Académique Documents
Professionnel Documents
Culture Documents
Exercices 4 Suivi Temporel
Transféré par
The KuuCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices 4 Suivi Temporel
Transféré par
The KuuDroits d'auteur :
Formats disponibles
CHIMIE / Unité :1
LA TRANSF. D'UN
SYSTEME CHIMIQUE
EST-ELLE TOUJOURS
RAPIDE
EXERCICE 1
Pour mesurer la quantité d’alcool dans le sang, on utilise la réaction chimique suivante :
3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16 H+(aq) 3 CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l).Cette réaction est lente,
son évolution est suivie par dosage.
À la date t = 0, on mélange vp=2mL de sang prélevé au bras d’un conducteur avec v= 10mL d’une solution
aqueuse acidifiée de dichromate de potassium (2K+ + 2 Cr2O72-(aq)) de concentration molaire C=2.10–2 mol.L‐1.
Le volume total du mélange réactionnel est VM = 12 mL.
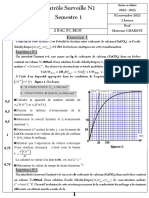
Un suivi temporel obtenu par dosage des ions dichromate Cr2O72‐ a permis de tracer la courbe suivant.
1- Établir le tableau d’avancement du système en désignant par n0 la quantité de matière initiale
d’alcool présente dans les 2mL de sang, et par n1 la quantité de matière initiale en ions dichromate introduite
dans le mélange réactionnel.(L’ion H+ est en excès).
2- Quelle relation existe entre l’avancement x de la
réaction, la concentration en ions dichromate [Cr2O72–]
dans le mélange, le volume VM du mélange réactionnel, et
la quantité n1 ?
3- La réaction peut être considérée comme totale. À l’aide
du graphique [Cr2O72–] = f(t), calculer l’avancement
maximal.
4- Le taux autorisé d’alcool est de 0,5 g dans 1 L de sang.
Le conducteur est‐il en infraction ?
5- Donner la définition de la vitesse de la réaction.
6- Déterminer sa valeur à l’instant initial.
Données :
Masse molaire moléculaire de l’éthanol : 46 g.mol‐1.
EXERCICE 2
On considère la transformation modélisée par la réaction
dont l’équation d’oxydoréduction s’écrit :
HO
2 + 2 I- (aq) + 2 H+
2 (aq) (aq) I
2 (aq) + 2H O
2 (l)
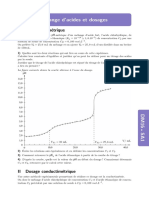
Un suivi cinétique temporel a permis de tracer la courbe
[I2] = f(t) a donné la courbe suivante.
Afin de réaliser ce suivi cinétique :
‐ On prépare une solution S1 (concentration c1) 10 fois
moins concentrée que la solution S0 d’eau oxygénée
commerciale de concentration c0;
‐ On mélange dans un bécher, V=5 mL d’acide sulfurique
et V2=9 mL d’une solution aqueuse d’iodure de
potassium, K+(aq)+I–(aq) de concentration C.
‐ à l’instant de date t0 = 0 s, on introduit rapidement, dans ce bécher, un volume V1=1mL de la solution S1 d’eau
oxygénée H2O2 (aq).(Les ions iodure I ‐(aq) et les ions oxonium H3O+(aq) sont introduits en excès).
1- Dresser en utilisant les notations de l’énoncé un tableau descriptif de l’évolution du système.
2- À l’aide de ce tableau, établir l’expression de l’avancement x(t) de la réaction en fonction de [I2](t), la
concentration molaire en diiode présent dans le milieu réactionnel et de volume du mélange Vtot.
3- Exprimer la vitesse instantanée v de la réaction en fonction de [I2].
4- On note v0 la vitesse de réaction à l’instant de date t0 = 0 min et v1 celle à l’instant de date t1=5min.
Comparer v1 et v0.Interpréter.
5- À partir des résultats expérimentaux, déterminer la valeur de l’avancement final x f de la transformation
étudiée.
6- Définir puis déterminer graphiquement la valeur du temps de demi‐réaction t1/2 en faisant apparaître
clairement la méthode utilisée.
7- On refait la même expérience en utilisant les mêmes volumes mais la solution d’eau oxygénée 5 fois moins
concentrée que la solution S0 d’eau oxygénée commerciale de concentration c0.
Représenter sur le même graphe la courbe de variation de la concentration de [I2]=f(t).Justifier.
Vous aimerez peut-être aussi
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Equilibre Esterification-Hydrolyse PDFDocument7 pagesEquilibre Esterification-Hydrolyse PDFAzizElheniPas encore d'évaluation
- Soutien Scolaire TC PDFDocument4 pagesSoutien Scolaire TC PDFsine abdellah100% (1)
- Examens Nationaux de 2008 À 2021 - PCTIZNIT PDFDocument194 pagesExamens Nationaux de 2008 À 2021 - PCTIZNIT PDFMaroua SekkoutPas encore d'évaluation
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImenePas encore d'évaluation
- Segment 001 de Examen-Blanc-N2-Pc-2emebacDocument2 pagesSegment 001 de Examen-Blanc-N2-Pc-2emebacAdil NomadPas encore d'évaluation
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 pagesExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalPas encore d'évaluation
- Examen National 2016 Session Normal-SVTDocument6 pagesExamen National 2016 Session Normal-SVTMohamed El OuahdaniPas encore d'évaluation
- Mo, N Control Controle 1 - 1 S1 2 Bac FRDocument3 pagesMo, N Control Controle 1 - 1 S1 2 Bac FRMed Brini0% (1)
- Série 1Document4 pagesSérie 1saidisalma412Pas encore d'évaluation
- c2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma)Document2 pagesc2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma)HAMADA1972100% (1)
- 2 Bac Devoir Electrolyse MécaniqueDocument4 pages2 Bac Devoir Electrolyse MécaniquerihabPas encore d'évaluation
- Chute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof OthmaneDocument18 pagesChute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof Othmanemohamedelhafhouf2006Pas encore d'évaluation
- Dipole RL Prof - Sbiro (WWW - Pc1.ma)Document5 pagesDipole RL Prof - Sbiro (WWW - Pc1.ma)lahcen essPas encore d'évaluation
- Ob S2-Cin-ChimiqueDocument3 pagesOb S2-Cin-ChimiqueManar Bahi100% (2)
- Concours Blanc 2 MedecineDocument3 pagesConcours Blanc 2 MedecinePaul Eric EkoaPas encore d'évaluation
- TD Lorentz 2019 LSLL WahabdiopDocument4 pagesTD Lorentz 2019 LSLL Wahabdiopbip100% (1)
- Transformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Document2 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Amine AlaoUii AlaouiPas encore d'évaluation
- Examens Nationaux PC de 2008 À 2022 ELHAFYANI BMSDocument212 pagesExamens Nationaux PC de 2008 À 2022 ELHAFYANI BMSFatima zahra sbissiiiPas encore d'évaluation
- Noyau Masse Energie PDFDocument4 pagesNoyau Masse Energie PDFHadjer Jojo100% (1)
- Examen National Physique Chimie SPC 2010 Normale SujetDocument6 pagesExamen National Physique Chimie SPC 2010 Normale SujetŤăhã ÊìîPas encore d'évaluation
- Série D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienDocument2 pagesSérie D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienInass LayachPas encore d'évaluation
- Corrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Document4 pagesCorrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Riadh MarouaniPas encore d'évaluation
- Cours 5 C TRAFI 2BACDocument18 pagesCours 5 C TRAFI 2BACEnidroun OutPas encore d'évaluation
- S Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFDocument3 pagesS Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFmaanane maananePas encore d'évaluation
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- Examen Blanc PC Prof AitouarabDocument8 pagesExamen Blanc PC Prof Aitouarabmohamed laghribPas encore d'évaluation
- Exercices 5 Suivi TemporelDocument1 pageExercices 5 Suivi TemporelMajed GharibPas encore d'évaluation
- Serie 2 Suivi 1234Document4 pagesSerie 2 Suivi 1234Ibtissam AttaouanziPas encore d'évaluation
- Bac Blan de Ndongo 2021Document5 pagesBac Blan de Ndongo 2021Amadou Makhtar SeckPas encore d'évaluation
- Série D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI Ezedinejuini rawiaPas encore d'évaluation
- Série Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1Document8 pagesSérie Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1chadaPas encore d'évaluation
- Chapitre3-Exercice Cinematique Dynamique NewtonDocument8 pagesChapitre3-Exercice Cinematique Dynamique Newtonالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Controle N1 2BAC PC BIOF 22 OmarDocument4 pagesControle N1 2BAC PC BIOF 22 Omarassad saisPas encore d'évaluation
- DS 2001 11 13Document2 pagesDS 2001 11 13الغزيزال الحسن EL GHZIZAL Hassane0% (1)
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 pagesDM16 1112 - Dosage PH Metrique Es PDFEmma LovaPas encore d'évaluation
- La Concentration Et Les Solutions Electrolytiques Cours 2 4Document9 pagesLa Concentration Et Les Solutions Electrolytiques Cours 2 4Smove OnerPas encore d'évaluation
- Série D'exercices 8, Dipôle RLC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Chtoukaphysique PDFDocument9 pagesSérie D'exercices 8, Dipôle RLC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Chtoukaphysique PDFkhaled nawiPas encore d'évaluation
- Série D'exercices - Physique - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal AliDocument9 pagesSérie D'exercices - Physique - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal AliChili 1111Pas encore d'évaluation
- Gsa 2bac 1819 Eb2 PCF PCDocument5 pagesGsa 2bac 1819 Eb2 PCF PCHAMADA1972Pas encore d'évaluation
- AvancementDocument2 pagesAvancementYoussef Ben AmarPas encore d'évaluation
- Fiches Exercices Titrages-2010Document3 pagesFiches Exercices Titrages-2010Daniel Parnor100% (1)
- 01 Bac Physchimie D Ci PDFDocument3 pages01 Bac Physchimie D Ci PDFSarah Amah AdomPas encore d'évaluation
- Correction CPR 2013Document18 pagesCorrection CPR 2013Hamid El Bouabidi0% (2)
- Devoir de Contrôle N°2 Lycée Pilote - Sciences Physiques - Bac Technique (2012-2013) MR Imed RADHOUANIDocument6 pagesDevoir de Contrôle N°2 Lycée Pilote - Sciences Physiques - Bac Technique (2012-2013) MR Imed RADHOUANIKhalil Bkekri0% (1)
- 2010 AmNord Exo1 Correction Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Correction Eau 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Exercices Devoir 2Document3 pagesExercices Devoir 2mohamed isoulghenPas encore d'évaluation
- Série, Les Ondes LumineusesDocument6 pagesSérie, Les Ondes LumineusesTEST - TEST0% (1)
- Résumé Équilibre ChimiqueDocument4 pagesRésumé Équilibre ChimiqueMehdi BnmssdPas encore d'évaluation
- Etat D'équilibreDocument2 pagesEtat D'équilibrela physique selon le programme Français100% (1)
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Technique (2020-2021) MR Foued BahlousDocument4 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Technique (2020-2021) MR Foued BahlousKhalil BkekriPas encore d'évaluation
- مواضيع البكالوريا ل موريطانيا من 2002إلى 2012 PDFDocument177 pagesمواضيع البكالوريا ل موريطانيا من 2002إلى 2012 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices 7 Suivi TemporelDocument1 pageExercices 7 Suivi Temporelكورة لايفPas encore d'évaluation
- Ds1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Document4 pagesDs1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Zaid ChPas encore d'évaluation
- DS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)Document4 pagesDS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)allach mohamedPas encore d'évaluation
- ? Série N°3 - Dipôle RCDocument5 pages? Série N°3 - Dipôle RCAsma GhPas encore d'évaluation
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- Exercices 4 Suivi TemporelDocument1 pageExercices 4 Suivi TemporelOmar HibaPas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- D'une: Cu SODocument2 pagesD'une: Cu SOThe KuuPas encore d'évaluation
- Les Fonctions Sinus Et Cosinus Schema ResumeDocument2 pagesLes Fonctions Sinus Et Cosinus Schema ResumeThe KuuPas encore d'évaluation
- Cours IV - Logarithm NeperinDocument5 pagesCours IV - Logarithm NeperinThe KuuPas encore d'évaluation
- EXOS - Logarithme NeperienDocument2 pagesEXOS - Logarithme NeperienThe KuuPas encore d'évaluation
- EXOS V - Les Nombres ComplexDocument1 pageEXOS V - Les Nombres ComplexThe KuuPas encore d'évaluation
- Cours V - Les Nombres ComplexDocument12 pagesCours V - Les Nombres ComplexThe KuuPas encore d'évaluation
- Cours V - Les Nombres Complex (Introduction)Document5 pagesCours V - Les Nombres Complex (Introduction)The KuuPas encore d'évaluation
- Étude Théorique Des Performances D'une Pompe À Chaleur À Adsorption Zéolithe-Eau Alimentée Par Un Capteur SolaireDocument102 pagesÉtude Théorique Des Performances D'une Pompe À Chaleur À Adsorption Zéolithe-Eau Alimentée Par Un Capteur SolaireLahouari FatahPas encore d'évaluation
- 5 CorrectionDocument4 pages5 CorrectionRayen AbPas encore d'évaluation
- Série #01: Examen Blanc, C. U. El-Oued: 2008/2009Document2 pagesSérie #01: Examen Blanc, C. U. El-Oued: 2008/2009Fatïma ZohraPas encore d'évaluation
- Mécanique Quantique-1Document185 pagesMécanique Quantique-1Lionel PolesePas encore d'évaluation
- SVT Tempêtes TropicalesDocument4 pagesSVT Tempêtes TropicalesGachaTalePas encore d'évaluation
- Oplb Lexique La Me Te OrologieDocument6 pagesOplb Lexique La Me Te OrologieBERNIERPas encore d'évaluation
- Guide de Planification Du Cours de Mécanique Appliquée en Première E, F1, MA, MEMDocument33 pagesGuide de Planification Du Cours de Mécanique Appliquée en Première E, F1, MA, MEMESSOME ESSOME OLIVIER STEPHANEPas encore d'évaluation
- c2s - Generalites Sur Les Solutions AqueusesDocument7 pagesc2s - Generalites Sur Les Solutions AqueusesAhamadi ElhouyounPas encore d'évaluation
- Atome Fiche Cours CH 1+2Document7 pagesAtome Fiche Cours CH 1+2yassin jarrayaPas encore d'évaluation
- Sous Les Feux Du Soleil. Vers Une Meteorologie de L EspaceDocument248 pagesSous Les Feux Du Soleil. Vers Une Meteorologie de L EspaceDahou MariaPas encore d'évaluation
- Méthode de Ritz Et Complément Au Principe de L'énergie PotentielleDocument7 pagesMéthode de Ritz Et Complément Au Principe de L'énergie Potentiellefadi eidPas encore d'évaluation
- Corrige TD Electrostatique Locale PDFDocument15 pagesCorrige TD Electrostatique Locale PDFMohamed Es-sedratyPas encore d'évaluation
- Champ G Et eDocument89 pagesChamp G Et eValdes Kouassi100% (1)
- CNC MP 2008 Physique 1 EpreuveDocument9 pagesCNC MP 2008 Physique 1 EpreuveHamid BOUDERKAPas encore d'évaluation
- InfrarougeDocument10 pagesInfrarougeChui RabebPas encore d'évaluation
- CH1 Caractéristique Du VentDocument5 pagesCH1 Caractéristique Du VentSalmi Nour E'ddinePas encore d'évaluation
- TB 26 Paleoclimats Fiche PDFDocument15 pagesTB 26 Paleoclimats Fiche PDFyyyyyPas encore d'évaluation
- TP TractionDocument9 pagesTP Tractionfathallah karimPas encore d'évaluation
- Portees Accreditees BTP - Version 08.07.2019 - 2019 - CompressedDocument258 pagesPortees Accreditees BTP - Version 08.07.2019 - 2019 - CompressedPaul Zephyrin AwonaPas encore d'évaluation
- Chimie Du Solide TD4Document5 pagesChimie Du Solide TD4mceciPas encore d'évaluation
- Rapport FinalDocument36 pagesRapport FinalSoufiane B. SS.Pas encore d'évaluation
- Cours N°4 3B4 Modele AtomiqueDocument4 pagesCours N°4 3B4 Modele AtomiqueKawthar FenniPas encore d'évaluation
- R944-R944B ProtocoleDocument6 pagesR944-R944B Protocolewtn2013Pas encore d'évaluation
- Chapitre 1 MHP IntroductionDocument11 pagesChapitre 1 MHP IntroductionMohammed ALMUSHIAAPas encore d'évaluation
- TP Fibre OptiqueDocument3 pagesTP Fibre OptiqueAmira SabPas encore d'évaluation
- Le Système SolaireDocument184 pagesLe Système Solaireimane baiouPas encore d'évaluation
- TensionDocument6 pagesTensionHasna AbPas encore d'évaluation
- 21 08 2014 - 14 35 51 - Abbyy11 PDFDocument159 pages21 08 2014 - 14 35 51 - Abbyy11 PDFdiana nistoranPas encore d'évaluation
- Brochure TP1 AdsorptionDocument3 pagesBrochure TP1 AdsorptionChakib ZouarPas encore d'évaluation
- Le FrottementDocument12 pagesLe FrottementGuy YgalPas encore d'évaluation