Académique Documents
Professionnel Documents
Culture Documents
Exercice S
Transféré par
s04855450 évaluation0% ont trouvé ce document utile (0 vote)
39 vues2 pagesTitre original
Exercice s
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
39 vues2 pagesExercice S
Transféré par
s0485545Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Lycée Abi Bakr Errazi Devoir Surveillé N°1 2Bac SPCF
A.S : 2022/2023 Semestre II Pr. Ahmed Boulouiha
❖ Physique : (12 points)
Certains dipôles électriques, comme les condensateurs et les bobines, permettent d’emmagasiner de
l’énergie, qui se dissipe progressivement au cours du temps. On peut compenser cette énergie dissipée en
utilisant des dispositifs adéquats.
On étudie, dans un premier temps, le comportement d’un
dipôle RC lors de la charge du condensateur, puis
dans un deuxième temps, l’amortissement et
l’entretien des oscillations dans un circuit RLC série.
Pour cela, on réalise le circuit électrique schématisé sur
la figure 1 qui comporte :
- un générateur de tension de f.é.m. 𝑬 ;
- Un conducteur ohmique de résistance 𝑹 ;
- une bobine (b) d’inductance 𝑳 et de résistance 𝒓𝒃 ;
- un condensateur de capacité 𝑪 initialement déchargé ;
- un interrupteur 𝑲 à double position.
Partie 1 : Etude du dipôle RC lors de la charge du condensateur
A un instant de date 𝒕 = 𝟎, on place l’interrupteur 𝑲 en position (1). Un système d’acquisition
informatisé permet de tracer la courbe d’évolution de la tension 𝒖𝑪 (𝒕). La droite (T) représente la
tangente à la courbe à la date 𝒕 = 𝟎. (Figure 2)
(1.5) 1.1. Etablir l’équation différentielle vérifiée par 𝒖𝑪 (𝒕).
1.2. Trouver les expressions de 𝑨 et de 𝝉 , pour que
(1.5) 𝒕
𝒖𝑪 (𝒕) = 𝑨. (𝟏 − 𝒆−𝝉 ) soit solution de cette équation
différentielle.
(1.25) 1.3. L’intensité du courant électrique s’écrit sous forme
𝒕
𝒊(𝒕) = 𝑰𝟎 . 𝒆−𝝉 . Trouver l’expression de 𝑰𝟎 en fonction
de 𝑬, 𝒓 et 𝑹.
1.4. En exploitant la courbe de la figure 2 :
(1)
1.4.1. Trouver la valeur de la résistance 𝑹 sachant que 𝑰𝟎 = 𝟎. 𝟐𝟎 𝑨.
(0.5)
1.4.2. Déterminer la valeur de 𝝉 .
(1) 1.4.3. Vérifier que la capacité du condensateur est 𝑪 = 𝟏𝟎𝝁𝑭.
Partie 2 : Etude de l’amortissement et de l’entretien des oscillations dans un circuit RLC
Une fois le condensateur est totalement chargé, on bascule l’interrupteur K vers la position (2) à
un instant que l’on choisira comme nouvelle origine des dates (𝒕 = 𝟎).
La courbe de la figure 3, représente l’évolution
temporelle de la charge 𝒒(𝒕) du condensateur.
(0.5) 2.1. Identifier le régime oscillatoire qui
correspond à la courbe de la figure 3.
(1) 2.2. On considère que la pseudo période égale
la période propre de l’oscillateur électrique,
déterminer l’inductance 𝑳 de la bobine (b).
2.3. Calculer ∆𝑬𝒕 , la variation de l’énergie
(1.5)
totale du circuit entre les instants 𝒕𝟏 = 𝟎 𝒎𝒔 et
𝒕𝟏 = 𝟏𝟖 𝒎𝒔 , puis interpréter ce résultat.
2.4. Pour entretenir les oscillations, on monte en série avec le condensateur et la bobine (b),
précédemment étudiés, un générateur (G) qui délivre une tension proportionnelle à l’intensité du
courant électrique : 𝒖𝑮 (𝒕) = 𝒌. 𝒊(𝒕).
(1.5) 2.4.1. Etablir l’équation différentielle vérifiée par la charge 𝒒(𝒕).
2.4.2. On obtient des oscillations électriques sinusoïdales lorsque la constante k prend la valeur
(0.75)
𝒌 = 𝟏𝟏 𝑺𝑰. En déduire la valeur de la résistance électrique 𝒓𝒃 de la bobine (b).
❖ Chimie : (8 points)
La méthylamine de formule semi-développée 𝑪𝑯𝟑−𝑵𝑯𝟐 est utilisée dans l’industrie Pharmaceutique
comme constituant de plusieurs produits tels que des antispasmodiques ou des anesthésiques ou comme
matière première pour la fabrication des insecticides.
Le but de l’exercice est l’étude d’une solution aqueuse de 𝑪𝑯𝟑 −𝑵𝑯𝟐 et son dosage par mesure
du pH.
Indicateur coloré Hélianthine Rouge de méthyle Phénophtaléine
Zone de virage 3.1 – 4.4 4.2 – 6.2 8.2 - 10
Partie 1 : Préparation la solution aqueuse de méthylamine
On prépare un volume 𝑽 = 𝟏𝑳 d’une solution aqueuse 𝑺𝑩 de méthylamine de concentration 𝑪𝑩 =
𝟏𝟎−𝟐 𝒎𝒐𝒍. 𝑳−𝟏 . La mesure du pH de la solution 𝑺𝑩 à 25 C° donne 𝒑𝑯 = 𝟏𝟏, 𝟑.
Donnée :
- Le produit ionique de l’eau à 25 C° : 𝑲𝒆 = 𝟏𝟎−𝟏𝟒 .
(0.5) 1.1. Ecrire l’équation de la réaction de la méthylamine avec l’eau.
(0.5) 1.2. Dresser le tableau d’avancement de la réaction.
(1) 1.3. Calculer le taux d’avancement final 𝝉 de cette réaction. Que peut-on déduire ?
1.4. Exprimer 𝑲 la constante d’équilibre de la réaction en fonction de C et τ, puis calculer sa
(1) valeur.
1.5. Trouver l’expression de la constante d’acidité 𝑲𝑨 du couple
(1) 𝑪𝑯𝟑 − 𝑵𝑯+ 𝟑(𝒂𝒒) ⁄𝑪𝑯𝟑 − 𝑵𝑯𝟐(𝒂𝒒) en fonction de 𝑲 et 𝑲𝒆 puis vérifier que 𝒑𝑲𝑨 ≈ 𝟏𝟎. 𝟕.
Partie 2 : Dosage d’une solution aqueuse de méthylamine.
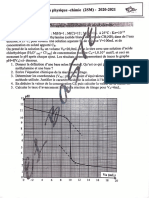
On réalise le dosage par 𝒑𝑯 − 𝒎é𝒕𝒓𝒊𝒒𝒖𝒆 d’un volume
𝑽𝑩 = 𝟏𝟎 𝒎𝑳 de la solution aqueuse 𝑺𝑩 de méthylamine
𝑪𝑯𝟑 −𝑵𝑯𝟐 de concentration 𝑪𝑩 par une solution aqueuse 𝑺𝑨
d’acide chlorhydrique (𝑯𝟑 𝑶+ −
(𝒂𝒒) + 𝑪𝒍(𝒂𝒒) ) de concentration
𝑪𝑨 = 𝟓. 𝟏𝟎−𝟐 𝒎𝒐𝒍. 𝑳−𝟏 . La courbe de la figure ci-contre
représente les variations du pH du milieu réactionnel en
fonction du volume versé 𝑽𝑨 de la solution 𝑺𝑨 .
(0.75) 2.1. Légender le dispositif expérimental du dosage ci-
contre.
(0.5) 2.2. Ecrire l’équation chimique modélisant ce
dosage.
(0.5) 2.3. Déterminer graphiquement les coordonnées
(𝑽𝒂𝑬 ,𝒑𝑯𝐸 ) du point d’équivalence.
(0.5) 2.4. Calculer la concentration molaire 𝑪
𝑩
2.5. Indiquer en justifiant, l’indicateur coloré
(0.5) convenable à la réalisation de ce dosage en
absence du pH-mètre.
[𝑪𝑯𝟑 −𝑵𝑯𝟐(𝒂𝒒)]
2.6. Déterminer le quotient +
pour le
(1) [𝑪𝑯𝟑 −𝑵𝑯𝟑(𝒂𝒒) ]
volume 𝑽𝑨 = 𝟏𝟎 𝒎𝑳 de la solution 𝑺𝑨 versée.
(0.5) 2.7. Déduire, en justifiant la réponse, l’espèce
chimique prédominante lorsque on ajoute 𝑽𝑨 = 𝟏𝟎 𝒎𝑳
Vous aimerez peut-être aussi
- Histoire de La Littérature FrançaiseDocument308 pagesHistoire de La Littérature FrançaiseBreno Gomes89% (9)
- 638db87da9cf6 - Enoncé-Devoir de Synthese N1Document10 pages638db87da9cf6 - Enoncé-Devoir de Synthese N1Imen Barhoumi0% (1)
- Disque Dur 2Document41 pagesDisque Dur 2fares cherniPas encore d'évaluation
- BAC BLANC - V FDocument7 pagesBAC BLANC - V FHAMADA1972100% (1)
- Examen Blanc SM Inter2222 PDFDocument8 pagesExamen Blanc SM Inter2222 PDFMouad Chaker100% (1)
- Les Exams Nationaux PC 2008-2019Document164 pagesLes Exams Nationaux PC 2008-2019바드 에딘Pas encore d'évaluation
- LMPS AUSIM Livre Blanc Classification Des DonnéesDocument20 pagesLMPS AUSIM Livre Blanc Classification Des DonnéesSucitu EmanuelPas encore d'évaluation
- Extraction Separation Et Identification Des Especes Chimiques Exercices Non Corriges 2 PDFDocument3 pagesExtraction Separation Et Identification Des Especes Chimiques Exercices Non Corriges 2 PDFmortadaPas encore d'évaluation
- Blanc N°1 2023Document7 pagesBlanc N°1 2023Alaoui AminePas encore d'évaluation
- L'educationDocument8 pagesL'educationIBrahima IB LengAniPas encore d'évaluation
- Devoir N 1SII 2021 Bac BiofDocument4 pagesDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Devoir de Contrôle N°1 - Physique - Bac Mathématiques (2011-2012) MR Timoumi Mohamed PDFDocument5 pagesDevoir de Contrôle N°1 - Physique - Bac Mathématiques (2011-2012) MR Timoumi Mohamed PDFMohamed Ouerghi100% (1)
- Le Feng Shui - Comment Aménager Sa Maison Façon - Feng ShuiDocument19 pagesLe Feng Shui - Comment Aménager Sa Maison Façon - Feng ShuikhassimPas encore d'évaluation
- Pages de Bac Blanc 2Document5 pagesPages de Bac Blanc 2Khaouda Driss100% (2)
- Devoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2016-2017) MR TRAYIA NABIL PDFDocument8 pagesDevoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2016-2017) MR TRAYIA NABIL PDFNour Al Islam0% (1)
- Examens Nationaux de 2008 À 2021 - PCTIZNIT PDFDocument194 pagesExamens Nationaux de 2008 À 2021 - PCTIZNIT PDFMaroua SekkoutPas encore d'évaluation
- Devoir Surveillé #1 Semestre 2, 2BAC BIOF, PC Et SM, 2019-2020, PR JENKAL RACHIDDocument3 pagesDevoir Surveillé #1 Semestre 2, 2BAC BIOF, PC Et SM, 2019-2020, PR JENKAL RACHIDMofid PCPas encore d'évaluation
- Bac Blan de Ndongo 2021Document5 pagesBac Blan de Ndongo 2021Amadou Makhtar SeckPas encore d'évaluation
- FR - Accreditation - Certification Requirements and Training GuideDocument14 pagesFR - Accreditation - Certification Requirements and Training GuideYoussef FatihiPas encore d'évaluation
- Devoir Maison 1 s2Document3 pagesDevoir Maison 1 s2ayoubPas encore d'évaluation
- Devoir N 1 S2Document2 pagesDevoir N 1 S2Mohamed ElouakilPas encore d'évaluation
- Devoir Survéillé #3 2eme Bac PC3 2022 - 2023 Prof - Said Kharacha (WWW - Pc1.ma)Document4 pagesDevoir Survéillé #3 2eme Bac PC3 2022 - 2023 Prof - Said Kharacha (WWW - Pc1.ma)yassioutaPas encore d'évaluation
- Nationaux PC 2008-2022Document209 pagesNationaux PC 2008-2022Adam AlfargaliPas encore d'évaluation
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- Sujet de Révision - Sciences Physiques - Bac Mathématiques, SC, Tech (2010-2011) MR MohamedDocument6 pagesSujet de Révision - Sciences Physiques - Bac Mathématiques, SC, Tech (2010-2011) MR Mohamedأبوأحمد الجزيريPas encore d'évaluation
- QFDocument4 pagesQFtigana100% (1)
- RCI 2017 BAC Serie D Physique ChimieDocument4 pagesRCI 2017 BAC Serie D Physique ChimieJunior RaymondPas encore d'évaluation
- Devoir Surveillé #3 Semestre 1, 2BAC BIOF, SP Et SVT, 2019-2020, PR JENKAL RACHID, Révision, ChtoukaphysiqueDocument3 pagesDevoir Surveillé #3 Semestre 1, 2BAC BIOF, SP Et SVT, 2019-2020, PR JENKAL RACHID, Révision, Chtoukaphysiquealgeriea210Pas encore d'évaluation
- Devoir de Niveau N°6 de Sciences Physiques: EXERCICE 1 (5 Points)Document3 pagesDevoir de Niveau N°6 de Sciences Physiques: EXERCICE 1 (5 Points)Japhet BAOUNDOULAPas encore d'évaluation
- 61295cc080954devoir 1 Physique Chimie Niveau Terminale D LyceeDocument3 pages61295cc080954devoir 1 Physique Chimie Niveau Terminale D LyceeJaphet BAOUNDOULAPas encore d'évaluation
- Controle 2 - 2 S1 2bac FRDocument3 pagesControle 2 - 2 S1 2bac FRsmail hallaouiPas encore d'évaluation
- N2008PCDocument6 pagesN2008PCmjidooooPas encore d'évaluation
- En PC Biof 2008 SNDocument6 pagesEn PC Biof 2008 SNEL MEHDI EL HAMDOUCHIPas encore d'évaluation
- C3s1biofpc 2019-2020Document2 pagesC3s1biofpc 2019-2020khalid el yacoubi0% (1)
- En PC Biof 2009 SNDocument7 pagesEn PC Biof 2009 SNEL MEHDI EL HAMDOUCHIPas encore d'évaluation
- 648cd3ea422fd - Enoncé Bac 2023 SCDocument13 pages648cd3ea422fd - Enoncé Bac 2023 SChamzaballoumi1Pas encore d'évaluation
- Wa0000.Document203 pagesWa0000.abb32214Pas encore d'évaluation
- Contrôle 1Document3 pagesContrôle 1Imene ImenePas encore d'évaluation
- 2008PC1Document6 pages2008PC1Khaouda DrissPas encore d'évaluation
- Simili 2024Document6 pagesSimili 2024Maryam OuachirPas encore d'évaluation
- Examen National Physique Chimie SPC 2015 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2015 Normale SujetYassin DaoudiPas encore d'évaluation
- Sujet 5Document6 pagesSujet 5Jihed HorchaniPas encore d'évaluation
- 2008PC1Document6 pages2008PC1Khaouda DrissPas encore d'évaluation
- 64654956134bc - Pack Révision Sujet 5 1Document13 pages64654956134bc - Pack Révision Sujet 5 1maramzakhamaPas encore d'évaluation
- Devoir 2Document3 pagesDevoir 2Anas100% (1)
- En PC Biof 2010 SRDocument6 pagesEn PC Biof 2010 SREL MEHDI EL HAMDOUCHIPas encore d'évaluation
- Contrôle 11 (PR EL FATIMY)Document2 pagesContrôle 11 (PR EL FATIMY)Arwa ElkamelPas encore d'évaluation
- Enoncéphysique 1Document5 pagesEnoncéphysique 1Houria MalloliPas encore d'évaluation
- D5 TS2 2021 RDKDocument3 pagesD5 TS2 2021 RDKAmadou Makhtar SeckPas encore d'évaluation
- Devoir 1 S2 AIT EL MADANEDocument4 pagesDevoir 1 S2 AIT EL MADANEothmane.zaariPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة العاديةDocument7 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة العاديةjouaitiPas encore d'évaluation
- Devoir Maison 1 S2Document4 pagesDevoir Maison 1 S2labiadsihame73Pas encore d'évaluation
- Devoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDDocument3 pagesDevoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDHiba NajiPas encore d'évaluation
- Devoir Surveillé #1 Semestre 2, 2BAC BIOF SM Et PC, 2020-2021, PR JENKAL RACHIDDocument3 pagesDevoir Surveillé #1 Semestre 2, 2BAC BIOF SM Et PC, 2020-2021, PR JENKAL RACHIDmeryemPas encore d'évaluation
- Bestcours NS 28FDocument8 pagesBestcours NS 28Frobi jungkookPas encore d'évaluation
- D4 TS1 2023 LVN - WahabdiopDocument4 pagesD4 TS1 2023 LVN - Wahabdiopsokhnamaimounadiop662004Pas encore d'évaluation
- RCI 2014 PC Serie DDocument5 pagesRCI 2014 PC Serie DAli marius Tiene100% (1)
- 628be6e12313b - Sujet - 3 - Physique Melloul Lele5erDocument11 pages628be6e12313b - Sujet - 3 - Physique Melloul Lele5erIlyes Ben Jemaa0% (1)
- Examen PC Juillet 2015 2bac FR (WWW - Adrarphysic.fr) - 2Document7 pagesExamen PC Juillet 2015 2bac FR (WWW - Adrarphysic.fr) - 2medPas encore d'évaluation
- Control 2 Officiel 3Document5 pagesControl 2 Officiel 3salma benmiledPas encore d'évaluation
- Contrôle 4 (PR Hammou Mouna)Document3 pagesContrôle 4 (PR Hammou Mouna)りきHibaPas encore d'évaluation
- SC - Physiques Bac Blanc - Maths-2021 (Jlali Ammar)Document5 pagesSC - Physiques Bac Blanc - Maths-2021 (Jlali Ammar)Ali SkimaPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - Bac Mathématiques (2016-2017) MR Jalel CHAKROUNDocument5 pagesDevoir de Contrôle N°2 - Sciences Physiques - Bac Mathématiques (2016-2017) MR Jalel CHAKROUNwalidPas encore d'évaluation
- Po SP - Tle D..HervéDocument3 pagesPo SP - Tle D..HervémarioagbozoPas encore d'évaluation
- Examen National 2021 Session normal-SPDocument8 pagesExamen National 2021 Session normal-SPAmmar LokihiPas encore d'évaluation
- Renault Logan SymbolDocument2 pagesRenault Logan SymbolkokondroPas encore d'évaluation
- Sup Livres 060309Document12 pagesSup Livres 060309tinderpaperPas encore d'évaluation
- Sin - Ax - Sin - BX - 2Document3 pagesSin - Ax - Sin - BX - 2Anton BaëzaPas encore d'évaluation
- Propos 20d 27introductionDocument2 pagesPropos 20d 27introductionJean Eddy OlibertPas encore d'évaluation
- Les Théories Explicatives Du Sous Développement 3Document2 pagesLes Théories Explicatives Du Sous Développement 3Moussa TaherPas encore d'évaluation
- Yves Denéchère - La Migration Singulière Des Adoptés Dans L'espace Euro-AméricainDocument9 pagesYves Denéchère - La Migration Singulière Des Adoptés Dans L'espace Euro-Américainhedoncdmx69Pas encore d'évaluation
- Détermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Document7 pagesDétermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Nelly RakotoPas encore d'évaluation
- 210-U-10 Polymères Et Résines CompositesDocument26 pages210-U-10 Polymères Et Résines CompositesBESSAIH RymPas encore d'évaluation
- TD 3 ArbreDocument4 pagesTD 3 ArbreOumaimaPas encore d'évaluation
- Dans Ce LabDocument3 pagesDans Ce LabDiana ZoboPas encore d'évaluation
- 1-Chapitre1-Cycle de Vie Et Decoupage D Un ProjetDocument19 pages1-Chapitre1-Cycle de Vie Et Decoupage D Un ProjettomasjosecaballeroPas encore d'évaluation
- Cours de Requete SpatialeDocument15 pagesCours de Requete SpatialePaul JuniorPas encore d'évaluation
- Gram. 34 Cours 1Document2 pagesGram. 34 Cours 1Kim MisoyaPas encore d'évaluation
- Rapport de Stage TT - TSIRA618 Hamri JassemDocument22 pagesRapport de Stage TT - TSIRA618 Hamri JassemHamri Zayneb100% (1)
- Le Design SensorielDocument2 pagesLe Design SensorielLeakim MaëlPas encore d'évaluation
- Circuit Gaz Condensation - ConvertiDocument23 pagesCircuit Gaz Condensation - ConvertiZoheir ChaouliPas encore d'évaluation
- TP Vérification Expérimentale Du Théorème de Lénergie CinétiqueDocument2 pagesTP Vérification Expérimentale Du Théorème de Lénergie Cinétiquerneji0400Pas encore d'évaluation
- Cahier de Douai -Arthur RimbaudDocument7 pagesCahier de Douai -Arthur RimbaudRanime AltaweelPas encore d'évaluation
- Les Troubles de L'odorat (Ok)Document17 pagesLes Troubles de L'odorat (Ok)EbePas encore d'évaluation
- Daf Liste Editions Et Exemplaires Bif Version Site 2016Document6 pagesDaf Liste Editions Et Exemplaires Bif Version Site 2016Ernst LudwigPas encore d'évaluation
- Rapport Finale PDFDocument58 pagesRapport Finale PDFmohamedPas encore d'évaluation
- Samba Serveur Contrôleur de DomaineDocument16 pagesSamba Serveur Contrôleur de DomaineRANDRIANASOLO FrancoPas encore d'évaluation
- Fuite Des Cerveaux, Le Mal Qui Ronge L'afriqueDocument2 pagesFuite Des Cerveaux, Le Mal Qui Ronge L'afriqueGilbertOumPas encore d'évaluation