Académique Documents
Professionnel Documents
Culture Documents
AL4SP41TEWB0111 Sequence 04 PDF
Transféré par
VoilalebeaucielbleuTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
AL4SP41TEWB0111 Sequence 04 PDF
Transféré par
VoilalebeaucielbleuDroits d'auteur :
Formats disponibles
Sommaire
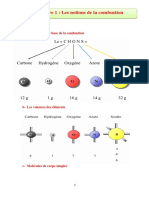
Séquence 4
La combustion du méthane
La combustion du butane
Séance 1 La combustion du méthane
Séance 2 Les atomes pour comprendre la combustion du méthane
Séance 3 La combustion du butane
Séance 4 Je fais le point sur la séquence 4
76 — © Cned, Physique - Chimie 4e
séance 1 — Séquence 4
Séance 1
La combustion du méthane
A Que vais-je apprendre dans cette séance ?
Si tu as une gazinière chez toi, alors tu as déjà assisté à la combustion du méthane : en effet,
le gaz méthane est le principal constituant du gaz naturel (plus de 90 %). D’ailleurs, pour
simplifier, dans la suite du cours, le gaz naturel sera appelé méthane.
Dans cette séance, tu vas découvrir comment brûle le méthane.
B Je découvre
Étude de documents
Document n°1 : La combustion du méthane dans une gazinière
Le phénomène le plus visible quand du méthane brûle, c’est la flamme bleue (fig.1) :
Fig. 1
Mais quels sont les réactifs de cette combustion ? Il y a évidemment le méthane mais aussi,
comme dans toute combustion, le dioxygène, lequel provient de l’air.
Le méthane arrive, en grande quantité, par le « tuyau de gaz ». Par rapport à cette quantité
de méthane, le dioxygène présent dans l’air ambiant au niveau de la flamme n’est pas en
quantité suffisante pour permettre la combustion. C’est pourquoi un brûleur de gazinière
est conçu pour aspirer de l’air en grande quantité et le mélanger au méthane avant que ne se
produise la flamme.
La figure 2 montre comment les deux réactifs se mélangent. Le méthane arrivant par le tuyau
de gaz passe dans un « injecteur » : c’est une pièce munie d’une sortie très étroite, ce qui fait
que le méthane en sort à grande vitesse et faible pression. Cette faible pression provoque un
© Cned, Physique - Chimie 4e — 77
Séquence 4 — séance 1
effet d’aspiration, et l’air frais entre ainsi par les côtés du brûleur. L’air et le méthane, bien
mélangés, sortent par les petits trous en haut du brûleur, où ils s’enflamment.
Fig. 2
Exercice 1 - Question de réflexion
Réponds à la question posée, puis étudie la correction.
Le mélange air-méthane ne peut s’enflammer (à température ambiante) que si le méthane
représente environ 10 % du volume total du mélange. Le méthane étant un gaz, la
proportion en molécules est la même que la proportion en volume, soit 10 %.
Imagine 100 molécules de mélange air-méthane. Calcule le nombre de molécules de chacun
des gaz contenus dans ce mélange.
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
Document n°2 : La combustion du méthane dans un bec Bunsen
Le bec Bunsen est un appareil de chauffage au gaz très utilisé en travaux pratiques dans les
lycées (fig. 3).
Fig. 3
78 — © Cned, Physique - Chimie 4e
séance 1 — Séquence 4
Les deux réactifs sont, comme pour la gazinière, le méthane et le dioxygène. La figure 4
montre comment s’effectue leur mélange :
flamme
Fig. 4
Le méthane arrive par un injecteur, semblable à celui de la gazinière. L’air est aspiré par les
trous de la virole, une pièce en forme de cylindre percée de trous qui, selon comment on la
tourne, laisse entrer plus ou moins d’air. Le mélange air-méthane s’enflamme en haut de la
cheminée.
Exercice 2 - Recherche documentaire
Réponds à la question posée, puis étudie la correction.
Bunsen est le nom d’un célèbre chimiste. Recherche dans une encyclopédie sa nationalité, le
siècle auquel il a vécu, et une ou deux de ses découvertes. A-t-il inventé le bec qui porte son
nom ?
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 79
Séquence 4 — séance 1
Activité expérimentale
Expériences avec un bec Bunsen
Dans un bec Bunsen, le réglage de la virole est très important. Si ses trous sont grands
ouverts (l’entrée d’air – donc de dioxygène – est alors maximale), la flamme est bleue : on
appelle cela une combustion complète (fig. 5). Si ses trous sont refermés, la flamme est
jaune : on appelle cela une combustion incomplète (fig. 6).
Fig. 5 Fig. 6
80 — © Cned, Physique - Chimie 4e
séance 1 — Séquence 4
Nous allons étudier quels sont les produits de la réaction lorsque la combustion est
complète.
Plaçons un ballon retourné au-dessus de la flamme. Ainsi on peut récupérer les gaz produits
par la flamme, puisque ces gaz chauds s’élèvent.
On observe que de la buée, faite de fines gouttelettes d’eau, se dépose sur la paroi intérieure
du ballon (fig. 7). On peut en conclure que la combustion complète du méthane produit de
la vapeur d’eau. (D’ailleurs, tu as sûrement déjà remarqué la formation de buée sur les vitres
de la cuisine quand la gazinière fonctionne même s’il n’y a rien sur le feu.)
Fig. 7
Puis renversons le ballon et versons de l’eau de chaux : elle blanchit (fig. 8). On peut en
conclure que la combustion complète du méthane produit du dioxyde de carbone.
Fig. 8
De nombreuses études ont montré qu’il n’y a pas d’autre produit de réaction.
© Cned, Physique - Chimie 4e — 81
Séquence 4 — séance 1
Exercice 3 - Question de réflexion
Réponds aux questions posées, puis étudie la correction de cet exercice très important.
Exprime l’équation chimique de la combustion complète du méthane :
1- par une équation chimique écrite avec des mots :
. .....................................................................................................................................
2- par une phrase :
. .....................................................................................................................................
j e retiens
• Le méthane est le principal constituant du gaz naturel.
• Quand la combustion du méthane donne une flamme bleue, on dit que cette
combustion est « complète ». Pour que la combustion soit complète, il faut que le
dioxygène soit en quantité abondante.
• L’équation chimique de la combustion complète du méthane est :
méthane + dioxygène dioxyde de carbone + eau
C Je vérifie mes connaissances
Exercice 4 – Oui ou non
Coche la case correspondant à ta réponse, puis vérifie la correction.
Oui Non
Le principal constituant du gaz naturel est-il le méthane ? ® ®
Le principal constituant du gaz naturel est-il le butane ? ® ®
Le méthane a-t-il besoin de dioxygène pour brûler ? ® ®
Dans un brûleur, le mélange air-méthane se fait-il avant la flamme ? ® ®
Quand la combustion du méthane donne une flamme bleue, peut-on
® ®
dire que cette combustion est incomplète ?
Quand la combustion du méthane donne une flamme bleue, peut-on
® ®
dire que cette combustion est complète ?
L’équation chimique de la combustion complète du méthane est-elle :
® ®
méthane + dioxygène eau + dioxyde de carbone ?
L’équation chimique de la combustion complète du méthane est-elle :
® ®
méthane + dioxygène dioxyde de carbone + eau ?
Pour récupérer les gaz produits par la combustion du méthane, suffit-il
® ®
de placer un ballon retourné au-dessus de la flamme ?
82 — © Cned, Physique - Chimie 4e
séance 1 — Séquence 4
D J’approfondis
Exercice 5 – Recherche documentaire
Recherche l’information demandée dans une encyclopédie ou sur Internet. Réponds par des
phrases bien rédigées, puis vérifie la correction.
1- Où le gaz naturel se trouve-t-il dans la nature ?
. .....................................................................................................................................
2- Quels sont les pays auxquels la France achète du gaz naturel ?
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 83
Séquence 4 — séance 2
Séance 2
Les atomes pour comprendre
la combustion du méthane
A Que vais-je apprendre dans cette séance ?
Dans cette séance, tu vas apprendre à écrire l’équation chimique de la combustion complète
du méthane au moyen des formules chimiques.
B Je découvre
Étude de documents
Lis attentivement le texte ci-dessous, et fais les exercices demandés au fur et à mesure.
Document n° 1 : La molécule de méthane
La figure 9 représente la molécule de méthane. Elle est constituée d’un atome de carbone
(couleur symbolique : noir) sur lequel sont fixés quatre atomes d’hydrogène (couleur
symbolique : blanc).
Fig. 9
Exercice 6 - Question de réflexion
Réponds à la question, puis étudie la correction.
D’après la figure 9, trouve la formule chimique du méthane.
. .....................................................................................................................................
Document n° 2 : L’équation chimique de la combustion complète du méthane
On a vu dans la séance précédente que le méthane, en présence de dioxygène abondant,
brûle avec une flamme bleue : on appelle cela une combustion complète. L’équation
chimique de la combustion complète du méthane est :
méthane + dioxygène dioxyde de carbone + eau
84 — © Cned, Physique - Chimie 4e
séance 2 — Séquence 4
Cette équation se lit de la façon suivante : « Le méthane réagit avec le dioxygène pour
donner du dioxyde de carbone et de l’eau ».
La figure 10 représente l’équation chimique au moyen des maquettes de molécules :
Fig. 10
Exercice 7 - Question de réflexion
Réponds à la question, puis étudie la correction.
D’après la figure 10, écris l’équation chimique de la combustion du méthane avec les
formules chimiques.
. .....................................................................................................................................
Document n° 3 : Ajuster l’équation chimique de la combustion complète du méthane
L’équation chimique telle qu’elle est représentée à la figure 10 pose une difficulté. En effet,
elle contredit la règle apprise dans la séquence sur la combustion du carbone, règle qui dit
que les atomes des réactifs se retrouvent intégralement dans les produits de réaction. Or,
sur l’équation de la figure 10, nous voyons :
- dans les réactifs : 1 atome de carbone, 4 atomes d’hydrogène, 2 atomes d’oxygène
- dans les produits de réaction : 1 atome de carbone, 2 atomes d’hydrogène, 3 atomes
d’oxygène
On dit que « l’équation chimique n’est pas ajustée ». Pour l’ajuster, la seule possibilité
permise est de modifier le nombre de molécules dans les réactifs ou dans les produits de
réaction. Cette modification est représentée sur la figure 11 :
Fig. 11
En faisant ainsi, on n’a pas changé la nature des réactifs (il n’y a que des molécules de
méthane et de dioxygène) ni des produits de réaction (il n’y a que des molécules de dioxyde
de carbone et d’eau). Et l’équation est bien ajustée :
- dans les réactifs : 1 atome de carbone, 4 atomes d’hydrogène, 4 atomes d’oxygène
- dans les produits : 1 atome de carbone, 4 atomes d’hydrogène, 4 atomes d’oxygène
Avec les formules chimiques, l’équation s’écrit maintenant :
CH4 + 2 O2 CO2 + 2 H2O
© Cned, Physique - Chimie 4e — 85
Séquence 4 — séance 2
Il faut faire bien attention à la signification des chiffres dans cette équation :
- Les chiffres écrits en grand devant les formules chimiques désignent les nombres de
molécules : par exemple 2 O2 signifie 2 molécules de dioxygène. Ces chiffres sont
appelés coefficients de l’équation.
- Les chiffres écrits en petit et en bas désignent les nombres d’atomes dans la molécule
concernée : dans CH4 par exemple, le chiffre 4 veut dire 4 atomes d’hydrogène dans la
molécule de méthane.
Mais, en définitive, pourquoi faut-il ajuster les équations chimiques ? Autrement dit, qu’est-
ce qui prouve que les atomes des réactifs se retrouvent intégralement dans les produits de
réaction ?
Comme on l’a vu dans la séquence sur la combustion du carbone, les chimistes ont constaté
qu’il y a toujours conservation de la masse lors d’une réaction chimique. Et si la masse est
conservée, c’est justement parce qu’il y a conservation des atomes (ce qui signifie que les
atomes présents dans les réactifs se retrouvent intégralement dans les produits de réaction :
aucun atome n’est perdu, aucun n’est créé pendant une transformation chimique).
Exercice 8 - Questions sur le texte
Réponds aux questions, puis étudie la correction.
1- Écris l’équation chimique de combustion complète du méthane dans le dioxygène :
a) avec des mots :
. .....................................................................................................................................
b) avec des schémas de molécules (équation chimique ajustée) :
. .....................................................................................................................................
c) avec des formules chimiques (équation chimique ajustée) :
. .....................................................................................................................................
2- À quelle condition peut-on dire qu’une équation chimique est ajustée ?
. .....................................................................................................................................
3- Pour ajuster une équation chimique, que peut-on faire ?
. .....................................................................................................................................
4- Voici une équation chimique :
C3H8 + 5 O2 3 CO2 + 4 H2O
a) Que signifie le chiffre 5 qui apparaît dans cette équation ?
b) Que signifie le chiffre 8 qui apparaît dans cette équation ?
. .....................................................................................................................................
c) Cette équation te semble-t-elle ajustée ?
. .....................................................................................................................................
86 — © Cned, Physique - Chimie 4e
séance 2 — Séquence 4
j e retiens
• La formule chimique du méthane est CH4
• Pour qu’une équation chimique soit ajustée, il faut que les atomes présents dans les
réactifs se retrouvent intégralement dans les produits de réaction. On dit qu’il y a
conservation des atomes lors d’une réaction chimique.
• C’est parce qu’il y a conservation des atomes lors d’une transformation chimique qu’il y
a conservation de la masse.
• L’équation chimique ajustée de la combustion complète du méthane est :
CH4 + 2 O2 CO2 + 2 H2O
• Dans une équation chimique, les chiffres écrits en grand devant les molécules désignent
des nombres de molécules. Ceux écrits en petit et en bas à droite (en indice) désignent
les nombres d’atomes dans les molécules.
C Je vérifie mes connaissances
Exercice 9 – Oui ou non
Coche la case correspondante à ta réponse, puis vérifie la correction.
Oui Non
La formule chimique du méthane est-elle CH4 ? ® ®
La formule chimique du méthane est-elle C4H ? ® ®
Il faut ajuster les équations chimiques ; est-ce parce qu’il y a
® ®
conservation des molécules lors d’une réaction chimique ?
Il faut ajuster les équations chimiques ; est-ce parce qu’il y a
® ®
conservation des atomes lors d’une réaction chimique ?
Quand la combustion du méthane donne une flamme bleue, peut-on
® ®
dire que cette combustion est incomplète ?
Si dans une équation chimique se trouve écrit « 7 H2 O » le chiffre 7
® ®
veut-il dire 7 atomes d’hydrogène ?
Si dans une équation chimique se trouve écrit « 7 H2 O » le chiffre 7
® ®
veut-il dire 7 molécules d’eau ?
© Cned, Physique - Chimie 4e — 87
Séquence 4 — séance 2
Exercice 10
Réponds aux questions, puis vérifie la correction.
On représente la combustion du méthane à l’échelle des molécules :
1- Complète le tableau suivant :
Dessin de la
maquette de
l’atome
Nom de l’atome
Symbole
2- Quelle est l’indication de la balance après la combustion ? Justifie ta réponse en utilisant
la conjonction « DONC ».
.....................................................................................................................................
.....................................................................................................................................
.....................................................................................................................................
3- En t’aidant du schéma, écris l’équation chimique de la combustion du méthane.
.....................................................................................................................................
.....................................................................................................................................
Exercice 11
Réponds à la question, puis vérifie la correction.
La molécule de paracétamol est constituée de 8 atomes de carbone, 9 atomes d’hydrogène,
2 atomes d’oxygène et 1 atome d’azote. Parmi les propositions suivantes, choisis la formule
chimique de cette molécule.
Remarque, le symbole chimique de l’azote est N.
® 8C9H2O1N ?
® C8H9O2N ?
® C8H9O2N ?
88 — © Cned, Physique - Chimie 4e
séance 2 — Séquence 4
D J’approfondis
Étude de document
Lis attentivement le texte ci-dessous, puis fais le’exercice demandé.
Lavoisier et la conservation de la masse lors des réactions chimiques
Antoine-Laurent de Lavoisier est né le 26 août 1743 à Paris. Après de brillantes études en
mathématiques, chimie, botanique, médecine... il occupa des postes très importants dans
l’administration du royaume. Il fut en particulier Fermier Général, c’est-à-dire chargé de
récolter l’impôt. Mais sa passion était la chimie ; il entra à l’Académie des Sciences en 1768.
Lavoisier était très instruit et avait connaissance des recherches qui se faisaient à l’époque
en chimie, dans toute l’Europe. Son idée fut de reprendre les expériences en cours, en leur
apportant beaucoup plus de rigueur. En particulier, Lavoisier pesait systématiquement
et avec un très grand soin les réactifs et les produits de réaction. Pour cela, il avait fait
construire des balances très précises par les meilleurs artisans de Paris.
En 1777, Lavoisier démontre que l’air contient 20 % « d’air vital », que nous appelons
aujourd’hui dioxygène.
Et dans son traité de chimie paru en 1789, Lavoisier écrit : « [...] rien ne se crée, ni dans les
opérations de l’art, ni dans celles de la nature, et l’on peut poser en principe que, dans toute opération, il y
a une égale quantité de matière avant et après l’opération ; que la qualité et la quantité des principes est la
même, et qu’il n’y a que des changements, des modifications. »
On constate que cette phrase (écrite en termes de l’époque) exprime bien la conservation
de la masse lors d’une réaction chimique. D’ailleurs cette loi est souvent appelée « Loi de
Lavoisier ».
Exercice 12 – Recherche documentaire et question de réflexion
1- Comment la vie de Lavoisier s’est-elle terminée ? Cherche les réponses dans une encyclopédie ou
sur Internet.
. .....................................................................................................................................
2- Lis le texte ci-dessous, puis écris (avec des mots) l’équation chimique de la réaction qui
est décrite :
En 1785, Lavoisier réalise à Paris, devant un parterre de savants français et étrangers, une expérience
spectaculaire, avec l’aide de son collaborateur Jean-Baptiste Meusnier de La Place. Il remplit un grand
ballon de verre avec un mélange « d’air inflammable » (appelé aujourd’hui dihydrogène) et « d’air
vital » (appelé aujourd’hui dioxygène). Il enflamme le mélange au moyen d’une étincelle électrique.
Une explosion se produit, et l’on peut alors observer de la buée sur les parois intérieures du ballon.
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 89
Séquence 4 — séance 3
Séance 3
La combustion du butane
A Que vais-je apprendre dans cette séance ?
Dans cette séance, tu vas apprendre à écrire l’équation chimique de la combustion complète
du gaz butane.
B Je découvre
Étude de document
Lis attentivement le texte ci-dessous, et fais l’exercice demandé. Vérifie ensuite la correction.
Le butane
Le butane est un gaz que l’on extrait du pétrole lors d’une opération appelée raffinage.
Ensuite, pour le vendre, on le stocke dans des bouteilles ou des cartouches. Une bouteille
ou une cartouche de butane contient du butane liquide, surmonté de butane gazeux, prêt à
sortir par le haut du récipient (fig. 12) :
Fig. 12
Si une partie du butane est à l’état liquide, c’est parce qu’il est sous pression dans la
bouteille. En effet, comme on l’a vu dans la séquence 2 (revois cette séquence), quand on
comprime un gaz en diminuant son volume, on rapproche ses molécules. Et quand les
molécules arrivent à se toucher, c’est l’état liquide.
L’intérêt de stocker le butane à l’état liquide, c’est qu’il prend beaucoup moins de place que
le butane gazeux : 1 litre de butane liquide peut libérer 239 litres de butane gazeux à 15 °C.
De plus, il n’y a pas besoin d’une pression très élevée pour liquéfier le butane : moins de 2
bars.
Le butane présente cependant un inconvénient : si la température est inférieure à 0 °C
environ il ne se vaporise plus (il reste entièrement à l’état liquide) et ne peut plus sortir de la
bouteille ou de la cartouche.
90 — © Cned, Physique - Chimie 4e
séance 3 — Séquence 4
La figure 13 représente une maquette de la molécule de butane :
Fig. 13
Cette molécule comporte 4 atomes de carbone et 10 atomes d’hydrogène (on ne les voit
pas tous sur la fig. 13 car certains sont cachés derrière les atomes de carbone). La formule
chimique de la molécule de butane est donc C4H10
Exercice 13 - Questions sur le texte
Réponds aux questions par des phrases rédigées, puis vérifie la correction.
1- Que contient une bouteille ou une cartouche de butane ?
. .....................................................................................................................................
2- Quel est l’intérêt de stocker le butane à l’état liquide ?
. .....................................................................................................................................
3- Quelle est la pression dans une bouteille ou une cartouche de butane ?
. .....................................................................................................................................
4- Savoir calculer :
Une bouteille de butane a un volume intérieur de 1 litre. Quand elle est neuve, elle contient
une masse de 420 grammes de butane. Sachant que 1 litre de butane liquide a une masse
de 579 grammes (à température ambiante), calcule le volume de butane liquide dans la
bouteille.
Conseil : tu négligeras la masse du butane gazeux par rapport à celle du butane liquide.
. .....................................................................................................................................
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 91
Séquence 4 — séance 3
Activités expérimentales
Activité n° 1 : La combustion complète du butane
Différents appareils utilisent le butane comme combustible : réchaud de camping,
chalumeau (fig. 14), etc.
Fig. 14
Sur la fig. 14 on voit que la flamme est bleue : cette combustion du butane est complète.
Si l’on refait pour la combustion complète du butane les expériences décrites dans la séance
précédente pour la combustion complète du méthane, on constate que les produits de
réaction sont exactement les mêmes :
- de la vapeur d’eau
- du dioxyde de carbone
Exercice 14 – Question de réflexion
Réponds à la question posée, puis étudie la correction.
Écris, sans chercher à l’ajuster, l’équation chimique de la combustion complète du butane :
1- avec des mots :
. .....................................................................................................................................
2- avec les formules chimiques :
. .....................................................................................................................................
92 — © Cned, Physique - Chimie 4e
séance 3 — Séquence 4
Activité n° 2 : Ajustage de l’équation chimique de la
combustion complète du butane
L’équation chimique non ajustée est :
C4H10 + O2 CO2 + H2O
Voici, étape par étape, le raisonnement qui permet d’ajuster cette équation :
1- Dans les réactifs, il y a 4 atomes de carbone (dans C4H10). Dans les produits, il y a 1
seul atome de carbone (dans CO2). Pour rétablir l’équilibre, il faut 4 molécules de CO2 .
L’équation chimique devient :
C4H10 + O2 4 CO2 + H2O
2- Dans les réactifs, il y a 10 atomes d’hydrogène (dans C4H10). Dans les produits, il y a 2
atomes d’hydrogène (dans H2O). Pour rétablir l’équilibre, il faut 5 molécules de H2O .
L’équation chimique devient :
C4H10 + O2 4 CO2 + 5 H2O
3- L’équation chimique est maintenant ajustée en atomes de carbone et en atomes
d’hydrogène ; il reste à l’ajuster en atomes d’oxygène. Dans les réactifs, il y a 2 atomes
d’oxygène (dans O2). Dans les produits de réaction, il y a 8 atomes d’oxygène dans 4 CO2
(car 4 × 2 = 8) et 5 atomes d’oxygène dans 5 H2O (car 5 × 1 = 5), soit un total de 13
atomes d’oxygène. Pour rétablir l’équilibre, il faut 6,5 molécules de O2 (car 6,5 × 2 = 13).
L’équation chimique devient :
C4H10 + 6,5 O2 4 CO2 + 5 H2O
4- On pourrait laisser l’équation chimique comme cela. Mais le coefficient 6,5 n’est pas très
satisfaisant : une demi-molécule, ça n’existe pas ! Pour résoudre cette difficulté, il suffit
de multiplier tous les coefficients par 2, et l’équation devient :
2 C4H10 + 13 O2 8 CO2 + 10 H2O
5- Vérification :
- dans les réactifs : 8 atomes de carbone (4 × 2), 20 atomes d’hydrogène (2 × 10), 26
atomes d’oxygène (13 × 2)
- dans les produits : 8 atomes de carbone (8 × 1), 20 atomes d’hydrogène (10 × 2), 26
atomes d’oxygène ((8 × 2) + (10 × 1))
Exercice 15 – Vérifier la connaissance du cours
Complète, sans regarder le cours qui précède, les endroits en pointillés, puis vérifie dans le livret
des corrigés.
L’équation chimique non ajustée de la combustion du butane dans le dioxygène est :
C4H10 + O2 CO2 + H2O
1- Dans les réactifs, il y a …. atomes de carbone. Dans les produits, il y a …. atome de
carbone. Pour rétablir l’équilibre, il faut …. molécules de CO2 . L’équation chimique
devient :
C4H10 + O2 … CO2 + H2O
2- Dans les réactifs, il y a …. atomes d’hydrogène. Dans les produits, il y a …. atomes
d’hydrogène. Pour rétablir l’équilibre, il faut …. molécules de H2O . L’équation chimique
devient :
C4H10 + O2 …. CO2 + …. H2O
© Cned, Physique - Chimie 4e — 93
Séquence 4 — séance 3
3- L’équation chimique est maintenant ajustée en atomes de carbone et en atomes
d’hydrogène. Il reste à l’ajuster en atomes d’oxygène. Dans les réactifs, il y a …. atomes
d’oxygène. Dans les produits de réaction, il y a …. atomes d’oxygène dans 4 CO2 et ….
atomes d’oxygène dans 5 H2O , soit un total de …. atomes d’oxygène. Pour rétablir
l’équilibre, il faut …. molécules de O2 . L’équation chimique devient :
C4H10 + …. O2 …. CO2 + …. H2O
4- On pourrait laisser l’équation chimique comme cela. Mais le coefficient … n’est pas très
satisfaisant : une demi-molécule, ça n’existe pas ! Pour résoudre cette difficulté, il suffit
de multiplier tous les coefficients par 2, et l’équation devient :
C4H10 + … O2 …. CO2 + …. H2O
j e retiens
• Le butane a pour formule chimique C4H10
• Lors de la combustion complète du butane, les produits de réaction sont les mêmes
que lors de la combustion complète du méthane : de l’eau et du dioxyde de carbone.
• Il faut être capable d’ajuster une équation chimique.
C Je vérifie mes connaissances
Exercice 16 – Oui ou non
Coche la case correspondante à ta réponse, puis vérifie la correction.
Oui Non
La formule chimique du butane est-elle C4H6 ? ® ®
La formule chimique du butane est-elle C4H8 ? ® ®
La formule chimique du butane est-elle C4H10 ? ® ®
Une combustion complète nécessite-t-elle beaucoup de dioxygène ? ® ®
Lors de la combustion complète du butane, la flamme est-elle jaune ? ® ®
Lors de la combustion complète du butane, les produits de la réaction
® ®
sont-ils le carbone et le dioxyde de carbone ?
Cette équation chimique est-elle ajustée :
® ®
2 C4H10 + 13 O2 8 CO2 + 10 H2O ?
Cette équation chimique est-elle ajustée :
® ®
2 C4H10 + 12 O2 8 CO2 + 10 H2O ?
Cette équation chimique est-elle ajustée :
® ®
2 C4H10 + 14 O2 8 CO2 + 10 H2O ?
94 — © Cned, Physique - Chimie 4e
séance 3 — Séquence 4
Exercice 17
Lors d’une séance de travaux pratiques, un élève réalise la combustion du butane (gaz
contenu dans les briquets).
1- Complète la légende des schémas ci-dessous avec les mots :
buée, pince en bois, flamme bleue, briquet, tube à essai.
.............................
.............................
.............................
.............................
.............................
2- Ensuite, il retourne le tube à essai et y met de l’eau de chaux. Elle se trouble.
Complète le schéma suivant avec les mots : tube à essai, eau de chaux
.............................
.............................
3- Quels sont les réactifs de cette combustion ?
. .....................................................................................................................................
. .....................................................................................................................................
4- Quels sont les produits de cette combustion ? Justifie ta réponse.
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
5- Écris l’équation chimique de cette réaction (avec des mots).
. .....................................................................................................................................
D J’approfondis
Exercice 18 – Exercice de réflexion :
Réponds à la question posée, puis vérifie la correction.
Le propane est un gaz combustible dont la formule chimique est C3H8 . L’équation chimique
de la combustion complète du propane est (avec des mots) :
propane + dioxygène dioxyde de carbone + eau
Écris l’équation chimique avec les formules,
. .....................................................................................................................................
puis ajuste-la.
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 95
Séquence 4 — séance 4
Séance 4
Je fais le point sur la séquence 4
Exercice 19
Réponds aux questions posées, puis étudie la correction.
Dans cet exercice, nous allons étudier la combustion du méthane.
1- Associe un mot de la colonne de gauche à un mot de la colonne de droite.
Méthane
Eau Réactifs
Dioxyde de carbone Produits
Dioxygène
2- Écris l’équation chimique de cette combustion (avec des mots).
. .....................................................................................................................................
. .....................................................................................................................................
3- a) Comment peux-tu mettre en évidence le dioxyde de carbone obtenu lors de la
combustion du méthane ?
. .....................................................................................................................................
b) Pourquoi peux-tu affirmer que la combustion du méthane produit de l’eau ?
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
4- Si on brûle 16 g de méthane dans une quantité de dioxygène suffisante pour que la
combustion se fasse complètement, on obtient 44 g de dioxyde de carbone et 36 g d’eau.
Calcule la masse de dioxygène utilisé. Justifie ta réponse.
. .....................................................................................................................................
. .....................................................................................................................................
96 — © Cned, Physique - Chimie 4e
séance 4 — Séquence 4
Exercice 20
Réponds aux questions posées, puis étudie la correction.
On représente le modèle moléculaire du
vinaigre (acide éthanoïque) par :
1- Combien comptes-tu de sortes d’atomes différents dans ce modèle moléculaire ?
. .....................................................................................................................................
2- Complète le tableau suivant :
Dessin de la
maquette de
l’atome
Nom de l’atome
Symbole chimique
de l’atome
Nombre d’atomes
dans la molécule de
vinaigre
3- À partir du tableau, déduis l’écriture de l’acide éthanoïque sous la forme [CxHyOz]
. .....................................................................................................................................
Exercice 21
Réponds aux questions posées, puis étudie la correction.
Quelle est la bonne écriture ?
1- Trois atomes d’hydrogène : H3 ? 3 H ? H?
2- Deux molécules de dioxyde de carbone :
2 CO2 ? C2O4 ? CO2 ? C2O2 ?
© Cned, Physique - Chimie 4e — 97
Séquence 4 — séance 4
Exercice 22
Réponds aux questions posées, puis étudie la correction.
L’objectif de cet exercice est de justifier l’affirmation suivante : « Les combustions du
méthane et du propane ne nécessitent pas la même quantité de dioxygène ».
Dans le tableau suivant, les équations des différentes réactions ne sont pas ajustées.
Combustion du méthane Combustion du propane
CH4 + O2 CO2 + H2O C3H8 + O2 CO2 + H2O
Réactifs Produits Réactifs Produits
Carbone
Hydrogène
Oxygène
Nombre total
d’atomes
1- Compte le nombre d’atome(s) et complète les deux colonnes « réactifs ».
2- Compte le nombre d’atome(s) et complète les deux colonnes « produits ».
3- Pourquoi faut-il ajuster les coefficients des deux équations ?
. .....................................................................................................................................
4- En t’aidant du tableau, ajuste les différents coefficients des deux équations. Garde l’ordre
du tableau : tu commences par ajuster les atomes de carbone.
...CH4 + ...O2 ...CO2 + ...H2O
Tu peux expliquer ton choix :
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
Puis tu ajustes les atomes d’hydrogène
...CH4 + ...O2 ...CO2 + ...H2O
En expliquant ton choix :
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
et enfin les atomes d’oxygène :
...CH4 + ...O2 ...CO2 + ...H2O
En expliquant ton choix :
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
98 — © Cned, Physique - Chimie 4e
séance 4 — Séquence 4
Fais de même pour la deuxième équation :
...C3H8 + ...O2 ...CO2 + ...H2O
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
. .....................................................................................................................................
5- Justifie la phrase du début d’exercice « Les combustions du méthane et du propane ne
nécessitent pas la même quantité de dioxygène ». Pour cela compare les deux équations
ajustées.
. .....................................................................................................................................
. .....................................................................................................................................
© Cned, Physique - Chimie 4e — 99
Vous aimerez peut-être aussi
- Cours Fours Et Chaudières - Labsi 2018 - EtudiantsDocument23 pagesCours Fours Et Chaudières - Labsi 2018 - EtudiantsElHadi S Zidane67% (6)
- CHI5061-cahier-labos 2Document87 pagesCHI5061-cahier-labos 2Laxcya RNPas encore d'évaluation
- L'alchimie Simplifiée R.SchwaebleDocument65 pagesL'alchimie Simplifiée R.SchwaebleOlivier PERRINPas encore d'évaluation
- Séquence 04Document24 pagesSéquence 04maamar SebbarPas encore d'évaluation
- Cours - Les Atomes Dans Les Transformations ChimiquesDocument23 pagesCours - Les Atomes Dans Les Transformations ChimiquesKim AtuaPas encore d'évaluation
- Les CombustionsDocument5 pagesLes CombustionsMoussa El FatmiPas encore d'évaluation
- Exercices - Chimie 4.3 - CombustionsDocument4 pagesExercices - Chimie 4.3 - CombustionsAbđė Ěł Łğđ100% (1)
- 1 - Considération Générales Sur La CombustionDocument52 pages1 - Considération Générales Sur La CombustionChikhi AyoubPas encore d'évaluation
- 2 1 AE BarbecueDocument1 page2 1 AE BarbecuekalibrouillePas encore d'évaluation
- CR 4 Les CombustionsDocument22 pagesCR 4 Les Combustionskawtar bourkanPas encore d'évaluation
- 1S TPC9 CombustionsDocument2 pages1S TPC9 CombustionsDjamila BenyoucefPas encore d'évaluation
- CHP 4 Les CombustionsDocument6 pagesCHP 4 Les Combustionsnaceur rbiiPas encore d'évaluation
- Chap 1 Les CombustionsDocument6 pagesChap 1 Les CombustionsmazhourPas encore d'évaluation
- 613a Combustions PDocument6 pages613a Combustions PJeremy ForoiPas encore d'évaluation
- Al4sp41tewb0111 Sequence 05Document20 pagesAl4sp41tewb0111 Sequence 05ogmios_94Pas encore d'évaluation
- Devoir 2 Modele 3 Physique Chimie 2ac Semestre 1Document1 pageDevoir 2 Modele 3 Physique Chimie 2ac Semestre 1Bouchra TahirPas encore d'évaluation
- Devoir N2 Semestre 1 Physique 2AC 1Document1 pageDevoir N2 Semestre 1 Physique 2AC 1Abdellah EL MAMOUNPas encore d'évaluation
- COURS-1-Fours-et-chaudi Res MI GC Mars 2020-PubliDocument14 pagesCOURS-1-Fours-et-chaudi Res MI GC Mars 2020-PubliAmine RedouanePas encore d'évaluation
- TDN°4 HydrocarburesDocument3 pagesTDN°4 Hydrocarburesnianghadiaw248Pas encore d'évaluation
- CC 2' - 2 S1 2éme Année FRDocument1 pageCC 2' - 2 S1 2éme Année FRSaid Lajiar50% (2)
- La Réaction Chimique - Les CombustionsDocument4 pagesLa Réaction Chimique - Les CombustionsPicasso BosePas encore d'évaluation
- ExerciceDocument1 pageExerciceAbđė Ěł Łğđ100% (3)
- Controle 2 Mod8 2ac Int WWWDocument1 pageControle 2 Mod8 2ac Int WWWapi-382847969100% (1)
- Croissance Des HAP Et Des Suies Et Transition Phase Gaz-Phase Solide Dans Les Processus de CombustionDocument15 pagesCroissance Des HAP Et Des Suies Et Transition Phase Gaz-Phase Solide Dans Les Processus de CombustionBen Habib BambaPas encore d'évaluation
- Corrigé - Les Atomes Dans Les Transformations ChimiquesDocument10 pagesCorrigé - Les Atomes Dans Les Transformations ChimiquesKim AtuaPas encore d'évaluation
- Combustion Et CombustiblesDocument35 pagesCombustion Et CombustiblesAbo KolouPas encore d'évaluation
- 4e Chap4 Cours CombustionDocument4 pages4e Chap4 Cours CombustionandoPas encore d'évaluation
- Phénoménes Dangereux Chap2Document86 pagesPhénoménes Dangereux Chap2fadiilaPas encore d'évaluation
- ExerciceDocument3 pagesExerciceayoPas encore d'évaluation
- Memoire Final 03Document30 pagesMemoire Final 03Criwza senseiPas encore d'évaluation
- PhysiqueDocument3 pagesPhysiqueAbđė Ěł Łğđ100% (1)
- Comprehention Systeme FeuDocument34 pagesComprehention Systeme FeuLcs GjnPas encore d'évaluation
- Cours 2 Moteurs A Combustion InternesDocument5 pagesCours 2 Moteurs A Combustion Internesahmed ahmadPas encore d'évaluation
- 4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02Document12 pages4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02d.g.zahra17Pas encore d'évaluation
- Notions Combustibles Exercices Enonces PDFDocument8 pagesNotions Combustibles Exercices Enonces PDFHoussam HaddaniPas encore d'évaluation
- Ab 1Document6 pagesAb 1boouananiPas encore d'évaluation
- Exercices CH Organique CombustionDocument1 pageExercices CH Organique CombustionlardeurPas encore d'évaluation
- Chimie Controle CombustionDocument2 pagesChimie Controle Combustionimanfekryahmed100% (1)
- PC 2ac Semestre 1 Devoir 2 Modele 1 1Document2 pagesPC 2ac Semestre 1 Devoir 2 Modele 1 1Dr. BENRAMDANEPas encore d'évaluation
- 02 Les CombustionsDocument2 pages02 Les CombustionsZAKARIA EL KHABBABIPas encore d'évaluation
- Conséquence de La Combustion1Document9 pagesConséquence de La Combustion1Moussa El FatmiPas encore d'évaluation
- Les Combustions Exercices Non Corriges 3Document2 pagesLes Combustions Exercices Non Corriges 3Badr LoulantiPas encore d'évaluation
- Combustion GESDocument38 pagesCombustion GESsaidaPas encore d'évaluation
- Chapitre 4Document21 pagesChapitre 4Vella Robert Houmguia NgolainaPas encore d'évaluation
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- 001 Inc - La - CombustionDocument17 pages001 Inc - La - Combustionsergis9servicesPas encore d'évaluation
- Transfo de La BiomasseDocument24 pagesTransfo de La BiomasseOumar NapoPas encore d'évaluation
- Chap 2 La CombustionDocument17 pagesChap 2 La CombustionmilanoaaPas encore d'évaluation
- Chapitre5 PDFDocument9 pagesChapitre5 PDFelkendyPas encore d'évaluation
- Risque Incend-Expls 2020 Hsst-ConvertiDocument16 pagesRisque Incend-Expls 2020 Hsst-ConvertiImad BelhadiPas encore d'évaluation
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDocument36 pagesCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- 4e Chap4Document5 pages4e Chap4zehwa aliPas encore d'évaluation
- Les Combustions - Partie 2Document8 pagesLes Combustions - Partie 2Marc EvansPas encore d'évaluation
- Benzène 0607Document2 pagesBenzène 0607PFE86% (7)
- Livre 4e - Partie 1Document38 pagesLivre 4e - Partie 1Aubrey PosenPas encore d'évaluation
- Notions Combustibles Cours PDFDocument4 pagesNotions Combustibles Cours PDFsimoPas encore d'évaluation
- SSIAP3.F1.L'incendie & ConséquensesDocument29 pagesSSIAP3.F1.L'incendie & ConséquensesJérôme G100% (1)
- Le cahier d’exercices : tome 2 – … plus loin: Outils visuels pour les musiciens, #3D'EverandLe cahier d’exercices : tome 2 – … plus loin: Outils visuels pour les musiciens, #3Pas encore d'évaluation
- Vocabulaire Des MateriauxDocument9 pagesVocabulaire Des Materiauxdody1988Pas encore d'évaluation
- CHM 204 VRDocument97 pagesCHM 204 VRwisdomayivi06Pas encore d'évaluation
- Fiche Eleve - Act-3Datation - Resolution-Probleme - EnS - PRDocument2 pagesFiche Eleve - Act-3Datation - Resolution-Probleme - EnS - PRfabien100% (1)
- Chimie 9éme-1Document29 pagesChimie 9éme-1Hama Coulibaly88% (8)
- S1 EXO 3 3APIC (WWW - Pc1.ma)Document5 pagesS1 EXO 3 3APIC (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- Asset Brochure Produit Zehnder CarbolineDocument12 pagesAsset Brochure Produit Zehnder CarbolineBrice Patrice GollyPas encore d'évaluation
- L SALAMA Dev n°1SBT2012Document3 pagesL SALAMA Dev n°1SBT2012Oumar TraoréPas encore d'évaluation
- Série 3 Oxydation Des MétauxDocument2 pagesSérie 3 Oxydation Des MétauxFaiz TahaPas encore d'évaluation
- FicheToxSynthetique 47Document3 pagesFicheToxSynthetique 47Florent DesobriPas encore d'évaluation
- La Combustion de Matériaux Organiques Dans L'airDocument3 pagesLa Combustion de Matériaux Organiques Dans L'airOussama ZnPas encore d'évaluation
- Chimie Controle Modele ParticulaireDocument2 pagesChimie Controle Modele Particulairebrahim chalhoubPas encore d'évaluation
- 3ac 4ppt - La Combustion Des Matériaux OrganiquesDocument4 pages3ac 4ppt - La Combustion Des Matériaux Organiquesmohamed aoubyPas encore d'évaluation
- 1 Cristallographie Et Cristallochimie I Duree 1h30Document4 pages1 Cristallographie Et Cristallochimie I Duree 1h30Samah SamahPas encore d'évaluation
- Extrait 42329210Document131 pagesExtrait 42329210ayoub bouazlaPas encore d'évaluation
- PV835412 - FDS (CLP) Gloss Lessive - FR V1-R1Document8 pagesPV835412 - FDS (CLP) Gloss Lessive - FR V1-R1gachetPas encore d'évaluation
- La Chimie OrganiqueDocument41 pagesLa Chimie OrganiqueOumar TraoréPas encore d'évaluation
- ELJouhari ChapitreIV-SMC4Document8 pagesELJouhari ChapitreIV-SMC4Au RevoirPas encore d'évaluation
- Préparation de Matériaux Hybrides À BaseDocument169 pagesPréparation de Matériaux Hybrides À BaseSamah SoltanePas encore d'évaluation
- Révision CO1Document4 pagesRévision CO1astridentebePas encore d'évaluation