Académique Documents
Professionnel Documents
Culture Documents
Les Reactions Chimiques Cours 5
Transféré par
hamza manafCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Les Reactions Chimiques Cours 5
Transféré par
hamza manafDroits d'auteur :
Formats disponibles
Chapitre 5 les réactions chimiques
I. Notion de réaction chimique
1. Transformation physique et transformation chimique :
la fusion du fer = transformation de Fer solide au Fer liquide
la combustion du butane = transformation chimique, il y a disparition du butane et le dioxygène et apparition
du dioxyde de carbone et de l’eau
2. Définition :
Une réaction chimique est une transformation chimique auquel il y a disparition des corps appelés réactifs et
apparition des corps appelés produits.
Toutes les combustions sont des réactions chimiques
Remarque : la combustion du charbon dans le O2 entraine une forte incandescence avec des étincelles
II. Réaction entre le Fer et le Soufre
1) Expérience :
On prépare 4g du Soufre et 7 g de poudre de Fer,
après on chauffe le mélange jusqu’à
l’incandescence à l’aide du bec Bensun . En fin
on obtient un corps noir non attiré par l’aimant
2) Déduction :
Il y a une transformation chimique ; le Soufre et le Fer disparaissent et le Sulfure de Fer apparait.
Cette réaction n’est pas une combustion, car on n’a pas de dioxygène aux réactifs.
Bilan
Soufre + Fer Sulfure de Fer
Réactifs Produits
III. Lois de réaction chimique :
1) Expérience et résultat :
Lors de la réaction entre le Soufre et le Fer ces
deux (2) réactifs disparaissent.
le Sulfure de Fer ce produit apparait.
Réactifs Produit
Soufre + Fer Sulfure de Fer
m1 = 4 g ; m2 = 7 g m3 = 11 g
m3 = m1 + m2 11 g = 4 g + 7 g
la masse du produit est égale à la somme des masses de chaque réactifs.
2 ) Conservation de la masse :
Lors d’une réaction chimique, il y a conservation de la masse c.-à-d. La somme des masses des réactifs est
égale à la somme des masses des produits ;
Bourassi Ahmed collège RIAD Oujda
3 ) Conservation des atomes en genre:
Bilan de réaction du carbone dans le dioxygène
Réactifs Produits
Nom Carbone + Dioxygène Dioxyde de carbone
Symbole/ C ; O2 CO2
formule
Modèle
Genre d’atome C;O C;O
4 ) Conservation des atomes en nombre:
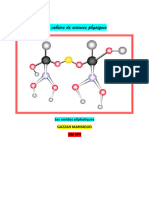
Bilan de réaction du méthane dans le dioxygène
Réactifs Produits
Nom Méthane + Dioxygène Dioxyde de carbone + eau
Symbole/Formule CH4 ; O2 CO2 ; H2O
Modèle
C=1 C=1
Nombre d’atome H=4 H=2+2=4
O= 2+2=4 O= 2+2=4
4 ) conclusion:
Lors d’une réaction chimique, il y a conservation des atomes en genre et en nombre.
IV. Equation chimique :
1 ) Equation chimique :
On modélise une réaction chimique par une équation chimique dont on écrit les formules chimiques des
molécules ou les symboles d’atomes des réactifs à gauche et celles des produits à droite, séparée par une
flèche indiquant le sens de la réaction ; exemple : C + O2 CO2 ; CH4 + O2 CO2 + H2O
2) Equilibrer une équation chimique :
Pour équilibrer une équation chimique, on utilise des nombres entiers appelés : coefficients stéréochimiques
Exemple : H2 + O2 H2O
au début H=2; O =2 H=2; O=1
pour le O : O=2x1=2 H= 2 x2 = 4 et O = 1 x 2 = 2
On aura H = 2 x 2 = 4
En fin en écrit : : 2 H2 + 1 O2 2 H2O
Bourassi Ahmed collège RIAD Oujda
Exercice : écrire les équations de réactions suivantes et les équilibrées
Combustion du butane dans le dioxygène ;
Réaction entre le fer et le dioxygène (humide) il se forme de la rouille (Fe2O3) ;
Combustion du benzène dans le dioxygène ; benzène (C6H6)
Bourassi Ahmed collège RIAD Oujda
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- ExercicesEtDS Etude Quantitative Chimie BEPDocument2 pagesExercicesEtDS Etude Quantitative Chimie BEPMenasria HakimPas encore d'évaluation
- Etude Quantitative D'une Réaction Chimique I) Conservation de La MasseDocument2 pagesEtude Quantitative D'une Réaction Chimique I) Conservation de La MasseMouhibi AbdellahPas encore d'évaluation
- 1as Conc Solubilité 03 21Document4 pages1as Conc Solubilité 03 21Abid ElyesPas encore d'évaluation
- Exercices Reaction Entre L Acide Chlorhydrique Et Le Fer Physique Chimie 3emeDocument13 pagesExercices Reaction Entre L Acide Chlorhydrique Et Le Fer Physique Chimie 3emeHayet Ben SaidPas encore d'évaluation
- TP N°18 MODELISER UNE SOURCE REELLE DE TENSION 2022Document8 pagesTP N°18 MODELISER UNE SOURCE REELLE DE TENSION 2022Cthulhu ClassePas encore d'évaluation
- Les Amides AliphatiquesDocument8 pagesLes Amides AliphatiquesMahmoud Gazzah100% (1)
- Mouvement Et Repos Vitesse Moyenne Exercices Non Corriges 5Document4 pagesMouvement Et Repos Vitesse Moyenne Exercices Non Corriges 5awacisko734Pas encore d'évaluation
- Etude Quantitative D'une Réaction ChimiqueDocument4 pagesEtude Quantitative D'une Réaction ChimiqueMawadda Messaoud100% (1)
- 2nd AC - C1 Lélément ChimiqueDocument7 pages2nd AC - C1 Lélément ChimiqueYoman Arthur verdier Assui100% (1)
- 01 2nde C Chapitre 2 Constitution de La MatiereDocument24 pages01 2nde C Chapitre 2 Constitution de La MatiereRafikou22100% (1)
- CH 3 Oxydation Des MétauxDocument2 pagesCH 3 Oxydation Des MétauxAbdellah BrmPas encore d'évaluation
- Fiche 1 - Oxydation Des MétauxDocument3 pagesFiche 1 - Oxydation Des Métauxmaintenance2 sipatPas encore d'évaluation
- Nouha Ramadan Hamou Mouna Exercices 1 Decroissance RadioactiveDocument1 pageNouha Ramadan Hamou Mouna Exercices 1 Decroissance Radioactiverihab0% (1)
- Mole Et Grandeurs Molaires RevueDocument7 pagesMole Et Grandeurs Molaires Revuemouhamed bachir gayePas encore d'évaluation
- Devoir-Non Serveille-N3-S1Document1 pageDevoir-Non Serveille-N3-S1Karim Obaiss100% (1)
- Association Des Conducteurs Ohmiques Cours FRDocument4 pagesAssociation Des Conducteurs Ohmiques Cours FRBaye Traore100% (1)
- Fascicule Sciences Physiques 4emeDocument54 pagesFascicule Sciences Physiques 4emeNemir MimirPas encore d'évaluation
- Progression - Physique-Chimie 4emeDocument1 pageProgression - Physique-Chimie 4emeLassene BambaPas encore d'évaluation
- Structure Del ADocument7 pagesStructure Del Aacademie archimede0% (1)
- Travail Et Energie PotentielDocument5 pagesTravail Et Energie PotentielTaiga Aisaka0% (1)
- 2nde A - APC - L'élément ChimiqueDocument3 pages2nde A - APC - L'élément Chimiquemassamba AwoussiPas encore d'évaluation
- RE'PARTITION DU PROGRAMME DE PHYSIQUE (1ere Année)Document3 pagesRE'PARTITION DU PROGRAMME DE PHYSIQUE (1ere Année)Othmane ADPas encore d'évaluation
- CH6 EXERCICES Classification Périodique Des Éléments Chimiques TCSbiofDocument2 pagesCH6 EXERCICES Classification Périodique Des Éléments Chimiques TCSbiofOUMJAHD HAJAR990100% (1)
- 1S2TDP32012 PDFDocument3 pages1S2TDP32012 PDFالغزيزال الحسن EL GHZIZAL Hassane50% (2)
- 1 - Exercices de Fixation TC FRDocument2 pages1 - Exercices de Fixation TC FRait hssainPas encore d'évaluation
- Auto InductionDocument5 pagesAuto InductionTraoré Mamadou Tâ0% (2)
- Exercice Gravitation Systeme Solaire Poids MasseDocument3 pagesExercice Gravitation Systeme Solaire Poids MasseHamza Derar0% (1)
- EXO Notion de Couple OxydantDocument2 pagesEXO Notion de Couple OxydantPFE100% (1)
- Cours Masse Volumique DensitéDocument7 pagesCours Masse Volumique Densitéعبد الفتاح الشقراويPas encore d'évaluation
- Correction Serie N1 Analytique 1Document6 pagesCorrection Serie N1 Analytique 1Hk Eh100% (1)
- Atomes PDFDocument24 pagesAtomes PDFJam Hann100% (1)
- PC Physique Chimie 1994Document6 pagesPC Physique Chimie 1994Mahmoud ChiboubPas encore d'évaluation
- 3ème Fascicule Sciences Physiques IGEPSADocument97 pages3ème Fascicule Sciences Physiques IGEPSARaïlie EwanguiPas encore d'évaluation
- 1bac ChimieDocument1 page1bac ChimieMed Amine Hattaki100% (2)
- La Propagation de La Lumiere Cours 5Document3 pagesLa Propagation de La Lumiere Cours 5hamza manafPas encore d'évaluation
- Devoir de Contrôle 1AS Lycée Pilote by Galaï Abdelhamid Avec Correction PDFDocument5 pagesDevoir de Contrôle 1AS Lycée Pilote by Galaï Abdelhamid Avec Correction PDFAnis DahnenPas encore d'évaluation
- Exercices Ions CapDocument8 pagesExercices Ions CapFred RocherPas encore d'évaluation
- Chaleur Et Température FinDocument2 pagesChaleur Et Température FinKarim ObaissPas encore d'évaluation
- Equilibre D Un Corps Sous L Action de 2 Forces Exercices Non Corriges 2 PDFDocument3 pagesEquilibre D Un Corps Sous L Action de 2 Forces Exercices Non Corriges 2 PDFSigmandro AndroPas encore d'évaluation
- Pendule Elastique CoursDocument4 pagesPendule Elastique Courseya GramiPas encore d'évaluation
- QCM TrianglesDocument4 pagesQCM TrianglesGamerenflamme Nul67% (3)
- PC - 2nde - C A - Cours - Complet - Lycee - Numerique - Cote - D IvoireDocument216 pagesPC - 2nde - C A - Cours - Complet - Lycee - Numerique - Cote - D IvoireLAWSON NICOLAS100% (1)
- Exo PhysiqueDocument33 pagesExo PhysiqueRaogo Laurent OuedraogoPas encore d'évaluation
- Sã©rie 1 - MVT de RotationDocument2 pagesSã©rie 1 - MVT de RotationYASSINE VRGSPas encore d'évaluation
- Caractère Qualitatif DDocument4 pagesCaractère Qualitatif DSugar Cube100% (2)
- 2nd AC - C6 Equation - Bilan Dune Réaction ChimiqueDocument8 pages2nd AC - C6 Equation - Bilan Dune Réaction ChimiqueDerz ØffĩčïëlPas encore d'évaluation
- Lois PhysiquesDocument1 pageLois PhysiquesMartin SossouPas encore d'évaluation
- Alcools CoursDocument6 pagesAlcools CoursOuedraogo Harouna100% (1)
- Quantité de MatièreDocument17 pagesQuantité de MatièreOumar TraoréPas encore d'évaluation
- TP Chimie Des Solutions 2015 2016 1Document24 pagesTP Chimie Des Solutions 2015 2016 1sumaleePas encore d'évaluation
- Exercice SolutionDocument2 pagesExercice SolutionMeryem Chakri0% (1)
- Cours-Les Réactions chimiques-FR PDFDocument6 pagesCours-Les Réactions chimiques-FR PDFhakima032100% (1)
- Série D'exercices #19 - Sciences Physiques PH Des Solutions Aqueuses - Poussée D'archimède - 2ème Sciences (2010-2011) MR Adam BoualiDocument1 pageSérie D'exercices #19 - Sciences Physiques PH Des Solutions Aqueuses - Poussée D'archimède - 2ème Sciences (2010-2011) MR Adam BoualiBenmansour Mouhamed ata0% (1)
- Les Spectres Atomiques PDFDocument6 pagesLes Spectres Atomiques PDFAzizElheniPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2014-2015) MR Handoura NaceurDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2014-2015) MR Handoura NaceurLotfi Ben MalekPas encore d'évaluation
- YahyaDocument2 pagesYahyapfePas encore d'évaluation
- FichierDocument3 pagesFichierwalid bakkouriPas encore d'évaluation
- L'équation D'une Réaction ChimiqueDocument1 pageL'équation D'une Réaction Chimiquelewot19564Pas encore d'évaluation
- 6128ed3519f3cequation Bilan D Une Reaction Chimique Cours de PHDocument4 pages6128ed3519f3cequation Bilan D Une Reaction Chimique Cours de PHEric KonanPas encore d'évaluation
- Le Traitement Des Eaux Cours PPT 1Document18 pagesLe Traitement Des Eaux Cours PPT 1hamza manaf50% (2)
- AnnonceDocument1 pageAnnoncehamza manafPas encore d'évaluation
- La Propagation de La Lumiere Cours 5Document3 pagesLa Propagation de La Lumiere Cours 5hamza manafPas encore d'évaluation
- Devoir 3 Modele 5 Physique Chimie 2ac Semestre 2Document2 pagesDevoir 3 Modele 5 Physique Chimie 2ac Semestre 2hamza manaf100% (1)
- Certificat de Conformite: T0050/7B - Lot N°1444035, Sont Conformes À La Norme NF EN 933-8 - 2012Document1 pageCertificat de Conformite: T0050/7B - Lot N°1444035, Sont Conformes À La Norme NF EN 933-8 - 2012hamza manafPas encore d'évaluation
- La Separation Des Constituants D Un Melange Exercices Non Corriges 1Document1 pageLa Separation Des Constituants D Un Melange Exercices Non Corriges 1hamza manafPas encore d'évaluation
- L Air Qui Nous Entoure Resume de Cours 5Document2 pagesL Air Qui Nous Entoure Resume de Cours 5hamza manafPas encore d'évaluation
- Lumiere Et Couleurs Dispersion de La Lumiere Cours PPT 3Document9 pagesLumiere Et Couleurs Dispersion de La Lumiere Cours PPT 3hamza manafPas encore d'évaluation
- Les Substances Naturelles Et Synthetiques Cours PPT 6Document21 pagesLes Substances Naturelles Et Synthetiques Cours PPT 6hamza manafPas encore d'évaluation
- Devoir 3 Modele 2 Physique Chimie 2ac Semestre 2Document1 pageDevoir 3 Modele 2 Physique Chimie 2ac Semestre 2hamza manafPas encore d'évaluation
- Les Lois de La Reaction Chimique Resume de Cours 3Document3 pagesLes Lois de La Reaction Chimique Resume de Cours 3hamza manafPas encore d'évaluation
- 10 1 014-En-1340Document67 pages10 1 014-En-1340hamza manafPas encore d'évaluation
- La Lumiere Qui Nous Entoure Cours 1Document7 pagesLa Lumiere Qui Nous Entoure Cours 1hamza manafPas encore d'évaluation
- L Installation Electrique Domestique Exercices Non Corriges 1Document3 pagesL Installation Electrique Domestique Exercices Non Corriges 1hamza manafPas encore d'évaluation
- Les Combustions Cours PPT 2Document25 pagesLes Combustions Cours PPT 2hamza manaf100% (1)
- Les Lentilles Minces L Image Formee Par Une Lentille Mince Convergente Cours 2Document6 pagesLes Lentilles Minces L Image Formee Par Une Lentille Mince Convergente Cours 2hamza manafPas encore d'évaluation
- Le Champ Magnetique CoursDocument3 pagesLe Champ Magnetique Courshamza manafPas encore d'évaluation
- 1 Ondes EnonceDocument3 pages1 Ondes Enoncehamza manafPas encore d'évaluation
- La Pollution de L Air Cours 3Document2 pagesLa Pollution de L Air Cours 3hamza manafPas encore d'évaluation
- La Formation Des Roches Sedimentaires Fiche PedagogiqueDocument6 pagesLa Formation Des Roches Sedimentaires Fiche Pedagogiquehamza manafPas encore d'évaluation
- Superposition D Ondes CoursDocument2 pagesSuperposition D Ondes Courshamza manafPas encore d'évaluation
- Annale Maths Bac S Nouvelle Caledonie Decembre 2020 SujetDocument5 pagesAnnale Maths Bac S Nouvelle Caledonie Decembre 2020 Sujethamza manafPas encore d'évaluation
- L Alimentation Chez Les Etres Vivants Resume de Cours Manuel 2Document2 pagesL Alimentation Chez Les Etres Vivants Resume de Cours Manuel 2hamza manafPas encore d'évaluation
- Norme Marocaine: Enrobés HydrocarbonésDocument19 pagesNorme Marocaine: Enrobés Hydrocarbonéshamza manaf100% (1)
- Soude Caustique PerleDocument5 pagesSoude Caustique PerleHenderson TshikwataPas encore d'évaluation
- Calepin ChantierDocument52 pagesCalepin ChantierhamonPas encore d'évaluation
- 10a Les Principaux Types de Formulation de PesticidesDocument9 pages10a Les Principaux Types de Formulation de PesticidesJamm MenguePas encore d'évaluation
- Ecotoxicologie MoléculaireDocument14 pagesEcotoxicologie Moléculairedjaouad bourouaisPas encore d'évaluation
- 1f1ad Manuel de Procedure D Enregistrement Des Produits Et Etablissement de La Medecine Traditionnelle Et Complementaire - 2018 - DPLMTDocument28 pages1f1ad Manuel de Procedure D Enregistrement Des Produits Et Etablissement de La Medecine Traditionnelle Et Complementaire - 2018 - DPLMTmiantsakoPas encore d'évaluation
- Les Guidages en RotationDocument54 pagesLes Guidages en RotationJaksMaksPas encore d'évaluation
- Notice P 1 26 4 PDFDocument1 pageNotice P 1 26 4 PDFhandelsbankerPas encore d'évaluation
- Module D'young SolutionDocument5 pagesModule D'young SolutionDocteur Albert TouatiPas encore d'évaluation
- BNSR Geotechnique Normes Par Themes 10 2007 PDFDocument28 pagesBNSR Geotechnique Normes Par Themes 10 2007 PDFSeif15100% (1)
- La Technologie PCR QuantitativeDocument11 pagesLa Technologie PCR QuantitativeAsma SppPas encore d'évaluation
- DEVOIR DE NIVEAU Tle D - LMJF - N°1 - 16 Novembre 2021Document4 pagesDEVOIR DE NIVEAU Tle D - LMJF - N°1 - 16 Novembre 2021Yoman Arthur verdier Assui100% (1)
- Transport PneumatiqueDocument3 pagesTransport PneumatiqueBachir Adjouati100% (1)
- 2022 CentresEtrangers2 J2 ExoA Correction VanilleConducti 5pts 1Document2 pages2022 CentresEtrangers2 J2 ExoA Correction VanilleConducti 5pts 1wakil.paris2Pas encore d'évaluation
- Tissu ConjonctifDocument22 pagesTissu ConjonctifyecinePas encore d'évaluation
- Corrosion Par PiqureDocument19 pagesCorrosion Par PiqurezikPas encore d'évaluation
- 2nd S Serie D'exercices - Des Atomes Aux MoleculesDocument2 pages2nd S Serie D'exercices - Des Atomes Aux MoleculesAmdan AkondoPas encore d'évaluation
- Interrupteur REEDDocument9 pagesInterrupteur REEDpfePas encore d'évaluation
- Chapitre 5 - Géométrie Moléculaie - Hybridation - Version Complète PDFDocument63 pagesChapitre 5 - Géométrie Moléculaie - Hybridation - Version Complète PDFMahbouba HkiriPas encore d'évaluation
- Document Complet de SVT Cote DivoirDocument113 pagesDocument Complet de SVT Cote DivoirJonathan Azocli100% (1)
- Chapitre 4 ESEDocument12 pagesChapitre 4 ESEFerouliPas encore d'évaluation
- Roulements Lma PDFDocument49 pagesRoulements Lma PDFMouss TachegachtPas encore d'évaluation
- Diapo Extraction Des Huiles Essentielles MemoireDocument10 pagesDiapo Extraction Des Huiles Essentielles MemoirebouzbidPas encore d'évaluation
- NORAUTO HF500 Mode D'emploiDocument6 pagesNORAUTO HF500 Mode D'emploitestPas encore d'évaluation
- Pharmacopoeia of The People - S Republic of China - 2005 - Vol - 2 - 1Document434 pagesPharmacopoeia of The People - S Republic of China - 2005 - Vol - 2 - 1DangPas encore d'évaluation
- Examen 2012Document18 pagesExamen 2012شي ماءPas encore d'évaluation
- Brique EMG 21 DDocument61 pagesBrique EMG 21 DJaouad SAYKOUKPas encore d'évaluation
- Orga 35Document3 pagesOrga 35elycheikh.menePas encore d'évaluation
- Flender Zapex Couplings ZW PDFDocument40 pagesFlender Zapex Couplings ZW PDFYorkistPas encore d'évaluation
- Manual Cafetera Express Krups EA82 PDFDocument187 pagesManual Cafetera Express Krups EA82 PDFPablo Gómez RPas encore d'évaluation
- 826 Detecteur GazDocument4 pages826 Detecteur GazHakim YahiaouiPas encore d'évaluation