Académique Documents
Professionnel Documents
Culture Documents
Orga 35
Transféré par
elycheikh.meneTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Orga 35
Transféré par
elycheikh.meneDroits d'auteur :
Formats disponibles
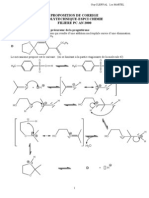
Corrigé exercice 35
OXYDATION PAR LE DIOXYDE DE MANGANÈSE
HO MnO2
A
C5H8O
1) A priori, le 3-méthylbut-2-én-1-ol possède deux fonctions susceptibles de s’oxyder :
- la fonction alcène ; mais on sait que cela conduit soit à un diol, et A n’a qu’un atome O, soit à
une coupure oxydante, mais A possède toujours 5 atomes C... ce n’est donc pas a priori
l’alcène qui s’oxyde ;
- la fonction alcool primaire ; on sait qu’elle peut a priori s’oxyder en aldéhyde ou en acide
carboxylique, mais comme A ne possède qu’un seul atome O, ce ne peut pas être un acide
carboxylique.
Il pourrait aussi s’agir d’une oxydation plus complexe, non vue en cours, mais on va vérifier à la
question suivante que l’hypothèse de l’oxydation de l’alcool en aldéhyde est compatible avec les
résultats expérimentaux.
2) A est l’aldéhyde suivant (3-méthylbut-2-énal) :
O
En effet :
- Cette molécule est acyclique et possède deux liaisons doubles ; ceci est compatible avec la
formule brute, qui montre un degré d’insaturation de 2 (une molécule saturée à 5 atomes C
aurait 2 × 5 + 2 = 12 atomes H ; il en manque donc 4 soit 𝐷𝐼 = 2).
- Le spectre IR possède deux bandes aux fréquences d’élongation caractéristiques des liaisons
C = C et C = O conjuguées, respectivement 1623 et 1683 cm!" ; les fréquences sont abaissées
par rapport à des liaisons isolées car les liaisons ont un léger caractère de liaison simple dans
l’hybride des deux formules mésomères :
-
O +
O
- Le spectre RMN montre bien un proton (a) d’aldéhyde à 𝛿 = 9,96 ppm, couplé avec un
proton vinylique (b) à 𝛿 = 5,88 ppm, leur couplage donnant un doublet pour chaque signal.
Par ailleurs, les 6 protons des groupes méthyle (c) donnent bien un signal proche d’un
singulet, car ils sont presque isochrones et car il n’y a pas de proton sur le C adjacent (les
deux groupes méthyle sont en fait diastéréotopiques, l’un d’entre eux est en effet plus proche
du groupe carbonyle que l’autre…). Le léger déblindage à 𝛿 = 2,1 ppm est dû à la proximité
de la liaison double.
H (b)
O CH3
(c)
H CH3
(a)
3) Le nombre d’oxydation passe de −I dans cet alcool primaire à +I dans l’aldéhyde :
Chimie organique Exercice 35 Page 1 sur 3
HO -I MnO2 O +I
H H
H
4) Le nombre d’oxydation du manganèse passe de +IV dans MnO# à +II dans Mn#$ . Comme l’alcool
gagne, lui, deux degrés d’oxydation, on en déduit que la stœchiométrie est de 1:1 entre les deux
réactifs.
$
On équilibre avec H(aq) et H# O... en faisant l’hypothèse qu’on est en milieu acide aqueux...
HO-CH# -CH=C(CH) )# + MnO# + 2H$ = OHC-CH=C(CH) )# + Mn#$ + 2H# O
... mais en fait MnO# est utilisé dans des solvants organiques et non pas dans l’eau, il faudrait donc
adapter cette équation au solvant utilisé.
5) On pourrait utiliser un autre oxydant, en milieu non aqueux pour éviter que l’aldéhyde ne
s’oxyde en acide carboxylique : iode (+V) dans le periodinane de Dess-Martin (DMP), chrome (+VI)
dans CrO) dans la pyridine (réactif de Collins et Sarett), et bien d’autres...
Les oxydants cités précédemment convertissent tous les alcools primaires en aldéhydes, mais
concernant MnO# , l’énoncé indique que cela ne fonctionne pas dans la réaction suivante :
HO MnO2
rien
Visiblement, MnO# n’oxyde que les alcools situés à une liaison d’une liaison double (on parle d’alcools
allyliques). Il laisse intacts les autres alcools, il est donc chimiosélectif.
6) L’absence d’absorption IR autour de 1700 cm!" et la présence d’une bande vers 3400 cm!" pour
C suggère que les groupes C = O de B ont été remplacés par des groupes OH. LiAlH𝟒 est un réducteur,
comme NaBH+ , mais plus puissant et moins chiomiosélectif, puisqu’il réduit les fonctions cétone,
mais aussi les fonctions ester.
La formule brute de C montre également la perte d’un atome de carbone et d’un atome d’oxygène par
rapport à B, qui correspondrait au groupe CH) O de l’ester, perdu lors de la réduction.
Le degré d’insaturation de C étant de 3 (avec 11 atomes C, il faudrait 2 × 11 + 2 = 24 atomes H pour
saturer, et il y en a 18), les deux cycles et la fonction alcène sont bien conservés.
OH
OH
O
O
C
Le passage de B à C est bien une réduction, on peut utiliser les nombres d’oxydation pour le prouver :
O OH
O +III -I
O OH
réduction par
+II 0
O LiAlH4 O
(puis hydrolyse)
O O
B C
7) NaBH+ ne réduit pas toujours les esters. C’est un réducteur moins puissant que LiAlH+ . Il n’est
pas certain qu’on pourrait l’utiliser ici pour obtenir C.
Chimie organique Exercice 35 Page 2 sur 3
8) On utilise les résultats du début de l’énoncé, où l’on a appris que MnO# était un oxydant
chimiosélectif des fonctions alcool allyliques, ce qui est le cas du groupe OH du cycle, situé à une
liaison de la fonction alcène. On en déduit la nature de D :
OH
O
O
D
La formule brute révèle un degré d’insaturation de 𝐷𝐼 = 4, puisqu’avec 11 atomes C, il faudrait
2 × 11 + 2 = 24 atomes H pour obtenir la saturation et on n’en a que 16. Or D possède 2 cycles et deux
liaisons doubles, ce qui correspond bien à 𝐷𝐼 = 4.
Les données spectroscopiques confirment également cette structure : on a conservé l’une des
fonctions alcool (bande IR vers 3400 cm!" ) et on a maintenant une bande fine et intense à 𝜈 =
1678 cm!" , caractéristiques d’une cétone conjuguée.
9) L’hydrolyse doit être prudente lors de l’obtention de C, car on veut conserver la fonction acétal.
Or celle-ci s’hydrolyse assez facilement en milieu aqueux si la concentration en H$ (catalyseur) et/ou
la température sont trop élevées.
Chimie organique Exercice 35 Page 3 sur 3
Vous aimerez peut-être aussi
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Orga 38Document3 pagesOrga 38elycheikh.menePas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Orga 31Document2 pagesOrga 31SARAHPas encore d'évaluation
- Thème: Chimie Organique: Niveau: T CDE DisciplineDocument9 pagesThème: Chimie Organique: Niveau: T CDE DisciplineXrap HitPas encore d'évaluation
- Les Aldéhydes Et Les Cétones - Activation Et Protection Du Groupe CarbonyleDocument14 pagesLes Aldéhydes Et Les Cétones - Activation Et Protection Du Groupe CarbonylejenndPas encore d'évaluation
- Résumé Du Cours: Exercices de Chimie Corrigés Proposés Par Djibril FallDocument52 pagesRésumé Du Cours: Exercices de Chimie Corrigés Proposés Par Djibril FallHamza Dicko60% (5)
- Correction Devoir de ChimieDocument3 pagesCorrection Devoir de ChimieLéa ClastresPas encore d'évaluation
- DS05 CDocument15 pagesDS05 CbaatoutmbPas encore d'évaluation
- AlcoolsDocument4 pagesAlcoolsOumar TraoréPas encore d'évaluation
- Fascicule Exercices Corrigés de ChimieDocument51 pagesFascicule Exercices Corrigés de Chimieneyangom100% (1)
- Chapitre VIII Les Composés Oxygénés PremièreDocument5 pagesChapitre VIII Les Composés Oxygénés Premièremadomano1971Pas encore d'évaluation
- 1ers - Chap 16 - CoursDocument3 pages1ers - Chap 16 - CoursBenjamin TobarPas encore d'évaluation
- Chapitre VIII Les Composés Oxygénés FiniDocument7 pagesChapitre VIII Les Composés Oxygénés Finimadomano1971Pas encore d'évaluation
- Ch10 Aldehydes Et CetonesDocument54 pagesCh10 Aldehydes Et CetonesSalah Láálám100% (1)
- Chapitre 18 ChimieDocument3 pagesChapitre 18 ChimieIbrahimaPas encore d'évaluation
- TleD CH L4 Acides Carboxyliques Et DérivésDocument11 pagesTleD CH L4 Acides Carboxyliques Et DérivésHakeem TraorePas encore d'évaluation
- TleD - CH - L4 - Acides Carboxyliques Et DérivésDocument11 pagesTleD - CH - L4 - Acides Carboxyliques Et DérivésHamadi DialloPas encore d'évaluation
- Diols PDFDocument9 pagesDiols PDFDaoui Ibtihel100% (2)
- Wa0006Document135 pagesWa0006Yc Yacine100% (1)
- Cour L2PC 2023 ALCYNEDocument13 pagesCour L2PC 2023 ALCYNEemmanuel cerda adonaïPas encore d'évaluation
- Corrigé Centrale 2010 Acide OxaliqueDocument6 pagesCorrigé Centrale 2010 Acide OxaliquePascal FrajmanPas encore d'évaluation
- Chapitre 4 Les Réactions Doxydo ReductionDocument57 pagesChapitre 4 Les Réactions Doxydo ReductionabdelouahedPas encore d'évaluation
- Chimie WD 1s1-s2 PDFDocument71 pagesChimie WD 1s1-s2 PDFAdaPas encore d'évaluation
- Chapitre IDocument9 pagesChapitre ISamira MossaddikPas encore d'évaluation
- C 00 XP 1 CDocument13 pagesC 00 XP 1 CMihnea GamanPas encore d'évaluation
- AlcDocument3 pagesAlcslimdamak100% (1)
- Cours de Chimie Organique S1 Master MEPCDocument52 pagesCours de Chimie Organique S1 Master MEPCOumayma El YamaniPas encore d'évaluation
- Chapitre 2 - Aldehydes& Cetones ModDocument104 pagesChapitre 2 - Aldehydes& Cetones ModYoussef Aouin100% (1)
- Chimie Oraganique 2 SMC4Document126 pagesChimie Oraganique 2 SMC4Yc YacinePas encore d'évaluation
- 2010 Lyon Walchshofer Radix AlcanesCoursDocument2 pages2010 Lyon Walchshofer Radix AlcanesCoursAlisson AlainPas encore d'évaluation
- MP CHIMIE CCP 1 2013.enonceDocument7 pagesMP CHIMIE CCP 1 2013.enonceMohssine ElaissaouiPas encore d'évaluation
- Corrige HEI Chimie-Organique 1999 CHIMIEDocument7 pagesCorrige HEI Chimie-Organique 1999 CHIMIENawal ZakriPas encore d'évaluation
- ALCENESDocument8 pagesALCENESHadjer zitPas encore d'évaluation
- U4orgaanas1 99cDocument2 pagesU4orgaanas1 99cEssamiPas encore d'évaluation
- Ts Chi 1 CorrectionexocoursDocument3 pagesTs Chi 1 CorrectionexocoursfePas encore d'évaluation
- Synthèse Chimie - Les Grandes Réactions ChimiquesDocument21 pagesSynthèse Chimie - Les Grandes Réactions ChimiquesAdrien StandaertPas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- c1 Les AlcoolsDocument6 pagesc1 Les AlcoolsComan SakoPas encore d'évaluation
- Chapitre VDocument14 pagesChapitre VHåmēd Bën MåkhtārįPas encore d'évaluation
- Chapitre IIIDocument6 pagesChapitre IIIDas UnbekanntePas encore d'évaluation
- Session 1 2019-20 CorrigéDocument4 pagesSession 1 2019-20 CorrigéJULIENPas encore d'évaluation
- Chimie OrganiqueS3Document70 pagesChimie OrganiqueS3Akram OmariPas encore d'évaluation
- Isom Rie Et ST R Oisom Rie FC PCDocument64 pagesIsom Rie Et ST R Oisom Rie FC PCMohamed Ben talebPas encore d'évaluation
- Universite Cheikh Anta Diop de Dakar - Faculte Des Sciences Et Techniques - Departement de ChimieDocument9 pagesUniversite Cheikh Anta Diop de Dakar - Faculte Des Sciences Et Techniques - Departement de Chimieyasmine joopPas encore d'évaluation
- 1er Cours de Chimie OrganiqueDocument6 pages1er Cours de Chimie Organiquesalah100% (1)
- Description Des Fonctions Chimiques Simples2017Document16 pagesDescription Des Fonctions Chimiques Simples2017BikondPas encore d'évaluation
- Solutionnaire Chapitre 5 PDFDocument4 pagesSolutionnaire Chapitre 5 PDFBoubs SelkaPas encore d'évaluation
- Serie 1 Electrochimie Avec CorrectionDocument14 pagesSerie 1 Electrochimie Avec Correctionimad sahliPas encore d'évaluation
- Exercices7 Pair PourbaixDocument4 pagesExercices7 Pair PourbaixEl mrtb hamzaPas encore d'évaluation
- Chap4 OrganiqueDocument19 pagesChap4 OrganiqueMostafa McafsPas encore d'évaluation
- Alcènes Énoncés ExercicesDocument62 pagesAlcènes Énoncés ExercicesMaxime EidelsbergPas encore d'évaluation
- Oxydation Des AlcoolDocument3 pagesOxydation Des AlcoolJacobPas encore d'évaluation
- Isomérie Plane 1Document13 pagesIsomérie Plane 1adnan aitlahcPas encore d'évaluation
- Aldehydfes Et Cetones1Document6 pagesAldehydfes Et Cetones1Abdoul karim SamakePas encore d'évaluation
- Ex Amen 20123Document4 pagesEx Amen 20123med yahyaPas encore d'évaluation
- Travaux Dirigees de Resistance Des Materiaux Corrige PDFDocument71 pagesTravaux Dirigees de Resistance Des Materiaux Corrige PDFGenie MecaPas encore d'évaluation
- RDM RechercheDocument149 pagesRDM Rechercheelycheikh.menePas encore d'évaluation
- Exercices de TD Chromatographie Liquide Et GazDocument6 pagesExercices de TD Chromatographie Liquide Et Gazelycheikh.menePas encore d'évaluation
- Chimie MecanismesReactionnelsDocument6 pagesChimie MecanismesReactionnelsAshall David WheiPas encore d'évaluation
- PC 1ère CD-C6 Quelques Composés Oxygénés PDFDocument11 pagesPC 1ère CD-C6 Quelques Composés Oxygénés PDFZanaple CoulibalyPas encore d'évaluation
- tp1 AlternatifDocument4 pagestp1 AlternatiflordcutyPas encore d'évaluation
- Serie #8 Passage Entre Les Derives Des Acides CarboxyliquesDocument3 pagesSerie #8 Passage Entre Les Derives Des Acides CarboxyliquesMahmoud Essahbi Sahbi Daghsni100% (2)
- Nomeclature Des Composés OrganiquesDocument32 pagesNomeclature Des Composés OrganiquesmehdiPas encore d'évaluation
- 2023 NelleCaledo J1 Exo1 Sujet PLA 9ptsDocument5 pages2023 NelleCaledo J1 Exo1 Sujet PLA 9ptsl.garidouPas encore d'évaluation
- Chimie 4 (Chap 1 Et 2)Document65 pagesChimie 4 (Chap 1 Et 2)Kamel TouatiPas encore d'évaluation
- Orga 35Document3 pagesOrga 35elycheikh.menePas encore d'évaluation
- Correction TP AspirineDocument1 pageCorrection TP AspirinesangohangsxrPas encore d'évaluation
- Site 164 332650830Document68 pagesSite 164 332650830adn1234100% (1)
- C01 (Exos) Polymeres PlastiquesDocument2 pagesC01 (Exos) Polymeres PlastiquesAchwak Belfadel100% (1)
- Résumé Chimie 4 EasyCPSTDocument42 pagesRésumé Chimie 4 EasyCPSTTIHAL Wassim AmdjedPas encore d'évaluation
- Acide DicarboxyliqueDocument6 pagesAcide DicarboxyliqueFrederic WustPas encore d'évaluation
- CHIMIE - 1re CD - LES COMPOSES OXYGENESDocument3 pagesCHIMIE - 1re CD - LES COMPOSES OXYGENESPatrick NgondamaPas encore d'évaluation
- Les Amides AliphatiquesDocument8 pagesLes Amides AliphatiquesMahmoud Gazzah100% (1)
- 4.1.3-Modélisation de La Cristallisation de La MGL en Phase Continue Et DisperséeDocument301 pages4.1.3-Modélisation de La Cristallisation de La MGL en Phase Continue Et DisperséeTayeb BouazizPas encore d'évaluation
- 3 Exer 4eme Atomes MoleculesDocument2 pages3 Exer 4eme Atomes MoleculesXeresPas encore d'évaluation
- Le Savon PDFDocument18 pagesLe Savon PDFLawrence Mundene-timothee100% (1)
- Klubprepa Extrait 7517Document10 pagesKlubprepa Extrait 7517HamZa RaouguiPas encore d'évaluation
- Acides Carboxyliques Et Leurs DerivesDocument12 pagesAcides Carboxyliques Et Leurs DerivesSamba BarhamPas encore d'évaluation
- U10 CorrigDocument14 pagesU10 CorrigJohanna PeterPas encore d'évaluation
- Fascicule de Cours LipidesDocument25 pagesFascicule de Cours LipidesFukaiPas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- A 16 Synthèse de l' Arôme de La Banane FinalDocument4 pagesA 16 Synthèse de l' Arôme de La Banane FinalRodrigo FierroPas encore d'évaluation
- Exercice 1 (7 Points) Cinétique de La Synthèse de L'iodure D'hydrogèneDocument8 pagesExercice 1 (7 Points) Cinétique de La Synthèse de L'iodure D'hydrogèneAli RammalPas encore d'évaluation
- Godard A. Nouveaux Procédés Verts D'oxydation de L'acide OléiqueDocument277 pagesGodard A. Nouveaux Procédés Verts D'oxydation de L'acide OléiqueniebelungenPas encore d'évaluation
- Brochure de Chimie PDFDocument12 pagesBrochure de Chimie PDFAbdoul karim DansokoPas encore d'évaluation
- Cours Nomenclature Méd - Dent Version 4 - 3Document65 pagesCours Nomenclature Méd - Dent Version 4 - 3ghedhaifiPas encore d'évaluation
- Les Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtDocument4 pagesLes Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtNjipnangPas encore d'évaluation
- 3éme SC Acide Carboxiliques Et Ses DérivésDocument4 pages3éme SC Acide Carboxiliques Et Ses DérivésJihed HorchaniPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation