Académique Documents
Professionnel Documents
Culture Documents
Contribution A L'Étude de La Gynécomastie en Pratique Hospitalière A Bamako Au Mali
Transféré par
IbrahimTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Contribution A L'Étude de La Gynécomastie en Pratique Hospitalière A Bamako Au Mali
Transféré par
IbrahimDroits d'auteur :
Formats disponibles
MINISTERE DE L’ENSEIGNEMENT Un Peuple- Un But- Une Foi
SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
ANNEE UNIVERSITAIRE : 2009-2010 N0…/
CONTRIBUTION A L’étude
DE LA Gynécomastie EN PRATIQUE
Hospitalière A BAMAKO AU MALI
Présentée et soutenue publiquement le 07./02/2011 devant
la Faculté de Médecine, de Pharmacie et d’Odonto-Stomatologie
Par :
Mlle. DJEUGOUE NGALEU Paulette.
Pour obtenir le grade de Docteur en Médecine (DIPLOME D’ÉTAT)
Président : Pr Sadio YENA
Membres : Dr Augustin THERA
Dr KAYA Assetou Soucko
Directeur de thèse : Pr SIDIBÉ Assa Traoré
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
DEDICACES
Je dédie ce travail
Au Seigneur Dieu tout le Puissant
Toi qui me connais mieux que quiconque et ce par quoi je suis passée. Tes
grâces ont abondé dans ma vie et ta Fidélité a été sans faille malgré mes
infidélités. Merci pour ton soutient constant et permanant dans toutes les étapes
de ma vie. Ta présence a été manifeste et permanente pendant mes plus grands
moments de solitude. Ta protection et tes bienfaits pour moi ont été sans limite.
Reçois toute la gloire parce que tu en es digne. Tous les mots que je pourrai
prononcer ne pourraient exprimer la reconnaissance de mon cœur. Puisses-tu
l’écouter te louer toujours.
A mes merveilleux parents M DJEUGOUE Gaspard et Mme
DJEUGOUE née JOUGOUE Marie-Anne
Côté parents on ne peut pas rêver mieux que vous. Vous n’avez ménagé
aucun effort pour nous donner (mes frères, sœurs et moi) le meilleur. Nous vous
avons vu à l’œuvre depuis notre plus tendre enfance, sacrifier tout pour nous
permettre de réaliser nos rêves. Et aujourd’hui un autre rêve va se réaliser grâce
à vous. Merci pour tous les sacrifices faits pour moi. Je sais que ca a été dur
pour vous surtout que je ne suis pas toujours un enfant facile. C’est beau d’avoir
un père qui change facilement un morceau de craie contre une houe pour
rapporter de quoi manger à sa famille. Et une mère qui reprend le travail une
semaine après l’accouchement. Femme active et maman parfaite au foyer. Ce
travail est le fruit de vos efforts acharnés. Comme j’aime souvent le dire vous
êtes des « parents en or ». Puisses Dieu vous garder encore longtemps à nos
côtés.
A mon grand frère feu Dan Rostand FANSI DJEUGOUE.
Malgré ta maladie qui a duré toute ta vie, tu as été un modèle de grand frère
par ton accueil et ta tendresse. Tu as été brutalement arraché à notre affection et
ça fait dix ans déjà ! Ta vie n’a pas été facile. J’espère que tu ne souffres plus là
où tu es. Puisses-tu reposer en Paix !
DJEUGOUE NGALEU paulette Thèse de médecine
2
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A mes sœurs
Lucie-Terrance DJEUGOUE, Alvine FOMEKONG DJEUGOUE, Marcelle
DJEUGOUE, Grace williness DJEUGOUE Gaelle DJEUGOUE, Eunice
Annie DJEUGOUE, Junias DJEUGOUE, Manuella DJEUGOUE. Des filles
pas comme les autres ! Vous êtes mes sources d’inspiration et celles vers qui je
me tourne pour retrouver le sourire. Merci pour les toutes les privations que
vous avez un peu « subies » pour que je puisse réaliser mes rêves. Que Dieu
vous le rende au centuple.
A mon petit frère Pascal Claude DJEUGOUE TOUMENI
Tu comptes beaucoup pour toutes tes sœurs et pour moi en particulier. Tu
incarnes la force tranquille dans la famille. Bon courage dans tes études malgré
les conditions difficiles dans lesquelles tu évolues. Que Dieu te soutienne et que
très vite tu aies ton doctorat.
A ma feue arrière grand-mère affectueusement appelée Mami Maa
(Mars 2008), et ma regrettée grand-mère feue TOUMENI Thérèse
que nous appelions Mami Trè (Janvier 2011).
J’ai reçu des bénédictions de vous quand je venais pour ces études. J’aurai
aimé que vous soyez là pour voir que vos bénédictions ont porté du fruit.
J’espérais tellement qu’au moins toi mami Trè tu aies l’occasion de me voir
médecin. Mais Dieu en a décidé autrement. Que vos âmes reposent en paix.
A mes amies Dr Patricia Eyoup, Dr Neuilly Tafo, Dr Christelle
Monkam, Dr Estelle Benga, Dr Ariane Njanja
Les filles de la « D.A ». Nous sommes passées par beaucoup d’étapes en sept
années de vie commune. Ensemble nous avons connu des joies et des tristesses,
l’abondance et la disette, les ententes parfaites et des querelles atroces et nous
avons été plus fortes que tout ça. Je ne sais pas à quoi aurait ressemblé mon
séjour dans ce pays sans vous. Ce que je sais c’est que vous l’avez illuminé par
votre présence. Bien plus que des amies vous êtes des sœurs pour moi. Que Dieu
vous bénisse dans vos vies et vos carrières respectives. Merci aussi pour mes
neveux Ange Llyod, Lena Yedidjia et Danielle.
DJEUGOUE NGALEU paulette Thèse de médecine
3
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
REMERCIEMENTS
Mes remerciements vont :
Au Mali et au peuple malien
Pour leur accueil et pour les connaissances que j’ai reçues.
A ma famille d’accueil KAMATE Jean, maman, Mariam, Salomon,
Tanti Niagali, Tonton Moussa, Tonton Pierre à Dakar et à Bamako
Merci parce que vous n’avez pas fait de distinction entre moi et vos propres
enfants. Pour mon intégration complète à la famille et pour votre soutient sur
tous les plans. Par vous je suis devenue une malienne et en plus une « bobo ».
A papa Raphaël et maman Marie Fameni et leurs enfants à Douala.
Vous êtes notre point d’encrage à Douala. Merci pour l’attention de parents
que vous m’avez portée et vos encouragements.
A mes maîtres
Pr Hamar Traoré ; Pr Abdel Kader Traoré ; Pr Mamadou Dembélé ; Pr
Sidibé Assa Traoré ; Dr Kaya Assétou Soukho ; Dr Ibrahim Nientao ; Dr
Idrissa Coulibaly ; Dr Christophe Sawadogo ; Dr Youssouf Fofana ; Dr
Seydou Coulibaly.
Merci pour la formation à vos côtés.
Au Pr Sidibé Assa Traoré
Vous êtes un professeur formidable. Vous alliez la rigueur de l’enseignant et la
tendresse de la mère que vous êtes pour tous vos étudiants. Nous avons éprouvé
un réel plaisir d’apprendre à vos côtés. C’est en grande partie à cause de votre
volonté ferme que ce travail a pu voir le jour. Vous et votre enseignement sur
plusieurs plans (académique, social), sont pour toujours gravés dans nos
mémoires. Que le Seigneur vous comble de ses bienfaits.
DJEUGOUE NGALEU paulette Thèse de médecine
4
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Remerciement particulier à des personnes qui sont intervenues de façon
directe à l’élaboration de ce travail : Alvine DJEUGOUE ; Dr Abdoul
Karim Dao, Dr BAMBATSI Romarick, Sekou CISSE, Dr Youssouf
FOFANA.
Vous savez personnellement de quelle façon vous m’avez aidée dans ce
travail. Merci pour tout.
A mes frères et sœur du groupe « campus pour Christ FMPOS »
Rosine Awomo, Rosine Kwuissu ; Dr Chaya Nadège ; Clémence ;
Merveille ; Nuptia ; Linda Mogode ; Linda N; Hama KANAMBAYE, Yaya
Ibrahim B; Pierre ; Christel N ; Levis K ;Denis Kone, Amos Kodio, Adhemar
DJOMGWE, Marcele, Noellie, Lecson… Que Dieu vous bénisse pour tout. Et
que notre ministère soit visible au sein de cette faculté.
Aux Missionnaires
Lacosta SUAMI, Carlos Kalongo, Toussaint M, Gédéon K. Merci pour
vos conseils et pour vos prières j’aurai bien aimé vous connaître plus tôt. Que
Dieu vous accorde de prospérer et bénisse vos ministères respectifs.
A mes pères de Bamako
Dr Patrick TOUKO, Dr Théodore SALA B, Dr Martin N, Dr Thierry
EPOK, Dr Franck NGOKA, Dr Franklin SAMOU, Dr Géraldine
KAMGNO TABOUE, Dr Jean- Paul MAGADJI ... Vous avez guidé mes
premiers pas au Mali.
A mes filles de Bamako
Nadège PEYO, Erika DJABA, Félicité KAPCHE, Chantale la « first lady »,
Nelly Flaure LATAGUIA, Muriel MOUSSIMA, Dominique, sans oublier
Raymond NJOCK, j’ai beaucoup appris de vous
A mes voisins dans la cour (Sun City)
Dr Virginie Kamdem et famille ; Dr Eliane NGONGANG et famille, Julie
K, Dorine W, Mariam, Yao et Arnaud A, Marius et Jacques, Nicolas, Anani S,
Maurice A, Kone, Nelly, Guy-Bertrand, Téko, Rodrigue(Coco), Yannick T,
Cedrick S, Cédrick Y, Merci pour les fous rires
DJEUGOUE NGALEU paulette Thèse de médecine
5
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A mes oncles et tantes,
Merci pour l’encadrement et l’éducation.
A mes cousines et cousins Marie Madeleine, Rosalie, Antoinette et
Augustin, feu Josiane, Dorcas, Eddy Franck et Annie, Vanina,
Corine Sorel, Chimène, Andrienne et famile., Gamaliel, Peniel … Et
leurs enfants.
Nous avons passé de bons moments ensemble. Recevez mes remerciements
quelque soit le pays du monde où vous vous trouvez. Que Dieu nous accorde de
vivre en parfaite Cohésion.
A « Christina DJ »
Tu es mon DJ préféré. Ca en fait des circonstances, des rires et des pleurs.
Après une rencontre catastrophique j’ai appris à te connaître et à t’aimer telle
que tu es. Tu sembles sévère et fermée de prime abord. Mais à ton contact on se
rend compte que tu as un grand cœur. Merci d’avoir été mon « réveil » pendant
7 ans sans que tes pilles ne s’épuisent. Tu es certainement la personne avec qui
j’ai passé le plus de temps ici. Et tu sais que vivre avec moi c’est pas une mince
affaire. Je te dois beaucoup. Merci pour tout et que Dieu te guide dans ton
avenir.
A mes amis du Mali Willy Ariel ZONGO, Dr Kalilou Diallo, Dr Zire
Diarra, Dr Aliou Bah, Dr Abdoul Aziz Baby, Dr Abdoul Aziz Yacouba,
Dr Abdoul Aziz Djibrilla, Dr Abdoul Aziz Abidine, Dr Hamidou Maiga,
Dr Oumar Ag, Oumou M.
Je ne saurai tous vous citer juste un grand merci.
A mes amis du service de médecine Interne Dr Kalilou DIALLO, Dr
Romarick B, Dr Cédric Sidi, Dr Amagana TOGO, Dr Hadiza Amadou, Dr
Samake, Dr Drame Aminata H.T (ma partenaire de garde et de
nombreuses galères)
Aux DES et Internes du service de Médecine Interne
Au Personnel, infirmières et internes, du service de médecine Interne
DJEUGOUE NGALEU paulette Thèse de médecine
6
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Aux familles Yacouba DEMBELE en particulier Etienne et Eunice, et
Nouhoum SANGARE en particulier Aboubacar, Adam, Fatoumata,
Mah
Parce que vous êtes des exemples de la « DIATIGUIALA » qu’on reconnait
bien au Mali.
A la famille Napoléon SOB (Nap’s) et son épouse Assitan TRAORE
Merci pour tout le soutient dont j’ai fait l’objet pendant mon séjour à Bamako.
Vous êtes une famille très accueillante. Merci tout particulier à Sitan qui est ma
petite maman du point-G.
A mon « grand frère » Dr Abdoul Karim DEMBELE,
C’est tout simplement impressionnant tout ce que tu peux réaliser. Tu es un
homme à part. Même ton silence enseigne. Je ne peux même pas te souhaiter
bon courage tu en a déjà tellement !
A mes promotions SEGALEN et ALY GUINDO. Merci pour les bons
moments passés ensemble
A Paterne BIVIGOU Malgré la distance qui nous sépare tu as été d’un
grand et précieux réconfort. Merci pour ton soutient et pour tes prières.
A Jean Jacques EKOBIKA et Willy ZONGO j’ai été ravie du peu de
temps passé ensemble à Bamako.
A la famille KEITA dans laquelle j’ai résidé pendant tout mon séjour.
Merci de m’avoir supporté tout ce temps.
A la comunauté camerounaise au Mali.
En m’excusant d’éventuelles omissions, je vous prie de vous identifier à
ce travail qui n’aurait pu être sans votre apport.
DJEUGOUE NGALEU paulette Thèse de médecine
7
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A NOTRE MAÎTRE ET PRESIDENT DU JURY
Professeur Sadio YENA
Professeur agrégé en chirurgie thoracique
Chef du service de chirurgie thoracique de l’hôpital du Mali
Président de l’association malienne de télémédecine
Président d’honneur de l’association de lutte contre les maladies
cancéreuses du Mali
Président de la société de chirurgie thoracique et cardio-
vasculaire du Mali.
Honorable maître,
Nous sommes honorés du privilège que vous nous faites, en acceptant
de présider ce jury malgré toutes vos occupations.
Nous avons été séduits par votre dynamisme et votre rigueur dans le
travail et ceci depuis notre premier contact avec vous en stage
hospitalier.
Votre enseignement de qualité et votre simplicité font de vous un
maître admiré de tous.
Trouvez ici cher Maître, l’expression de notre profond respect
DJEUGOUE NGALEU paulette Thèse de médecine
8
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A NOTRE MAITRE ET JUGE
Professeur Niani MOUNKORO
Gynécologue obstétricien à l’hôpital Gabriel Touré
Maître assistant à la FMPOS
Cher maître,
Merci de nous accorder une partie de votre précieux temps, en faisant
partie de ce jury.
Vous avez toujours suscité en nous une grande admiration depuis
notre arrivée dans cette Faculté par votre calme, votre rigueur
scientifique et votre goût pour le travail bien fait.
Votre jugement est d’une grande importance pour la validation de ce
travail.
Nous vous prions d’accepter cher Maître l’expression de notre
profonde gratitude.
DJEUGOUE NGALEU paulette Thèse de médecine
9
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A NOTRE MAITRE ET JUGE
Docteur KAYA Assétou Soucko
Médecin Interniste
Maître assistant à ma FMPOS.
Cher maître,
Nous sommes très touchés par votre volonté parfaite et votre
disponibilité.
Nous sommes marqués par la qualité de l’enseignement reçu à vos
côtés et de l’attention dont nous avons été l’objet.
Nous sommes honorés de vous compter parmi les membres de notre
jury.
Vos critiques, vos suggestions sont d’un apport capital pour
l’amélioration de la qualité de ce travail.
Permettez nous, de vous exprimer toute notre reconnaissance et notre
respect.
DJEUGOUE NGALEU paulette Thèse de médecine
10
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
A NOTRE MAITRE ET DIRECTEUR DE THESE
Professeur SIDIBE Assa Traoré.
Maître de conférences agrégé en endocrinologie et maladies
métaboliques dans le service de médecine interne du C.H.U. du
Point G
Chargée des cours d’endocrinologie et de thérapeutique à la
FMPOS de Bamako
Chef du service d’endocrinologie à l’hôpital du Mali.
Cher maître,
C’est un immense honneur que vous nous avez fait en nous confiant
ce travail.
Nous avons été marqués par l’immense nombre de qualités que vous
rassemblez en vous seule.
Vous avez cette capacité impressionnante à allier sagesse, écoute,
conseils pour nous transmettre discipline, disponibilité et ponctualité.
Votre humilité, votre disponibilité et votre tendresse font qu’il est aisé
d’apprendre à vos côtés.
Vous êtes un réel modèle pour nous et nous ne vous remercierons
jamais assez pour votre intervention dans notre formation.
Veuillez agréer cher maître l’expression de notre profond respect et de
notre reconnaissance.
DJEUGOUE NGALEU paulette Thèse de médecine
11
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
SIGLES ET ABREVIATIONS
DHT: Dihydrotestostérone
AMH: facteur antimüllérien
hCG: hormone gonadotrophine chorionique
LH: Hormone luthéinisante
LRH: luteinizing releasing hormone
StAR: steroidogenesis activator protein
DHEA : déhydroépiandrostérone
SDHEA : Sulfate de déhydro-Androsténédione
LDL: Low Density Lipoprotein
PBR: (peripheral benzodiazepine receptor)
SCC: (side-chain clivage).
βHSD: β-Hydroxystéroïde déshydrogénase
ER: estrogen receptor ou récepteurs aux œstrogènes
T: Testostérone
E 2 : Œstradiol
CHU : centre hospitalier et universitaire
mm: millimètres
DJEUGOUE NGALEU paulette Thèse de médecine
12
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
PLAN
1. Introduction
2. Objectifs
3. Généralités
3.1 Définition
3.2 Rappels embriologiques
3.3 Physiopathologie
3.4 Critères diagnostiques
3.5 Traitement
4. Méthodologie
4.1 Cadre d’étude
4.2 Période et type d’étude
4.3 Population d’étude
4.4 Critères d’inclusion
4.5 Critères de non inclusion
4.6 Méthode et recueil des données
4.7 Problèmes d’étique
5. Résultats
5.1 Aspects épidémiologiques
5.2 Aspects Cliniques
5.3 Données paracliniques
5.4 Données thérapeutiques
6. Commentaires et discussion
6.1 Aspects épidémiologiques
6.2 Aspects socio-démographiques
6.3 Aspects cliniques
6.4 Aspects paracliniques
Conclusion
Recommandations
Références bibliographiques
DJEUGOUE NGALEU paulette Thèse de médecine
13
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
1. INTRODUCTION
La gynécomastie, développement excessif du sein chez l’homme constitue un
motif fréquent de consultation chez l’adolescent et l’adulte jeune [1]. Le terme
gynécomastie provient du grec « gyne » et « mastos », soit littéralement poitrine
de femme. Cette augmentation du volume mammaire résume la plus grande
partie de la pathologie mammaire de l’homme puisque les tumeurs bénignes ou
malignes du sein sont exceptionnelles.
La gynécomastie asymptomatique, ou développement du tissu glandulaire du
sein, est fréquente chez les hommes âgés. Elle est retrouvée à l’examen
physique chez un tiers à deux tiers de ceux-ci et dans 40 à 55% des cas à
l’autopsie.
Le développement mammaire est habituel dans les deux sexes à la naissance.
60% des adolescents présentent une gynécomastie à la puberté avec une
incidence maximale qui se situe vers l’âge de 14 ans. Cette dernière va régresser
habituellement en l’espace de 1 à 3 ans. Lorsqu’elle survient en période
pubertaire, isolée, il s’agit probablement d’une gynécomastie idiopathique. Il est
toutefois nécessaire de proposer une stratégie diagnostique de prise en charge
pour ne pas passer à côté de formes secondaires. La difficulté est de savoir où
finit la physiologie et où commence la pathologie. [2, 3,4]
Théoriquement, la véritable gynécomastie n’est liée qu’à la glande
mammaire, et la fausse gynécomastie ne contient que la graisse. En pratique, les
deux composantes, glandulaire et graisseuse sont très souvent associées. Alors
que les principales étiologies responsables d’une gynécomastie sont bien
connues, la prise en charge de cette hyperplasie mammaire, bien que fréquente,
reste non consensuelle et a fait l’objet de plusieurs publications.
En Afrique, quelques études ont été réalisées sur ce sujet [2, 4, 5], elle pose
un réel problème sur le plan esthétique et est par conséquent souvent mal tolérée
sur le plan psychologique.
Au Mali, nous ne disposons d’aucune donnée en la matière d’où l’intérêt de
cette étude.
Dans ce travail, nous nous proposons d’étudier les aspects
sociodémographiques, cliniques et paracliniques de la gynécomastie en pratique
hospitalière à Bamako.
DJEUGOUE NGALEU paulette Thèse de médecine
14
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
2. OBJECTIFS
Objectif général
Etudier la gynécomastie en consultation endocrinologique à Bamako.
Objectifs spécifiques
Déterminer la fréquence des gynécomasties en consultation
endocrinologique.
Décrire les modalités socio-démographiques de la gynécomastie.
Décrire les caractéristiques cliniques, paracliniques et thérapeutiques de la
gynécomastie.
DJEUGOUE NGALEU paulette Thèse de médecine
15
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3. GENERALITES
3.1. DEFINITION
La gynécomastie correspond à une hyperplasie non tumorale de la glande
mammaire.
Elle touche généralement les deux seins mais peut cependant être unilatérale.
Ceci peut paraître paradoxal, surtout lorsqu’une étiologie endocrinienne doit être
retenue, mais s’explique par la différence de sensibilité hormonale des
récepteurs présents au niveau du tissu mammaire [1].
3.2. RAPPELS EMBRIOLOGIQUES ANATOMIQUES ET PHYSIOLOGIQUES
3.2.1 Rappels sur la glande mammaire [6]
Développement prénatal
Dès la 4e semaine de la vie fœtale, des cellules épithéliales dérivées de
l'ectoderme prolifèrent dans le mésenchyme sous-jacent appelé « crête
mammaire ». Cet épaississement épithélial s'étend de la future aisselle à la future
aine de chaque côté de la face ventrale de l'embryon. Passé un stade globulaire
(7-8e semaine) les deux crêtes mammaires régressent, laissant subsister les deux
bourgeons mammaires.
L'invasion du mésenchyme sous-jacent par les cellules épithéliales se fait dès
la 5e semaine. Il est vraisemblable que le tissu graisseux se constitue pendant la
période anténatale et contribue au développement des canaux [7]. Entre la 10e et
la 12e semaine, les bourgeons épithéliaux envahissent le parenchyme et forment
des lobules. Entre la 15e et la 20e semaine (embryon de 10 cm), c'est le stade de
branchement où 15 à 25 cordons épithéliaux vont envahir le parenchyme. De la
20e à la 32e semaine, ces cordons deviennent des canaux par desquamation et
lyse des cellules épithéliales centrales. La plupart des auteurs décrivent pendant
les 32-40es semaines un processus de développement alvéololobulaire avec des
vésicules terminales composées d'un épithélium et contenant du colostrum. [8,9]
Dans beaucoup d'espèces, le dimorphisme sexuel est contrôlé par les
androgènes fœtaux. Ce contrôle est démontré chez la souris où les tissus
épithéliaux déclenchent leur propre destruction en induisant au contact des
cellules du mésenchyme, l'apparition de récepteurs aux androgènes dans ces
mêmes cellules (fibroblastes et adipocytes) [10]. Cette sensibilisation aux
androgènes est suivie d'une nécrose du tissu épithélial. Le dimorphisme sexuel
ne se produit pas toujours en prénatal. Il se fait au moment de la puberté chez le
lapin par exemple. En revanche, chez l'humain, la période déterminante du
dimorphisme sexuel est inconnue. In utero et dans les premières années de la
DJEUGOUE NGALEU paulette Thèse de médecine
16
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
vie, il ne paraît pas y avoir de différence anatomique entre les seins des deux
sexes [8, 9, 11].
À la naissance, la glande mammaire est donc un simple système de canaux.
Les 15 à 20 orifices des canaux qui présentent quelques glandes de
Montgomery, s'ouvrent au niveau de l'aréole, peu développée. Chez le nouveau-
né des deux sexes, du 2e au 7e jour après la naissance, un gonflement du futur
mamelon, uni- ou bilatéral, peut survenir. Une sécrétion lactée, semblable au
colostrum, peut apparaître et persister plusieurs semaines [12]. Ce
développement mammaire temporaire est expliqué par le sevrage des estrogènes
maternels qui libèrent la production de prolactine par l'antéhypophyse [11].
Ensuite la glande mammaire se développe de façon isométrique jusqu'à la
puberté.
3 .2.2 Rappels sur les testicules
Le testicule est une glande mixte formée par un contingent endocrine et un
contingent exocrine. Les deux compartiments cellulaires sont séparés par une
membrane basale : l'interstitium et les tubes séminifères. La production
d'hormones stéroïdes est assurée par les cellules de Leydig situées dans
l'interstitium [13].
Le système endocrinien de l’homme adulte trouve son unité dans le vecteur de
ses messages : l’hormone [14].
Un androgène est une hormone stéroïdienne capable d’induire la différentiation
et la maturation des organes reproducteurs masculins, de stimuler les caractères
sexuels secondaires pour aboutir à un phénotype masculin normal [15] et
d’entraîner les modifications comportementales nécessaires au rôle de l’homme
dans la reproduction [16].
La testostérone, hormone mâle sécrétée par le testicule est l’androgène majeur
qui exerce une action quasi ubiquitaire dans l’organisme de l’homme. Cette
action se fait directement ou par l’intermédiaire de sa bioconversion en un
androgène plus puissant, la dihydrotestostérone (DHT) ou en un œstrogène
puissant, l’œstradiol (E2). Le maintien d’un niveau approprié d’androgènes
impose une production qui équilibre l’épuration métabolique et l’excrétion. [17].
3.2.2.1 Rappels embryologiques
La gonade primitive indifférenciée se développe chez l'embryon à partir de la
e
5 semaine de gestation. Elle est alors représentée par une simple saillie du bord
interne du mésonéphros, saillie épithéliale constituée par un épaississement de
l'épithélium cœlomique qui recouvre le corps de Wolff.
DJEUGOUE NGALEU paulette Thèse de médecine
17
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Elle surmonte un stroma conjonctif avec des cellules mésenchymateuses,
l'ensemble réalisant la crête génitale. Cette gonade primitive est bipotentielle
jusqu'à la 6e semaine de gestation. Elle est formée de trois parties :
- les cellules germinales primordiales qui donneront naissance aux
spermatogonies chez le mâle, aux ovogonies chez la femelle ;
- les cordons sexuels qui seront à l'origine des tubes séminifères chez le sujet
XY, des follicules primordiaux chez le sujet XX ;
- les cellules mésenchymateuses, ancêtres des cellules de Leydig chez le mâle,
des cellules de la thèque et du stroma chez la femelle.
L'organogenèse testiculaire commence chez le fœtus mâle à partir de la 7e
semaine. Les cellules germinales induisent la formation de tubes séminifères au
sein des éléments somatiques du blastème (mésenchyme et épithélium
cœlomique). Les cellules germinales sont entourées de cellules épithéliales qui
vont se différencier en cellules de Sertoli. Ces cellules vont sécréter le facteur
antimüllérien (AMH : « antimullerian hormone ») qui semble être aussi un
facteur de différenciation testiculaire.
Les cellules de Leydig se différencient au cours de la 9e semaine à partir du
mésenchyme. Une fois la gonade primitive différenciée en testicule, la
prolifération des cellules germinales et leur évolution s'arrêtent au stade de
spermatogonies. Les cellules de Sertoli produisent l'AMH, les récepteurs
hCG/LH apparaissent sur les cellules de Leydig permettant la biosynthèse de la
testostérone sous l'influence de hCG. Tout est donc en place pour la
différenciation du sexe phénotypique [18].
3.2.2.2 Rappels anatomiques
Les testicules, gonades mâles productrices de spermatozoïdes sont localisés
dans le scrotum. Les testicules ont la grosseur d’olives et mesurent environ 4 cm
de long et 2,5 cm de diamètre. Ils sont recouverts de deux tuniques. La tunique
superficielle est la vaginale du testicule, ou tunique vaginale, formée de deux
feuillets dérivée du péritoine. La tunique profonde est albuginée, la capsule
fibreuse du testicule. Des projections de l’albuginée forment les cloisons du
testicule, qui divise celui-ci en 250 à 300 compartiments en forme de coins appelés
lobules. Chaque lobule renferme de 1 à 4 tubules séminifères contournés.
Ce sont ces tubules qui fabriquent les spermatozoïdes. Les tubules séminifères
contournés de chaque lobule convergent vers un tube séminifère droit qui
transporte les spermatozoïdes jusqu’au rété testis, un réseau de canaux situé dans la
DJEUGOUE NGALEU paulette Thèse de médecine
18
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
partie postérieure du testicule. A partir du rété testis, les spermatozoïdes quittent le
testicule par les canalicules et pénètrent dans l’épididyme, qui épouse la surface du
testicule [19].
Le tissu conjonctif qui recouvre les tubules séminifères contournés renferme les
cellules intersticielles, ou cellules de Leydig. Ces cellules synthétisent les
androgènes(en particulier la testostérone) et les libèrent dans le liquide intersticiel
où elles baignent. Ce sont donc deux populations cellulaires tout à fait distinctes
qui produisent les spermatozoïdes et les hormones dans le testicule [13, 18, 19].
Les testicules sont irrigués par les artères testiculaires, qui naissent de l’aorte
abdominale. Les veines testiculaires drainent les testicules. Elles constituent une
ramification d’un réseau appelé plexus pampiniforme (un pampre est une branche
de vigne) autour de l’artère testiculaire. Ce plexus absorbe la chaleur du sang
artériel afin de le rafraîchir avant son entrée dans le testicule. Il s’agit donc d’un
moyen de maintenir la basse température nécessaire à la physiologie normale des
testicules [19].
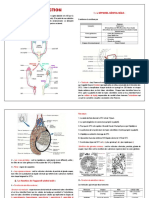
(c)
Figure I : Structure interne du testicule.(a) Coupe sagitale du testicule et de l’épididyme
(b) Coupe transversale de portions de tubules séminifères contounés(c) vue externe de
testicule d’un cadavre ; même qu’en (a).
Le tissu interstitiel compartiment à fonction endocrine du testicule, se
compose de :
- cellules de Leydig qui sont des groupes de cellules fusiformes, arrondies ou
polygonale. Ces cellules occupent les espaces triangulaires compris entre les
tubes séminifères ;
DJEUGOUE NGALEU paulette Thèse de médecine
19
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
-vaisseaux et de capillaires sanguins à endothélium fenêtré ;
-un important réseau de vaisseaux lymphatiques, et d’un tissu conjonctif peu
abondant.
Les cellules de leydig produisent un stéroïde androgène, la testostérone. La
structure et la fonction endocrine de ces cellules dépendent de l’hormone LH.
Par rétroaction négative, les cellules de Leydig contrôlent la sécrétion de LRH
(luteinizing releasing hormone) : baisse de la testostérone provoque la libération
de LRH, puis celle de LH qui active la sécrétion de cellules de Leydig [18].
3.2.2.3 Rappels physiologiques du testicule endocrine
3.2.2.3.1 Physiologie du testicule endocrine fœtal
La démonstration du rôle endocrine du testicule fœtal a été faite par Jost chez
le lapin [31]. Le testicule fœtal sécrète l'hormone antimullérienne, qui favorise la
régression des canaux mullériens, et la testostérone, qui assure la
masculinisation de l'embryon [13].
La sécrétion d'hormone antimullérienne apparaît au moment de la
différenciation des tubes séminifères primitifs, dès la 7e ou 8e semaine. Elle agit
avec un maximum d'intensité jusqu'à la 10e semaine, date à laquelle les canaux
de Müller ne sont plus retrouvés qu'à l'état de résidus chez l'embryon mâle. Elle
ne disparaît pourtant pas totalement car elle est retrouvée en petites quantités
dans le testicule prépubertaire [13, 32].
Les cellules de Leydig apparaissent dès la 8e semaine de la vie foetale. Elles
présentent alors tous les caractères ultrastructuraux de cellules stéroïdogènes.
Leur nombre augmente jusqu'à occuper 50 % du parenchyme testiculaire à la 16e
semaine. Ensuite, leur nombre décroît rapidement et les cellules de Leydig
disparaissent totalement quelques semaines après la naissance.
La sécrétion de testostérone est parallèle au développement du tissu
endocrine, avec un décalage de 15 jours. Elle atteint son maximum vers la 18e
semaine de la vie fœtale et produit des taux sériques équivalents à ceux de
l'adulte. Les taux de testostérone libre sont trois fois plus élevés que chez
l'adulte, mais cette augmentation des androgènes biodisponibles pourrait être
contrebalancée par les taux élevés d'œstradiol et de progestérone circulants.
DJEUGOUE NGALEU paulette Thèse de médecine
20
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Les cellules de Sertoli ont un rôle important, mais encore mal connu dans le
développement du testicule endocrine fœtal. Au cours de la vie embryonnaire,
l'apparition de cellules de Sertoli est le premier stade de la différenciation de la
gonade en testicule. La formation des tubes séminifères primitifs ne semble
dépendre ni de l'action de la FSH, ni de celle des androgènes. Ceci est conforté
par la formation in vitro de structures tubulaires par des cellules de Sertoli
isolées.
Le contrôle hormonal de la différenciation endocrine du testicule fœtal est
vraisemblablement assuré par la gonadotrophine chronique puisque au cours des
premières semaines de la vie embryonnaire, la LH n'est pas détectable dans le
plasma. Cette hypothèse est corroborée par la corrélation qui existe entre les
taux de testostérone, de gonadotrophine chronique et la densité de ses récepteurs
sur la membrane de la cellule de Leydig [13].
3.2.2.3.2 Physiologie du testicule endocrine du nouveau-né et de l’enfant
Au moment de la naissance, les taux de testostérone circulante sont élevés. Ils
décroissent ensuite en 5 à 10 jours de vie extra-utérine, puis augmentent à
nouveau pour atteindre un pic vers le 2e mois de la vie. Toutefois, ce pic ne
s'accompagne pas d'une élévation des taux de testostérone salivaire et laisse à
penser que les concentrations de testostérone libre ne varient pas dans le sang
périphérique.
Entre le 6e mois de la vie et le début de la puberté, la testostérone plasmatique
reste basse. L'examen du testicule en microscopie optique montre une involution
complète des cellules de Leydig. Seule la microscopie électronique à
transmission permet de mettre en évidence quelques cellules endocrines éparses
dans l'interstitium testiculaire. Mais l'existence de concentrations élevées de
testostérone dans le fluide séminal ponctionné dans des hydrocèles d'enfants
impubères prouve que la fonction endocrine du testicule n'est pas nulle à cette
période de la vie. Une sécrétion semblable n'a jamais été mise en évidence chez
la fillette impubère [13].
3.2.2.3.3 Physiologie de la stéroïdogenèse et du testicule endocrine de
l’adulte
La stéroïdogenèse testiculaire et surrénalienne donne naissance à de
nombreuses molécules qui sont soit des hormones finies, soit des substrats
intermédiaires libérés par excès [13].
DJEUGOUE NGALEU paulette Thèse de médecine
21
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
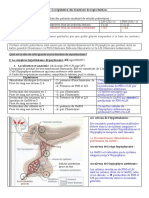
Hypothalamus LH-RH
Déhydroépiandrostérone (DHA)
Corticosurrrénales
Hypophyse LH FSH
Delta-4-androsténodione
Testostérone Estradiol (E2) Estrone (E1)
(T) Aromatase
Testicules
5-alpha-réductase Delta-4-androsténedione
Dihydrotestostérone
(DHT)
Figure 2 : Origine des stéroïdes sexuels chez l’homme. [3]
LH-RH: luteinizing hormone-Relizing Hormone; LH: luteinizing hormone
FSH: follicule stimulating hormone
La testostérone
La testostérone est le principal androgène circulant. Elle est le principal
stéroïde sécrété par le testicule, tant en quantité qu'en activité biologique. Elle
est produite de façon quasi-exclusive (plus de 95%) par les cellules de Leydig
du testicule. La production quotidienne est de 5 à 6 mg/24 h. Après castration, la
production de testostérone tombe à un niveau très faible, prouvant ainsi que la
contribution des glandes surrénales est négligeable [13, 17].
Le précurseur des androgènes est le cholestérol. Les cellules de Leydig
peuvent en assurer la synthèse à partir de l’acétate, mais elles utilisent surtout le
cholestérol extrait des lipoprotéines plasmatiques, et notamment de la fraction
de faible densité (LDL) [20], mais aussi celui des membranes cellulaires
(Figure4). Le cholestérol (C27) est transporté vers les mitochondries par un
mécanisme dépendant de la LH régulé par une protéine de transfert dite protéine
activatrice de la stéroïdogénèse (StAR ou steroidogenesis activator protein) [21]
dont le rôle essentiel a également été décrit dans la surrénale et l’ovaire [22]
ainsi que le cerveau [23].
DJEUGOUE NGALEU paulette Thèse de médecine
22
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Ce transfert intra-mitochondrial du cholestérol est l’étape limitante de la
stéroïdogenèse. PBR (peripheral benzodiazepine receptor) y participe de façon
minoritaire [24].
Figure 3 : Régulation de la stéroïdogenèse dans la cellule de Leydig [17]
Dans la mitochondrie, le début de la cascade de la stéroïdogenèse est marqué
par le clivage du cholestérol (C27) en prégnénolone (C21) par le cytochrome
P450 scc (side-chain clivage). La prégnénolone, biologiquement inactive, est
éjectée dans le réticulum endoplasmique où elle est métabolisée, notamment
sous l’action d’enzymes oxydatifs du groupe des cytochromes P450. La
prégnénolone est alors convertie en une variété de stéroïdes C19.
Deux voies sont possibles avant d’aboutir à la testostérone, désignées sous les
termes de voie 4 ou 5, suivant que les composés intermédiaires sont des 3-
céto, 4 stéroïdes ou des 3-hydroxy, 5 stéroïdes (Figure 4) :
- la voie préférentielle dans le testicule est la voie 5 qui fait intervenir en
premier P450 C17 qui est codé par le gène CYP17 dont l’expression est sous le
contrôle de la LH. Le premier composé intermédiaireα est la 17 -
hydroxyprégnénolone. Le clivage de la chaîne latérale fait apparaître le premier
stéroïde C19, la déhydroépiandrostérone ou DHEA. L’action du complexeβ 3 -
hydroxystéroide déshydrogénase/ 5- 4-isomérase (3 βHSD) la transforme en
DJEUGOUE NGALEU paulette Thèse de médecine
23
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
4-androstènedione, puis celle de la 17-β-hydroxystéroide déshydrogénase
(17βHSD réduisant le groupe cétonique 17 en OH) aboutit à la formation de
testostérone [17] ;
- la voie accessoire est la voie 4 qui fait intervenir en premier le complexe 3β-
hydroxystéroïde déshydrogénase 5- 4-isomérase pour former la progestérone
qui est hydroxylée en 17α -hydroxyprogestérone. L’action de clivage de P450 C17
la transformera en 4-androstènedione, premier C19 de cette voie minoritaire
[17].
Figure 4: Biosynthèse des stéroïdes chez l’homme. Les flèches rouges pleines
indiquent la voie préférentielle de la stéroïdogenèse dans les cellules de Leydig. La flèche
bleue discontinue indique les réactions catalysées par la 3βHSD et sépare schématiquement la
voie 5 à gauche et 4 à droite (17βHSD). La flèche rouge discontinue indique les réactions
catalysées par cette enzyme.
DJEUGOUE NGALEU paulette Thèse de médecine
24
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
La DHEA et la SDHEA
La DHEA et l’androstènedione sont également produits par la surrénale. Ce
sont des androgènes dits faibles en raison de la modestie de leur action
androgène et/ou de leur conversion possible en androgènes forts. Par exemple,
moins de 1% de la testostérone sérique provient de la DHEA. Cependant, à
l’intérieur même des cellules (intracrinologie), 30 à 50% de la synthèse des
androgènes proviendraient de la transformation de la DHEA, avec une formation
pratiquement ubiquitaire de stéroïdes sexuels, notamment dans le foie, la peau,
la prostate, l’os et le cerveau qui possèdent le matériel enzymatique nécessaire à
cette transformation.
La DHEA est en outre un neurostéroïde associé à des interactions avec les
neurotransmetteurs cérébraux [25, 26, 27]. La présence d’un possible récepteur
périphérique membranaire dans les cellules endothéliales et dans les cellules
musculaires lisses de la paroi artérielle a été récemment suggérée [17].
Le SDHEA n’a pas de rôle spécifique mais, en raison de sa demi-vie longue
(7-8h contre 15-30 minutes pour la DHEA) et de son interconversion continuelle
avec la DHEA [28], elle constitue une réserve importante de DHEA.
La dihydrotestosterone
C'est l'androgène actif au niveau des sites périphériques. Elle est synthétisée
localement par réduction de la testostérone par α la 5 -hydrogénase (la
testostérone a alors un rôle de prohormone). La présence de 5α -réductase a été
mise en évidence à de nombreuses reprises dans les cellules de Sertoli et dans
les spermatocytes. La dihydrotestostérone produite in situ intervient dans la
régulation de la spermatogenèse ; mais la quantité de dihydrotestostérone
testiculaire libérée dans le sang périphérique est mal connue et est négligeable
au regard de la production par les tissus périphériques. [13]
La 17β-œstradiol
La testostérone est métabolisée par l’aromatase en un œstrogène puissant,
l’œstradiol (E2). Cette aromatisation transforme également l’androstènedione en
estrone dont l’activité œstrogène est réduite. Cette aromatisation, source de 75-
90% des œstrogènes sériques de l’homme, a lieu dans les tissus périphériques,
principalement la graisse, mais aussi en quantité moins importante dans la peau,
le rein, l’os et le cerveau [29].
Une petite quantité d’œstrogènes est également sécrétée dans le sang
directement à partir du testicule (15%) et probablement aussi à partir des cellules
de Sertoli [48].
DJEUGOUE NGALEU paulette Thèse de médecine
25
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
L’homme produit approximativement 40 μg d’œstradiol et 60 μg d’estrone par
jour [29]. Il existe deux formes de récepteur aux œstrogènes(ER) encodés par
deux gènes distincts : ER-a et ER-b. ER-a prédomine dans l’hypothalamus et
l’hypophyse, alors qu’ER-b est présent dans le testicule et l’épididyme [17].
L’importance de l’œstradiol chez l’homme a été amplement confirmée par les
explorations d’hommes présentant une mutation de l’ER-α ou du gène de
l’aromatase. Ces hommes présentent des taux élevés de LH et de testostérone,
une grande taille en raison d’un retard de soudure des cartilages de croissance
épiphysaires, mais aussi une ostéopénie, ainsi qu’une hyperinsulinémie chez le
patient présentant une mutation de l’ER-α. La conversion tissulaire de la
testostérone en œstrogènes est par ailleurs essentielle pour la fertilité masculine
[17].
Autres stéroïdes
Le testicule et la glande surrénale sécrètent de nombreux stéroïdes au cours de
la synthèse des androgènes. Certains sont des intermédiaires connus de la
stéroïdogenèse. D'autres sont mal caractérisés. Leur rôle physiologique chez
l'homme est incertain. Ils ne semblent avoir un rôle effectif qu'en cas de carence
androgénique testiculaire.
Le testicule relargue également dans la circulation des précurseurs des
androgènes tels que la prégnénolone, la 17-hydroxyprégnénolone, la
progestérone, la 17-hydroxyprogestérone, la déhydroépiandrostérone et
l'androstènedione. La production de 17-hydroxyprogestérone par le testicule est
de 1 à 2 mg/j. Sa place dans l'action des stéroïdes est inconnue, mais la quantité
produite quotidiennement serait en faveur d'un rôle différent de celui de simple
précurseur.
Catabolisme de la testostérone
Dans les tissus, les voies de dégradation des androgènes dépendent du profil
enzymatique local. La majorité des réactions cataboliques se font dans le foie,
mais aussi dans la peau et la prostate pour aboutir à une élimination dans l’urine
ou par la peau. C’est la testostérone elle-même qui induit les enzymes
hépatiques responsables de son propre catabolisme. La testostérone est
catabolisée par trois voies métaboliques :
- La voie des 17-cétostéroïdes.
Le radical hydroxy en position 17 est oxydé en cétone par le foie. Cette voie est
de loin la plus importante en termes quantitatifs. Elle produit plusieurs
DJEUGOUE NGALEU paulette Thèse de médecine
26
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
milligrammes de composés qui sont concentrés dans les urines sous forme sulfo-
ou glucuronoconjuguée. Les 17-cétostéroïdes les plus importants sont
l'androstérone et l'étiocholanolone. Seule une partie des 17-cétostéroïdes
provient du catabolisme des stéroïdes testiculaires et il faut noter que la
castration n'affecte pas de manière significative la quantité de 17-cétostéroïdes
urinaires.
- La voie de la dihydrotestostérone et des androstanediols.
La double liaison du cycle A et la cétone en position 3 sont réduites conduisant
respectivement à la production de dihydrotestostérone et deα 3 - ou 3 β-
androstanediol. Ces réactions ont lieu dans les tissus cibles pour les androgènes.
- Un pour cent de la testostérone est excrétée sous forme glucuronoconjuguée
dans les urines.
Son dosage y est aisé mais a peu d'intérêt par rapport aux dosages sanguins qui
sont plus fiables.
Cet ensemble métabolique est très actif puisque la 1/2 vie de la testostérone
est de 12 minutes, ce qui implique une fabrication permanente par le testicule
[30].
3.2.2.3.4 Physiologie du testicule endocrine sénescent
Le vieillissement s'accompagne, chez l'homme, d'une réduction progressive
de l'activité génitale, de la fertilité, du volume testiculaire de la masse
musculaire et de la pilosité.
La testostérone est plus basse chez le sujet âgé, mais reste en moyenne dans
les limites normales. Cette diminution est le reflet d'un fléchissement de la
stéroïdogenèse testiculaire. Les taux de TeBG augmentent avec l'âge. Cette
augmentation s'accompagne d'une diminution de la testostérone plasmatique
biodisponible et d'une augmentation des taux plasmatiques de LH et de FSH. La
fréquence des pics de concentration périphérique des gonadotrophines
hypophysaires augmente au prix d'une dégradation du rapport des taux
plasmatiques de LH bioactive et immunoréactive.
Le vieillissement testiculaire s'accompagne d'une diminution de la réaction de
la réponse des cellules de Leydig à la stimulation par la LH. Ceci semble dû
essentiellement à une diminution du nombre total de cellules endocrines
présentes dans l'interstitium. L'étude des concentrations de précurseurs de la
testostérone dans la veine spermatique met en évidence une diminution de la
voie métabolique 5 [13].
DJEUGOUE NGALEU paulette Thèse de médecine
27
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.3. PHYSIOPATHOLOGIE DE LA GYNECOMASTIE
L’œstradiol est le facteur de croissance essentiel du sein. Il stimule la
prolifération des canaux galactophores et du stroma conjonctif. D’autres
hormones, comme le cortisol, la GH (growth hormone) stimulent la croissance
mammaire en présence d’œstradiol. En revanche, les androgènes ont un effet
répresseur sur le développement mammaire. Bien que la prolactine soit
l’hormone de la lactation, elle n’a pas d’effet direct sur le volume mammaire
[3].
Chez l’homme, l’œstradiol est sécrété directement au niveau des testicules
par les cellules de Leydig et de Sertoli. Cependant, la source principale
d’estrogènes (75%) provient de l’aromatisation périphérique des androgènes
d’origine testiculaire ou surénalienne [3].
L’apparition d’une gynécomastie est la conséquence d’un déséquilibre de la
balance hormonale entre les œstrogènes et les androgènes : augmentation de la
sécrétion d’œstradiol et /ou diminution de la sécrétion de testostérone
conduisant à un rapport T/E₂ abaissé (normal environ 200±50) .
Il existe trois cas particuliers qui représentent les gynécomasties physiologiques
[3, 34, 35] :
La poussée mammaire néonatale : il s'agit d'une manifestation assez
fréquente, révélée par la palpation chez 60 à 90% des nouveaux nés
[3,34]. Elle survient plus précocement chez le garçon que chez la fille.
On identifie trois stades : le stade I correspondant à une tuméfaction sous
aréolaire du mamelon, le stade II, cette tuméfaction déborde l'aréole et un
stade III où à la tuméfaction s'ajoute un écoulement mamelonnaire. Cette
poussée mammaire néonatale est spontanément résolutive et ne nécessite
aucun traitement [34].
La poussée mammaire pubertaire : cette manifestation est également
très fréquente touchant près de la moitié des garçons. Elle survient aux
alentours de13-14 ans et on retrouve souvent une notion héréditaire. Il
s'agit d'une tuméfaction bilatérale de petite taille, sensible, voire
douloureuse à la palpation. Elle peut quelquefois se compliquer. La
régression spontanée est classique en un à deux ans. C'est la raison pour
laquelle l'abstention thérapeutique est la règle. Cependant, en cas de
persistance d'une tuméfaction inesthétique, un traitement chirurgical peut
être proposé [34].
DJEUGOUE NGALEU paulette Thèse de médecine
28
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
La gynécomastie du vieillard : c'est une manifestation qui est assez rare.
Il faudra distinguer cette manifestation d'une gynécomastie iatrogène liée
aux traitements médicaux. Il s'agit le plus souvent d'une gynécomastie
liée à un hypogonadisme [34].
La gynécomastie pathologique peut résulter d’un de ces trois mécanismes de base :
insuffisance de la synthèse de testostérone ou de son action (avec ou sans
augmentation secondaire de la production d’œstrogènes),
augmentation de la production d’œstrogènes,
action des médicaments.
3.3.1 Déficit en testostérone
Le Fait qu’un déficit en testostérone puisse provoquer une gynécomastie est
illustré par le syndrome d’anorchidie congénitale au cours duquel des
concentrations normales en œstradiol(ou légèrement plus basses), associées à
une synthèse de testostérone profondément réduits entraînent une gynécomastie
importante.
La baisse de la synthèse de testostérone est aussi responsable de la
gynécomastie chez certains hommes atteints du Syndrome de Klinefelter ou
d’insuffisance testiculaire d’origine autre. Lors de résistance aux androgènes
comme lors du testicule féminisant, l’action déficiente des androgènes est
associée à une augmentation de la production testiculaire d’œstrogènes [36].
3.3.2Augmentation de la synthèse des œstrogènes
L’augmentation primaire de la synthèse d’œstrogènes peut avoir diverses causes.
L’augmentation de la sécrétion des œstrogènes testiculaires peut résulter de :
l’augmentation des gonadotrophines plasmatiques. Ce qui est le cas des
synthèses ectopiques des gonadotrophines chorioniques par des tumeurs
testiculaires ou par des carcinomes bronchogéniques,
d’éléments ovariens dans les gonades des hommes à hermaphrodisme
vrai,
de la synthèse d’œstrogènes par des tumeurs testiculaires(en particulier
des tumeurs de Leydig ou de Sertoli).
DJEUGOUE NGALEU paulette Thèse de médecine
29
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
L’augmentation de la conversion périphérique des androgènes en œstrogènes
peut être due soit à :
l’augmentation du substrat nécessaire (androsténédione),
la synthèse périphérique des œstrogènes (hyperplasie congénitale des
surrénales, hyperthyroïdie, et la plupart des tumeurs surrénaliennes
féminisantes),
la baisse du catabolisme de l’androsténédione (pathologies hépatiques), de
telle sorte que les précurseurs œstrogéniques sont déviés vers les
aromatases des tissus périphériques.
Les aromatases périphériques peuvent augmenter lors des tumeurs du foie ou
des surrénales, et plus rarement en présence des pathologies héréditaires qui se
manifestent par une gynécomastie chez les hommes atteints et par une
macromastie chez les femmes.
3.3.3 Action des médicaments
Des médicaments peuvent provoquer une gynécomastie par divers mécanismes.
Beaucoup agissent soit directement sous forme d’œstrogènes, ou
provoquent une augmentation de l’activité plasmatique des œstrogènes (par
exemple chez les hommes qui reçoivent du diéthylstilbestrol lors de cancer de la
prostate ou chez les transsexuels qui en reçoivent pour préparer l’intervention
chirurgicale du changement de sexe).
Les garçons et les jeunes hommes sont particulièrement sensibles aux
œstrogènes et peuvent développer une gynécomastie après avoir utilisé des
pommades dermiques à base d’œstrogènes ou ingérer du lait ou de la viande
provenant d’animaux traités aux œstrogènes.
La gynécomastie qui fait suite à l’utilisation des digitaliques est généralement
attribuée à un effet secondaire de type œstrogénique de ce médicament. Elle se
produit le plus souvent chez des hommes atteints de dysfonctionnement
hépatique.
Un second mécanisme par lequel les médicaments induisent une
gynécomastie est illustré par le clomifène et la gonadotrophine chorionique
humaine (hCG), qui provoquent une augmentation de la sécrétion testiculaire
d’œstrogènes.
DJEUGOUE NGALEU paulette Thèse de médecine
30
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
D’autres médicaments provoquent une gynécomastie en interférant avec la
synthèse de testostérone (kétoconazole et agents alkylants) et /ou l’action de la
testostérone par exemple, en bloquant la liaison des androgènes sur les
récepteurs protéiques au niveau des tissus cibles (spironolactone et cimétidine).
Enfin certains médicaments provoquent une gynécomastie par des
mécanismes non encore identifiés comme le bisulfan, l’étionamide, l’isoniazide,
le méthyldopa, les antidépresseurs tricycliques, les inhibiteurs de l’enzyme de
conversion de l’angiotensine, la pénicillamine, l’oméprazole, les inhibiteurs
calciques, le métoclopramide, les médicaments anti rétrovirus, le diazépam, la
marijuana et l’héroïne.
Dans certains cas, la féminisation est due aux effets de médicament sur la
fonction hépatique.
Le traitement par hormone de croissance peut provoquer une gynécomastie
même chez les garçons prépubères, ce qui suggère que l’hormone de croissance
elle-même ou un facteur de croissance insuline-like agit directement sur les
seins.
3.4. CRITERES DIAGNOSTIQUES
3.4.1 Diagnostic positif
3.4.1.1 Clinique
L’interrogatoire
L'interrogatoire oriente le diagnostic. Il faut rechercher des antécédents
familiaux du même type, des manifestations semblables à la puberté [34]. Il peut
aussi préciser la durée d’évolution et les caractères tels que la douleur.
L’examen physique
L’examen d’une gynécomastie se fait alors que le patient est allongé sur le dos,
les mains derrière la nuque. Cliniquement la gynécomastie est reconnaissable à
l’inspection, unilatérale, ou le plus souvent bilatérale et asymétrique,
accompagnée d’un élargissement ou d’un gonflement de l’aréole. Elle est
unilatérale chez près de la moitié des sujets [34, 35].
DJEUGOUE NGALEU paulette Thèse de médecine
31
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Aréole
Figure 5 : Examen d’une gynécomastie. Palpation entre le pouce et l’index de la
région sous aréolaire [35].
La palpation recherche également un écoulement mamelonnaire et
d’éventuelles adénopathies axillaires. L’examinateur palpe au moyen de son
pouce et de son index la région sous aréolaire. La palpation distingue le tissu
glandulaire ferme, un peu grenu de la gynécomastie du tissu plus homogène, à
limites moins nettes, de l’adipomastie.
Une vrai gynécomastie apparait comme une petite masse tissulaire, élastique,
molle ou ferme mais non indurée, située de façon concentrique par rapport au
mamelon et à l’aréole. Un nodule irrégulier excentré par rapport au mamelon
évoque un cancer mammaire. Contrairement au carcinome mammaire, dans la
gynécomastie il n’y a ni atteinte de la peau en regard, ni rétraction du mamelon,
écoulement ou ganglion axillaire. [34, 35]
La présence d’une galactorrhée signe une hyperprolactinémie. L'élargissement
et l'hyperpigmentation du mamelon avec saillie des tubercules de Montgomery
sont en faveur d'une hyperestrogénie. Une sensibilité douloureuse est fréquente
en cas de gynécomastie récente principalement dans les six premiers mois.
La palpation des testicules doit faire partie de l’examen clinique, à la
recherche d’une atrophie (hypogonadisme) ou d’une masse testiculaire (tumeur).
DJEUGOUE NGALEU paulette Thèse de médecine
32
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
L'examen clinique doit être complet en étudiant les caractères sexuels
secondaires (pilosité, habitus, répartition des graisses). Il doit également se faire
en examinant, en plus des testicules, la thyroïde, le foie et la peau (angiomes
stellaires, pigmentation anormale), recherchant ainsi les signes d’autres maladies
telles qu’une hépatopathie ou une hyperthyroïdie [34].
3.4.1.2 Paraclinique
L’imagerie ne doit pas faire partie du bilan systématique. Une mammographie
[9] et/ou une échographie mammaire permettent de mieux préciser les caractères
perçus lors de l'examen clinique et de confirmer le diagnostic de gynécomastie
surtout dans le cas où la distinction clinique entre une gynécomastie, une
lipomastie, et surtout un carcinome est difficile. La radiographie pulmonaire
permet de rechercher une tumeur broncho-pulmonaire. [34, 35]
En période pubertaire, en l'absence d'anomalie clinique, il n'est pas utile de
faire de bilan hormonal. Sur le plan biologique, le bilan hormonal doit
comporter : FSH, LH, prolactinémie, œstradiol et testostérone plasmatique,
HCG et TeBG. En fonction des résultats de ce bilan hormonal, un complément
plus orienté peut être demandé : une échographie testiculaire, un bilan
thyroïdien, hépatique ou surrénalien.
Figure 6: Deux cas de gynécomastie au Mali. A gauche gynécomastie biatérale
chez un homme de 22 ans. A droite gynécomastie unilatérale gauche chez un homme de 20
ans.
DJEUGOUE NGALEU paulette Thèse de médecine
33
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.4.1.3 Classification des gynécomasties
3.4.1.3.1 Anatomo-pathologique [35, 37]
Aspects macroscopiques :
Une gynécomastie diffuse est mal limitée et se confond en périphérie avec le
tissu mammaire adjacent.
Une gynécomastie circonscrite est d'aspect nodulaire, avec des limites nettes.
Dans les deux cas, la tranche de section est de coloration blanche, brillante et de
consistance souple ou ferme, homogène.
Aspects microscopiques
Classiquement, la gynécomastie revêt trois aspects microscopiques
• le type floride, caractérisé par :
- un accroissement numérique des canaux galactophores
- une hyperplasie épithéliale galactophorique d'aspect souvent micropapillaire,
parfois cribriforme.
- une hypercellularité et un oedème du tissu conjonctif péri-canalaire.
• Le type fibreux caractérisé par :
- un accroissement modéré du nombre des canaux qui sont parfois dilatés
- une hyperplasie discrète du revêtement galactophorique
- un tissu conjonctif dense fibro-collagène, pauci-cellulaire.
• Le type intermédiaire :
qui associe l'hyperplasie épithéliale galactophorique du type floride au tissu
conjonctif fibro-collagène du type fibreux.
L'hypothèse considérant ces trois types microscopiques comme des stades
successifs d'un même processus évolutif reste très controversée.
DJEUGOUE NGALEU paulette Thèse de médecine
34
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.4.1.3.2 Classification de Simon
C’est une classification qui s’intéresse au volume mammaire et à l’excès cutané.
Elle sert à l’évaluation avant la chirurgie [1, 38].
TABLEAU I : Classification de Simon [1].
Grade I Légère augmentation du volume mammaire sans
excès cutané.
Grade II a Augmentation modérée du volume mammaire
sans excès cutané.
Grade II b Augmentation modérée du volume mammaire
avec excès cutané.
Grade III Augmentation sévère du volume mammaire avec
excès cutané et sillon inflammatoire.
3.4.2 Diagnostic étiologique
Il existe des gynécomasties physiologiques liées à l’âge: nouveau né, puberté,
sujet âgé.
Les causes de gynécomasties sont nombreuses et les mécanismes sont divers.
3.4.2.1 Les causes médicamenteuses
Devant une gynécomastie, une étiologie médicamenteuse doit être
systématiquement recherchée, en particulier chez la personne âgée. Les produits
incriminés sont nombreux avec une causalité en règle établie à partir du principe
de l'interruption-réintroduction du médicament. Cependant, pour nombre d'entre
eux, le mécanisme n'est pas élucidé. Les deux médicaments les plus souvent en
cause sont la cimétidine et la spironolactone (Aldactone®).
Une gynécomastie iatrogène peut être la conséquence de :
un effet estrogénique : la responsabilité des estrogènes est évidente
lorsqu'ils sont pris à visée thérapeutique (Distilbène® pour cancer de la
prostate) ou chez les transsexuels. Elle devient plus difficile à authentifier
en cas d'exposition industrielle ou sous forme locale (crème vaginale chez
la partenaire) [39]. Les digitaliques et le delta-9-tétrahydrocannabinol,
principal constituant du haschich et de la marijuana, ont un effet
estrogène-like ;
DJEUGOUE NGALEU paulette Thèse de médecine
35
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
une augmentation de la synthèse d'estrogènes : l'administration
pulsatile de luteinizing hormone-releasing hormone (LH-RH), d'hCG, de
clomifène ou de testostérone peut être responsable d'une gynécomastie en
raison principalement d'une aromatisation périphérique des androgènes en
estrogènes ;
une inhibition de la synthèse de la testostérone : des traitements
prolongés (supérieurs à 2-3 semaines) par les imidazolés (métronidazole,
kétoconazole, miconazole) peuvent occasionner une gynécomastie.
Certaines chimiothérapies (vincristine, bisulfan, BCLU...) prescrites en
particulier pour les hémopathies et les cancers testiculaires sont également
susceptibles d'entraîner une gynécomastie en règle transitoire par
altération de l'épithélium germinal et réduction des cellules de Sertoli ;
une inhibition de l'action des androgènes : les antiandrogènes
(cyprotérone, flutamide) entraînent une gynécomastie quasi constante
régressive à l'arrêt du traitement.
Tableau II : Médicaments et substances* associées aux gynécomasties.
*Liste non exhaustive [35].
Anti-androgènes/Inhibiteurs de la synthèse des androgènes : Toxiques :
• Acétate de Cyproterone • Alcool
• Flutamide, bucatulamide • Amphétamines
• Finestaride • Héroïne, méthadone
• Spironolactone • Marijuana
• Ketoconazole Hormones :
• Traitement anti-VIH (efavirenz, antiprotéases) • Androgènes, Oestrogènes
Antibiotiques • Stéroïdes anabolisants
• Éthionamide • hCG
• Isoniazide • Hormone de croissance
• Métonidazole. Psychotropes :
Antiulcéreux • Diazepam
• Cimétidine, Ranitidine • Haloperidol
• Oméprazole • Phénothiazines
Agents chimiothérapeutiques • Antidépresseurs tricycliques
• Agents Alkylants Divers :
• Méthotrexate • IEC(enalapril, captopril)
• Vincristine, cisplatine, imatinib. • Anticalciques (nifedipine)
• Amiodarone,digoxine
• Méthoclopramide
• Phénitoïne
• Théophylline
Le risque relatif de gynécomastie sous cimétidine est élevé, en particulier en
cas de prescription à dose élevée (supérieure à 1 000 mg/j) et/ou de façon
prolongée (supérieure à 6 mois). Le mécanisme est un effet compétitif de celui
de la dihydrotestostérone au niveau des sites récepteurs des androgènes avec
DJEUGOUE NGALEU paulette Thèse de médecine
36
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
également inhibition du métabolisme de l'estradiol. Le risque paraît mineur avec
les autres antiulcéreux (ranitidine, oméprazole).
Trente(30) à soixante(60) % des malades traités à long terme par un
antialdostérone, la spironolactone, développe une gynécomastie. Le mécanisme
est également une inhibition compétitive de la dihydrotestostérone avec par
ailleurs, une modification de la stéroïdogenèse testiculaire entraînant une
diminution du rapport T/E 2 . Le risque est bien moindre lors de l'utilisation du
canrénoate de potassium. L'effet endocrinien de la spironolactone serait dû à un
métabolite autre que la canréone, le 7-alpha-thiométhylspironolactone[3].
Les médicaments pouvant entraîner une gynécomastie sont nombreux, mais
pour l'essentiel avec une fréquence rare et un mécanisme non élucidé :
- psychotropes : diazépam, antidépresseurs tricycliques, phénytoïne,
phénothiazine, amphétamines ;
- antituberculeux : isoniazide, éthionamide ;
- médicaments à visée cardiovasculaire : méthyldopa, réserpine, vérapamil,
nifédipine, énalapril, captopril, aténolol, amiodarone.
Les médicaments pouvant entraîner une gynécomastie sont résumés dans le
tableau II.
3.4.2.2 Etiologies responsables d’un déficit en testostérone
3.4.2.2.1 Insuffisances gonadiques congénitales
Syndrome de Klinefelter
Une gynécomastie en règle bilatérale, de volume modéré, non sécrétante est
observée dans la moitié des cas. Cliniquement, la macroskélie et la palpation de
testicules de petite taille, fermes et indolores, évoquent le diagnostic. Le profil
hormonal est caractérisé par une élévation des gonadostimulines alors que la
testostérone est le plus souvent diminuée, l'estradiol normal, rarement augmenté.
Le caryotype XXY, voire exceptionnellement une mosaïque, confirme le
diagnostic.
Anorchidie congénitale
Il s'agit de garçons XY de phénotype normal n'ayant pas de testicules à la
palpation du scrotum. Une gynécomastie est présente dans la moitié des cas en
DJEUGOUE NGALEU paulette Thèse de médecine
37
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
rapport avec un effondrement du taux de testostérone et une diminution moindre
de l'estradiol.
Syndrome de résistance aux androgènes
C'est une maladie génétique liée au chromosome X, caractérisée par une
anomalie du récepteur aux androgènes. Le syndrome de Reifenstein constitue la
forme incomplète révélée chez l'adulte associant un phénotype masculin, un
hypospadias, une gynécomastie, une infertilité. Cependant, la gynécomastie peut
être isolée. La testostérone et l'estradiol sont élevés, conséquence des taux élevés
de gonadostimulines en raison de la résistance au niveau
hypothalamohypophysaire, au rétrocontrôle négatif normalement exercé par la
testostérone.
Bloc de la biosynthèse de testostérone
Il s'agit de déficit exceptionnel transmis sur un mode autosomique récessif.
Parmi les cinq déficits enzymatiques décrits, les blocs en 3-bêta-hydroxystéroïde
et en 17-bêta-hydroxystéroïde déshydrogénase s'accompagnent fréquemment
d'une gynécomastie. Le diagnostic repose sur l'élévation des taux des
précurseurs situés en amont du bloc enzymatique.
3.4.2.2.2 Insuffisance gonadique acquise
Le tableau associe en règle des testicules atrophiques, une testostérone
diminuée, un estradiol normal et des gonadostimulines augmentées.
Les orchites virales (oreillons surtout, Echovirus, Arbovirus du groupe
B...) constituent la cause la plus fréquente d'atrophie testiculaire à la
puberté.
L'atrophie testiculaire peut être également la conséquence d'un
traumatisme, d'une radiothérapie ou d'une chimiothérapie, de
certaines maladies neurologiques (atrophie myotonique...).
Une gynécomastie est fréquente chez l'insuffisant rénal chronique,
retrouvée chez 50 à 60 % des hémodialysés. Les taux de gonadostimulines
et de prolactine sont en règle élevés, l'œstradiol normal et la testostérone
diminuée. En comparant des hémodialysés avec et sans gynécomastie, il
semble que le développement mammaire soit lié non à
l'hyperprolactinémie comparable dans les deux groupes, mais à la baisse
de la testostérone libre (sans modification de la TeBG) [40].
DJEUGOUE NGALEU paulette Thèse de médecine
38
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Les adénomes à prolactine chez l'homme sont rarement révélés par une
gynécomastie avec parfois galactorrhée mais plutôt par un syndrome
tumoral hypophysaire. La gynécomastie est la conséquence non pas de
l'action directe de la prolactine sur le tissu mammaire, mais de
l'insuffisance gonadique secondaire, induite par l'hyperprolactinémie ou la
tumeur elle-même.
3.4.2.3 Etiologies responsables d’un excès de production d’œstradiol
3.4.2.3.1 Augmentation de la production des œstrogènes
Tumeurs à cellules de Leydig
Ce sont des tumeurs rares représentant 1,3 % des causes de gynécomastie
chez l'adulte jeune dans certaines séries. Le pic de fréquence est entre 25 et 30
ans. Elles ne constituent que 2 à 3 % de l'ensemble des tumeurs testiculaires et
sont malignes dans 10 % des cas. Une cryptorchidie est retrouvée dans 9 % des
cas.
La gynécomastie, présente dans 20 à 30 % des cas, est souvent révélatrice de
la tumeur, les autres signes cliniques observés étant l'infertilité, l'impuissance, la
diminution de la libido, la pilosité réduite.
L'exploration hormonale montre, lorsqu'elle est typique, une augmentation de
l'estradiol, une diminution de la testostérone, du rapport T/E 2 , des
gonadostimulines de base et après stimulation par la LH-RH, enfin une réponse
excessive de l'estradiol après test à l'hCG (5 000 UI intramusculaires pendant 3
jours). En réalité, le bilan hormonal est souvent non concluant : estradiol normal
ou très discrètement augmenté, testostérone fréquemment normale, FSH et LH
normales. De plus, les leydigomes sont en règle des tumeurs de petit volume,
indolores, respectant le plus souvent la forme de la glande.
Elles échappent donc fréquemment à un examen clinique, même attentif, d'où la
nécessité d'une échographie testiculaire systématique permettant un diagnostic
précoce [41]. L'aspect habituel en échographie est une tumeur petite,
hypoéchogène, homogène, bien limitée sans calcification avec parfois un aspect
hypoéchogène du testicule controlatéral, lié à une atrophie tubulaire et une
fibrose.
Le développement d'une gynécomastie au cours des leydigomes est lié à une
augmentation de l'activité de l'aromatase qui transforme les androgènes en
estrogènes avec freination des gonadotrophines et de l'activité du parenchyme
DJEUGOUE NGALEU paulette Thèse de médecine
39
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
sain. De plus, la réduction de la testostérone et l'élévation de l'estradiol ont un
effet délétère sur la spermatogenèse. Ce qui entraîne fréquemment une oligo- ou
une asthénospermie.
Le traitement du leydigome est chirurgical : orchidectomie, voire en cas de
certitude histologique, énucléation de la tumeur. Si la tumeur est maligne, la
chirurgie peut être complétée par un curage ganglionnaire, une radiothérapie, un
traitement par OP'DDD ou agonistes de la LH-RH.
Après orchidectomie, les anomalies hormonales se corrigent dans un délai de
4 mois alors que la spermatogenèse reste encore le plus souvent altérée. Le
volume testiculaire controlatéral se normalise dans un délai de 1 mois. Enfin, la
régression de la gynécomastie après intervention est inconstante [42].
Les autres tumeurs du stroma, les tumeurs à cellules de Sertoli sont beaucoup
plus rares, malignes dans 60 % des cas.
Cancers testiculaires
La gynécomastie est révélatrice d'une tumeur germinale dans 5 à 10 % des
cas mais avec des fréquences variables selon le type histologique : 10 à 20 %
dans les choriocarcinomes, 4 % dans les tumeurs embryonnaires, 1 % dans les
séminomes.
La gynécomastie est liée plutôt à la stimulation par l'hCG ou sa sous-fraction
bêta de la production testiculaire d'œstradiol qu'à la sécrétion d'œstradiol par la
tumeur elle-même. Parmi les facteurs pronostiques, l'existence d'une
gynécomastie plus que le taux initial d'hCG est associée à une évolution
péjorative en terme de durée de survie. En revanche, l'apparition transitoire
d'une gynécomastie observée dans 15 % des cas après chimiothérapie n'a pas de
valeur pronostique défavorable [43].
Syndrome paranéoplasique avec sécrétion d'hCG
La production d'hCG au cours de certains cancers comme le carcinome
bronchique, augmente la sécrétion d'œstradiol au niveau des testicules,
responsable du développement d'une gynécomastie.
Hermaphrodisme vrai
Il est caractérisé à la puberté par un tableau mixte de féminisation et de
virilisation dû à l'activité des composants ovariens et testiculaires des gonades.
DJEUGOUE NGALEU paulette Thèse de médecine
40
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.4.2.3.2 Augmentation ds substrats de l’aromatase périphérique
Corticosurrénalome malin féminisant
Il est caractérisé par une production massive des précurseurs androgéniques
(dihydroépiandrostérone, delta-4-androstènedione) aromatisés au niveau des
tissus périphériques en estrogènes. Dans de rares cas, la tumeur elle-même peut
sécréter des estrogènes. Dans plus de 60 % des cas, l'examen clinique retrouve
une masse palpable.
Hyperplasie surrénale congénitale par déficit en 21-hydroxylase
Elle peut s'accompagner d'une gynécomastie liée à une augmentation de la
delta-4-androstènedione.
Cirrhose hépatique
C'est une cause classique de féminisation. L'élévation des taux d'estrogènes
n'est pas liée à une hyperproduction mais à une diminution de l'extraction
hépatique de la delta-4-androstènedione avec secondairement, une augmentation
de l'aromatisation périphérique de ce précurseur androgénique.
Période de renutrition
Elle peut entraîner (après jeûne prolongé, rééquilibration d'un diabète par
insulinothérapie, insuffisance rénale corrigée par hémodialyse) l'apparition d'une
gynécomastie. Le mécanisme reste obscur mais paraît comparable à celui des
hépatopathies, à savoir une diminution de la clairance hépatique des androgènes.
Hyperthyroïdie
Chez l'homme elle s'accompagne dans un tiers des cas d'une gynécomastie. Le
taux d'estradiol est alors élevé en rapport avec une augmentation de la
production de la delta-4-androstènedione et une activité aromatase périphérique
accrue par les hormones thyroïdiennes.
3.4.2.3.3 Augmentation de l’activité de l’aromatase périphérique
Cette anomalie exceptionnelle, parfois familiale, semble liée à une mutation
génétique responsable de la survenue précoce d'une gynécomastie avant la
puberté.
DJEUGOUE NGALEU paulette Thèse de médecine
41
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.4.2.4 Gynécomasties idiopathiques
Les causes précédentes ayant été éliminées, la gynécomastie est considérée
comme idiopathique dans près de la moitié des cas. Elle peut être la
conséquence d'anomalies mineures de la balance androgénoestrogénique non
objectivées par les examens hormonaux usuels. Elle peut être également la
conséquence d'une hypersensibilité du tissu mammaire à des taux
physiologiques d'estrogènes.
La gynécomastie survient parfois au décours d'une prise pondérale chez les
hommes ayant une répartition du tissu adipeux plutôt de type gynoïde, d'où un
excès probable d'aromatisation estrogénique.
Par ailleurs, il a été rapporté des gynécomasties transitoires liées au stress
chez des étudiants en période d'examens au cours desquelles les taux de
testostérone et le rapport T/E 2 diminuaient tout en restant dans les limites de la
normale. Il est ainsi probable que la plupart des gynécomasties idiopathiques
soient la conséquence d'une exposition environnementale minime et
prolongée à des substances estrogéniques ou antiandrogéniques non
identifiées.
3.4.3 Diagnostic différentiel
La gynécomastie doit être différenciée lorsqu'elle est :
bilatérale d'une adipomastie dont la consistance est molle sans structure
glandulaire, non centrée sur l'aréole, suivant le bord inférieur du grand
pectoral. Elle est parfois associée à une gynécomastie
(adipogynécomastie) rendant le diagnostic difficile chez l'obèse ;
unilatérale d'un carcinome mammaire, source d'une tuméfaction dure,
irrégulière, plus ou moins adhérente et excentrée avec possibilité
d'écoulement sanglant et d'adénopathies de voisinage. Le cancer du sein
est une tumeur rare (0,2 % des cancers de l'homme) ; son pronostic est
nettement plus défavorable que chez la femme. Le risque accru de
cancérisation de la gynécomastie est une notion actuellement
controversée. Une tuméfaction mammaire, excentrée, indolore, peut
également correspondre à un lipome, un neurofibrome, voire un
lymphome
DJEUGOUE NGALEU paulette Thèse de médecine
42
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Figure 7 : Diagnostic différentiel des gynécomasties. A gauche gynécomasties
sous forme de masse arrondie centrée sous l’aréole. A droite autre masse se présentant sous
forme d’une masse excentrée de l’aréole [44].
Figure 8 : Arbre décisionnel de la gynécomastie [53].
DJEUGOUE NGALEU paulette Thèse de médecine
43
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
3.5. TRAITEMENT
Le traitement de la gynécomastie est curatif certes, mais, il est aussi préventif
3.5.1 But
Le traitement vise à :
faire régresser la gynécomastie
corriger le déficit androgénique
prévenir la survenue des gynécomasties
Il doit donc de ce fait, être le plus étiologique possible.
3.5.2 Moyens
3.5.2.1 Traitement médicamenteux [3, 34, 35, 44]
Androgènes
Les androgènes aromatisables en estrogènes ne doivent pas être utilisés car
ils exposent à une aggravation de la gynécomastie !
Dihydrotestostérone (DHT) par voie percutanée (Andractim®)
La DHT, forme active des androgènes, non aromatisable en estrogènes est
globalement efficace dans 60 % des cas. L'administration locale de DHT
s'accompagne d'une élévation rapide de ses taux plasmatiques à l'origine d'une
freination de l'axe hypothalamohypophysaire, en particulier de la gonadotrophin
releasing hormone (GnRH) avec une diminution des taux d'œstradiol et de
testostérone. Si la testostérone totale est diminuée, la fraction libre n'est pas
modifiée car les concentrations de DHT sont insuffisantes pour déplacer la
testostérone de ses sites de liaison sur la TeBG [45]. La DHT pourrait avoir
également un effet local sur le tissu mammaire. L'efficacité clinique dépend des
taux plasmatiques de DHT qui sont en fait très variables pour une même dose
appliquée en percutanée, fonction de la perméabilité cutanée et/ou du
métabolisme de la DHT.
DJEUGOUE NGALEU paulette Thèse de médecine
44
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
L'application d'une dose de DHT(125 mg) ou mieux de deux (250 mg) en gel
entraîne une régression quasi constante et rapide en 1 à 2 semaines des
phénomènes douloureux. La diminution de volume s'observe après 1 à 2 mois de
traitement pour une durée totale d'application de 3 à 6 mois. Si l'efficacité est
constante dans les hypogonadismes non dysgénétiques, une disparition complète
est observée dans 25 % des cas et une régression partielle dans 30 à 40 % des
cas de gynécomastie idiopathique. La DHT est en règle inefficace dans les
gynécomasties anciennes correspondant à un tissu mammaire remanié et fibreux.
Danazol (Danatrol®)
Le danazol est un androgène faible qui freine l'axe gonadotrope. Des doses de
200 mg/j paraissent suffisantes chez l'adolescent en raison de la sensibilité de
l'axe gonadotrope à cet âge et doivent être augmentées à 400-600 mg chez
l'adulte. Une prise de poids, voire des œdèmes liés à une rétention hydrique
peuvent être observés sous traitement.
Testolactone
La testolactone est un dérivé synthétique de la testostérone inhibant
l'aromatisation des androgènes qui a été proposé dans les gynécomasties
pubertaires avec une efficacité notable sans effet secondaire.
Antiestrogènes
- Le citrate de clomifène (Clomid®)
à la dose de 50 à 100 mg/j entraîne une augmentation de la FSH, LH,
testostérone et œstradiol avec, de façon inconstante, une élévation du rapport
T/E 2 . En fait, il agirait plus par effet antiestrogénique local que par modification
de la balance androgénoestrogénique. Des effets indésirables sont possibles
(troubles digestifs et visuels). L'efficacité aléatoire de ce traitement est liée à son
mode d'action au niveau hypothalamohypophysaire, à la fois agoniste et
antagoniste sur les récepteurs des estrogènes pouvant même être à l'origine d'une
gynécomastie !
- Le tamoxifène (Nolvadex®) à la dose de 20 mg/j a un mécanisme d'action
comparable mais semble-t-il sans effet estrogénique agoniste ni d'effet
secondaire notable.
DJEUGOUE NGALEU paulette Thèse de médecine
45
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
- La bromocriptine (Parlodel®) a été proposée en dehors de toute
hyperprolactinémie. Son mécanisme d'action peu clair et ses effets secondaires
fréquents ont fait abandonner ce médicament dans cette indication.
Radiothérapie mammaire
- Enfin, la radiothérapie mammaire avant l'instauration d'un traitement
estrogénique pour cancer de la prostate évite dans 90 % des cas l'apparition
d'une gynécomastie.
3.5.2.2 Traitement chirurgical [1, 46, 47, 48]
Les objectifs de prise en charge chirurgicale d’une gynécomastie sont :
de rétablir le contour du sein masculin normal et
de corriger la déformation du sein, le mamelon, ou de l'aréole. L’impératif
esthétique est au premier plan, et tous les gestes visant à restaurer une
anatomie normale vont être guidés par un souci cicatriciel constant.
Les options chirurgicales pour le patient présentant une gynécomastie sont la
mastectomie, une liposuccion, ou une combinaison des deux approches. La
plupart des patients tire le meilleur parti d'une approche combinée.
Beaucoup d’auteurs ont par le passé tenté d’associer diminution de volume,
correction de la taille et de l’implantation de l’aréole et traitement de l’excès
cutané par des manœuvres plastiques qui, bien que donnant un résultat correct,
présentaient l’inconvénient de barrer la région mammaire de cicatrices visibles
La chirurgie de la gynécomastie doit traiter le contenu (excédent graisseux et
glandulaire), l’aréole, mais aussi éventuellement le contenant (la peau). D’où
l’importance de la classification de Simon.
Mastectomie
Le choix de la technique chirurgicale dépend du résultat souhaité en fin de
chirurgie.
L’approche la plus commune est l’incision intra-aréolaire, ou incision de
Webster. L'incision de Webster suit le contour de l'aréole et se fait dans la partie
pigmentée. La longueur de l’incision varie en fonction de l’anatomie spécifique
du patient. Cette incision est placée à la partie inférieure de l’hémisphère.
DJEUGOUE NGALEU paulette Thèse de médecine
46
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Figure 9: Incision de Webster [47]
L’incision intra aréolaire de Webster peut être élargie par des extensions
latérales et médianes. Voir figure ci dessous
Figure 10 : Incision intra aréolaire de Webster élargie [47]
L’incision transversale de l’aréole du mamelon peut être aussi utilisée. Mais
offre un moins large champ d’action
Figure 11 : Incision transversale de l’aréole [47]
DJEUGOUE NGALEU paulette Thèse de médecine
47
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Il existe aussi l’incision en triple V qui est de moins en moins utilisée
aujourd’hui.
Figure 12 : Incision triple V [47]
L'incision transaxillaire a été recommandée en raison de son avantage de
cicatrices sur la paroi thoracique, mais avec cette technique la résection
glandulaire est plus difficile et incomplète. De plus l’obtention d'une hémostase
adéquate est également très difficile par cette approche.
Dans les gynécomasties graves, la résection cutanée combinée aux
techniques de transposition du mamelon peut parfois être nécessaire. Le type le
plus commun est la technique de Letterman. Après la résection cutanée, la
plaque aréolo-mamelonnaire est tournée en haut et en dedans sur un même
pédicule dermique.
Figure 13 : Technique de Letterman [47]
En cas de gynécomastie massive, un greffage de l’aréole du mamelon peut
être effectué après incision elliptique et résection en bloc de l’excès cutané et du
tissu mammaire.
DJEUGOUE NGALEU paulette Thèse de médecine
48
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Figure 14: Greffage de l’aréole du mamelon qui peut être effectué après incision
elliptique et résection en bloc de l’excès cutané et du tissu mammaire. [47]
La liposuccion
Pour la réalisation d’une liposuccion, la canule est introduite par deux micro-
incisions (3mm) périphériques, situées dans le sillon sous-mammaire et dans la
région axillaire. La liposuccion classique en plan croisés permet ainsi l’ablation
du tissu graisseux en excès.
Avec la liposuccion, il y’a moins de saignement. De plus elle diminue la
survenue de complications telles que les distorsions de mamelon, les
déformations de l’aréole.
Il existe plusieurs types de liposuccion :
Liposuccion classique : qui aspire seulement le tissu graisseux et non
pas la glande mammaire en elle-même.
Liposuccion échoguidée qui a été récemment proposée et qui a amélioré
la prise en charge des gynécomasties.
En post-opératoire, la rétraction cutanée, favorisée par la lipo-aspiration, est
contrôlée par la mise en place d’un vêtement compressif (figure 13) qui doit être
porté deux mois. La rançon cicatricielle est très discrète.
Figure 15 : Vêtement compressif [47] .
DJEUGOUE NGALEU paulette Thèse de médecine
49
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Les complications chirurgicales
Elles sont de deux ordres :
– Les complications immédiates sont surtout représentées par les hématomes,
favorisés par l’importance du décollement et l’existence d’une cavité post-
opératoire. Les séromes sont moins fréquents. Les sepsis et les nécroses
aréolaires sont très rares et dus à une faute technique.
– Les complications tardives sont essentiellement esthétiques. Il peut s’agir
d’un excès de résection avec dépression de la région mammaire ou aréolaire. Le
traitement est difficile et répond aux réinjections de graisse.
Il peut aussi s’agir d’une insuffisance de résection ou d’une asymétrie
nécessitant un complément chirurgical.
Indications
Un facteur important dans l’approche thérapeutique de la gynécomastie est sa
durée d’évolution.
En effet, au cours des six premiers mois après son apparition, le tissu
glandulaire est histologiquement marqué par des phénomènes d’hyperplasie et
d’inflammation. C’est durant cette période qu’une intervention thérapeutique
peut s’avérer bénéfique.
A la phase proliférative (<12 MOIS), une régression avec diminution de la
douleur peut être obtenue. Dans ce cas on peut utiliser un traitement de SERM
(Selective estrogene receptor modulators) tel que le tamoxifène, ou le raloxifène.
Ces traitements se sont montrés en effet utiles dans le cas de gynécomasties de
la puberté persistantes ou de l’adulte, en particulier dans les formes
douloureuses, avec régression au moins partielle de la gynécomastie dans 80-
90% des cas.
A noter que le tamoxifène s’est également montré utile dans la prévention du
développement d’une gynécomastie chez les sujets traités par bicalutamide pour
des cancers de la prostate.
Chez les hommes présentant un hypogonadisme, la substitution de
testostérone peut être bénéfique pour réduire la gynécomastie tant que celle-ci
n’a pas atteint un stade fibrotique. Il n’y a par contre pas de place pour un
traitement de testostérone en cas de fonction gonadique normale, la
gynécomastie pouvant même s’aggraver par l’aromatisation de la testostérone en
œstradiol.
DJEUGOUE NGALEU paulette Thèse de médecine
50
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Au-delà de 12 mois d’évolution, la réaction inflammatoire disparaît et le tissu
glandulaire est le siège d’une réaction fibrotique, généralement irréversible et
résistante au traitement. Dans ce cas une mastectomie chirurgicale peut être
proposée.
Le traitement chirurgical ne doit être envisagé qu’après échec du traitement
médical. Ce traitement s’adresse particulièrement aux formes gênantes par leur
volume ou leur sensibilité, ainsi qu’aux gynécomasties psychologiquement mal
tolérées. Chez l’adolescent il faudra attendre environ deux ans avant d’envisager
la chirurgie.
Il est maintenant admis que les gynécomasties de faible grade sont mieux
traitées par liposuccion seule. La limite de cette méthode était la fibrose qui n’en
est plus une avec l’avènement de la liposuccion échoguidée. Celle-ci permet une
meilleure approche pour les gynécomasties moyennement fibrosées.
La liposuccion classique est une méthode qui ne peut être envisagée seule
que dans le cas où le contenu des seins est constitué par la graisse (fausse
gynécomastie ou adipomastie).
Dans les cas de véritables gynécomasties, la glande mammaire qui est dure
ne peut pas être aspirée. Elle ne peut être retirée que chirurgicalement. Tout
dépend alors de la taille du sein et de l’élasticité de la peau.
- Lorsque la peau est élastique et que le sein n’est pas trop gras, ce qui est
la majorité des cas, toute l’intervention peut être réalisée par incision
courte et discrète (webster).
- En revanche lorsqu’il existe un excès important de la peau et qu’elle n’est
pas élastique, les incisions sont horizontales plus ou moins longues situées
au niveau des aréoles
-
Dans le cas où le volume des seins est très important, les incisions
horizontales sont bas situées, et les aréoles sont amputées et greffées.
Pour les gynécomasties de haut grade, l’association de liposuccion et de
chirurgie (pour résection de l’excès cutané quelques mois plus tard) donne de
meilleurs résultats.
DJEUGOUE NGALEU paulette Thèse de médecine
51
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
4. MÉTHODOLOGIE
4.1. CADRE D’ÉTUDE :
Notre étude s’est déroulée dans le service de médecine interne du CHU du Point
G et au cabinet médical « DIDI NI TATA » de Torokorobougou en commune V.
4.2. PÉRIODE ET TYPE D’ÉTUDE :
Il s’agissait d’une étude descriptive en rétrospective et prospective qui s’est
étendue de janvier 2005 à Novembre 2010.
4.3. POPULATION D’ÉTUDE :
Patients de sexe masculin présentant une gynécomastie, vus en consultation
externe dans le service de médecine interne, et au cabinet médical « DIDI NI
TATA » de Torokorobougou.
La prévalence de la gynécomastie n’est pas trop connue et dépend des classes
d’âge. Notre échantillon était exhaustif.
4.4. CRITÈRES D’INCLUSION
Etaient inclus dans cette étude tous les patients ayant accepté d’y participer,
quelque soit leur âge, leur ethnie ou leur provenance géographique
présentant une gynécomastie et ayant pu réaliser un bilan étiologique.
4.5. CRITÈRES DE NON INCLUSION
N’étaient pas inclus dans notre étude, les patients :
N’ayant pas pu réaliser le dosage plasmatique des hormones nécessaire à
notre étude.
N’ayant pas une gynécomastie cliniquement évidente.
N’ayant pas accepté d’y participer pour l’étude prospective.
DJEUGOUE NGALEU paulette Thèse de médecine
52
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
4.6. MÉTHODES DE RECUEIL DES DONNÉES
Nous avons examiné tous les dossiers des malades vus en consultation
externe dans les différents services concernés par notre enquête.
Les données de l’interrogatoire, de l’examen physique, des examens
complémentaires ainsi que le diagnostic étiologique et le traitement entrepris ont
été mentionnés sur une fiche d’enquête standardisée.
L’interrogatoire a permis de préciser :
- l’identité du patient (nom, prénom, âge, profession, ethnie, adresse),
-la date, le lieu et le motif de consultation,
- les signes fonctionnels du syndrome d’hypométabolisme, du syndrome
cutanéo-muqueux et du syndrome neuromusculaire de l’hypothyroïdie,
-les antécédents médicaux personnels et familiaux ;
De prise de médicaments (Anti-androgènes/inhibiteurs de la synthèse des
androgènes, certains antibiotiques, certains anti-ulcéreux, agents
chimiothérapeutiques, toxiques, hormones, pshychotropes, et des médicaments
divers tels que les Inhibiteurs de l’Enzyme de Conversion.)
L’examen physique a comporté :
-un examen général : l’état général, le poids, la taille, l’IMC, la température, la
fréquence cardiaque, la fréquence respiratoire, la pression artérielle
-un examen des seins à la recherche de gynécomastie en précisant ses
caractéristiques (unilatérale ou bilatérale, l’état de la peau en regard, présence ou
non d’un écoulement mamelonaire, la sensibilité)
-un examen des testicules à la recherche d’une atrophie (hypogonadisme) ou
d’une masse testiculaire (tumeur)
-un examen à la recherche des signes cliniques de maladies telles qu’une
hépatopathie ou une hyperthyroïdie et examen de tous les autres appareils a été
fait
Les examens paracliniques étaient:
DJEUGOUE NGALEU paulette Thèse de médecine
53
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
-Un bilan biologique composé de :
La mesure de la β-HCG, la testostérone, l’estradiol, la LH. Ceci peut être
éventuellement complété par un bilan hépatique, rénal, et thyroïdien.
-Un bilan d’imagerie comportant :
-Une mammographie,
-Une échographie testiculaire. Eventuellement complété par un scanner cérébral.
Les malades n’ont pas tous pu réaliser ces examens pour des raisons financières.
4.7. PROBLÈMES D’ÉTHIQUE
La réalisation de notre enquête a nécessité le consentement des professeurs
pratiquants dans le service. Nous leur avions adressé des lettres pour expliquer
l’intérêt de notre étude.
Nous avons également eu recours à la disponibilité des malades concernés par
l’enquête prospective. Nous leur avons expliqué le but scientifique et non pas
lucratif de notre étude. Nous avons pu obtenir un consentement verbal de tous
nos patients.
4.8. PLAN D’ANALYSE DES DONNEES
Les données ont été analysées sous le logiciel SPSS version 16 et la saisie
des données, ainsi que les différents programmes de contrôle ont été réalisés
sous le logiciel Word office 12.
DJEUGOUE NGALEU paulette Thèse de médecine
54
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
5. RESULTATS
Sur un total de 7924 dossiers nous avons retrouvé 74 cas de gynécomastie soit
une fréquence hospitalière de 0,93%. Parmi les 74 patients seuls 17ont rempli
nos critères d’inclusion.
5.1. ASPECTS ÉPIDÉMIOLOGIQUES
Un total de 17 patients présentant une gynécomastie a été inclus dans cette
étude. Tous de sexe masculin. L'âge moyen était de 25,9 ans pour l'ensemble des
patients avec des extrêmes à 12 et 57 ans.
47.1%
50%
45%
40%
35%
30%
Pourcentage
23.50%
25%
17.60%
20%
15%
6% 5.90%
10%
5%
0%
0-12 ans 13-18 ans 19-30 31-45 ans >45 ans
Age
Figure 16: Répartition des patients selon l’âge.
La tranche d’âge 13-18 ans était la plus représentée avec 47,3% des patients. La
moyenne d’âge était de 25,9 ans ± 14,97 ans.
DJEUGOUE NGALEU paulette Thèse de médecine
55
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
TABLEAU III : Répartition des patients en fonction de l’ethnie
Ethnie Fréquence Pourcentage
Bambara 3 17,6%
Sonrhaï 1 5,9%
Senoufo 1 5,9%
Dogon 3 17,6%
Peulh 2 11,8%
Sarakole 4 23,5%
Bobo 3 17,6%
TOTAL 17 100%
Les sarakolés ont constitué l’ethnie dominante avec 23,5% des cas
5.2. ASPECTS CLINIQUES
TABLEAU II Répartition des malades selon le motif de consultation
Fréquence Pourcentage
Augmentation isolée du 12 70,6%
volume mammaire
Retard de croissance 1 5,9%
Obésité 2 11,8%
Micropénis 1 5,9%
Gynécomastie+Galactorrhée 1 5,9%
TOTAL 17 100%
L’augmentation isolée du volume mammaire a été le motif de consultation
dans plus de 70% des cas
DJEUGOUE NGALEU paulette Thèse de médecine
56
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Tableau IV : Répartition selon la durée d’évolution
Effectif Fréquence
< 6mois 2 11,8%
6-11 mois 3 17,6%
1-3 ans 9 52,9%
>3ans 3 17,6%
Total 17 100%
Le mode était la classe 1- 3 ans. Avec des extrêmes à 3mois et 7 ans
d’évolution.
>30
26-29
18,5-25
<18,5
0% 10% 20% 30% 40% 50%
Figure 17: Répartition des patients en fonction de l’indice de masse
corporelle.
Dans la population qui a fait l’objet de notre enquête, 52,9% des patients étaient
en surpoids ou en obésité.
DJEUGOUE NGALEU paulette Thèse de médecine
57
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
70%
60% n=7
n=3
40%
n=2 30%
n=3
Figure 18 : Répartition des patients en fonction des antécédents de
gynécomastie
Les antécédents familiaux de gynécomastie ont été retrouvés dans 40% des cas
(n=5) et les antécédents personnels dans 30% des cas (n=10).
Tableau V : Répartition des patients en fonction de la topographie de la
gynécomastie
Effectif fréquence
Unilatérale gauche 1 5,9%
Unilatérale droite 1 5,9%
Bilatérale 15 88,2%
Total 17 100%
La localisation bilatérale était la plus représentée avec plus de 88,2% des cas.
DJEUGOUE NGALEU paulette Thèse de médecine
58
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Tableau VII Répartition des patients en fonction de la présence ou non de
galactorrhée.
Effectif Fréquence
Oui 4 23,5%
Non 13 76,5%
Total 17 100%
La notion de galactorrhée est retrouvée dans 23,5% des cas.
ABSENTE PRESENTE
88.20%
11.80%
ABSENTE PRESENTE
Figure 19 : Répartition des patients en fonction de la présence ou non de
douleur.
La notion de douleur n’est retrouvée que chez deux patients soit environ 12%
des cas.
DJEUGOUE NGALEU paulette Thèse de médecine
59
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Tableau IX : Répartition des patients en fonction de la douleur et de la
durée d’évolution
Durée d’évolution TOTAL
Douleur <6 mois 6-11mois 1-3ans >3ans
Présente 1 1 0 0 2
Absente 1 2 9 3 15
TOTAL 2 3 9 3 17
La douleur était présente uniquement chez les patients ayant une gynécomastie
dont la durée d’évolution n’excédait pas un an.
NORMALE ANORMALE
11.80%
ANORMALE
82.40%
NORMALE
Figure 20 : Répartition des patients en fonction de la pilosité.
La pilosité était normale dans plus de 80% des cas
DJEUGOUE NGALEU paulette Thèse de médecine
60
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
5.3. DONNEES PARACLINIQUES
Testostérone
Elevée 19%
Normale 44%
Basse 38%
Oestradiol
Normale 91%
Basse 9%
Figure 21: Répartition des patients en fonction des taux de testostérone et
d’œstradiol
Les taux plasmatiques de testostérone et d’œstradiol étaient normaux dans
respectivement 44% des cas (n=16) et 91% des cas (n=11).
DJEUGOUE NGALEU paulette Thèse de médecine
61
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
100%
n=13
87%
n=13
0% 0% 7%
7%
n=1
n=1
Figure 22: Répartition des patients en fonction des dosages de
prolactinémie et de la β-HCG
Les taux de Prolactine et de β-HCG étaient normaux dans respectivement 76,5%
(n=15) et 100% (n=13) des cas chacun.
Tableau X: Répartition en fonction de taux de prolactine et de la présence
galactorrhée
Prolactinémie
Basse Normale Elevée
Galactorrhée
Présente 0 4 0
Absente 1 9 1
TOTAL 1 13 1
Dans les deux cas d’hyperprolactinémie, il n’y avait pas de galactorrhée .Les 4
cas de galactorrhée de notre étude étaient avec taux de prolactine normale.
DJEUGOUE NGALEU paulette Thèse de médecine
62
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Tableau XI : Répartition des patients en fonction du taux de LH
LH Effectif %
Basse 4 36,36
Normale 7 63,64
Elevée 0 0
TOTAL 11 100
La LH est normale dans 7 cas soit un pourcentage de 63,64% des cas (n=11).
Tableau XII: Répartition des patients en fonction du résultat de la
mammographie
Fréquence %
Aspect gynoïde 10 76,92
Fibro-glandulaire 2 15,38
Glande+Graisse 1 7,70
TOTAL 13 100
L’aspect gynoïde de la gynécomastie était le plus représenté dans 76,9% des cas
(n=13).
Répartition des patients en fonction du résultat de l’échographie
testiculaire :
Elle n’a été réalisée que chez 5 patients et était normale dans 4 cas soit 80% des
cas. Et nous avons retrouvé un cas de cryptorchidie.
DJEUGOUE NGALEU paulette Thèse de médecine
63
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Diagnostic retenu
Hyperprolactinémie
12%
G.iatrogénique
G.idiopathique
6%
18%
G. Sénile
6%
Hypogonadisme
24%
G.pubertaire
35%
Figure 23 : Répartition des patients en fonction du diagnostic retenu
Les gynécomasties étaient le plus souvent pubertaires et représentaient 35,3%
des cas.
DJEUGOUE NGALEU paulette Thèse de médecine
64
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
5.4. DONNEES THERAPEUTIQUES
Tableau XIII: Répartition des patients selon le traitement reçu
Effectif Fréquence(%)
Testostérone 7 41,2
Tamoxifène+DHT 2 11,7
Référence en chirurgie 1 5,9
Abstention thérapeutique 7 41,2
TOTAL 17 100
La testostérone a été la molécule la plus utilisée dans 53% des cas seule ou
associée.
DJEUGOUE NGALEU paulette Thèse de médecine
65
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
6.COMMENTAIRES ET DISCUSSION
6.1 Aspects méthodologiques
L’étude a été faite chez des patients suivis en consultation endocrinologique
externe dans le CHU du point G et du cabinet médical « DIDI NI TATA » de
Torokorobougou.
Il s’agissait d’une étude descriptive en prospective et rétrospective qui s’est
déroulée de janvier 2005 à Novembre 2010. Ce travail a été réalisé dans le but
d’étudier les aspects socio-démographiques, cliniques et étiologiques des
gynécomasties vu le risque qu’elles peuvent présenter du fait des étiologies
souvent graves.
Les limites à notre travail ont surtout été :
le coût élevé des examens complémentaires (hormones, imagerie),
le manque de moyens financiers des patients,
le non retour des patients après les premières ordonnances ce qui nous
empêche d’évaluer les aspects évolutifs,
le caractère rétrospectif de notre étude (manque d’informations et de
données dans les dossiers consultés),
la taille de notre série.
Toutefois, notre étude permet une première approche de la gynécomastie en
pratique hospitalière à Bamako.
Nous avons eu une fréquence hospitalière de 0,93%. Ceci est superposable
aux résultats de SIDIBE qui retrouve lui aussi 0,93% de fréquence hospitalière
sur une période de 16 ans.
6.2 Aspects socio démographiques
Au cours de notre étude, la moyenne d’âge était de 25,9 ans avec des extrêmes à
12 et 57 ans. Ce résultat est semblable à celui de VASSEUR et al chez qui la
moyenne d’âge était de 24 ans [49], et à celui de SIDIBE [2] qui a retrouvé une
moyenne d’âge de 22 ans.
DJEUGOUE NGALEU paulette Thèse de médecine
66
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Ces résultats discordent avec ceux de HAOUAT et al [5] chez qui la moyenne
d’âge était de 42 ans. Cette différence pourrait être due au fait qu’il n’avait
étudié que les gynécomasties non médicamenteuses.
La plupart de nos patients ont consulté à l’adolescence. La tranche d’âge la plus
représentée était [13-18] ans avec 47% des cas. Suivait la classe > 45 ans avec
23,5% des cas.
Ceci correspond à certaines séries de la littérature qui estiment que la
fréquence de la gynécomastie est grande à la puberté (40% entre 12 et 16 ans
voire 65% à 14 ans) [50].
Ces résultats sont différents de ceux retrouvés par Sidibe à Dakar [2] dont la
tranche d’âge la plus représentée était [21-30] avec 56,6% des cas. A noter tout
de même que la plus part de ses patients adultes ont une gynécomastie depuis
l’adolescence soit 53,34% des cas.
Tableau XIV : Etude comparative des moyennes d’âge d’après la littérature
AUTEURS AGE MOYEN EFFECTIFS
E.HAOUAT et Col [5] 42 22
MAHOUZI [4] 31,2 26
SIDIBE [2] 22 30
VASSEUR [49] 24 52
MALI 25,4 17
La plus part de nos patients ont consulté à la clinique « DIDI NI TATA »
ceci pourrait s’expliquer par le fait que les patients qui consultent en clinique
privée ont plus de moyens financiers et donc de capacité à réaliser les examens
complémentaires.
Nous avons noté que trois(3) ethnies étaient les plus représentées à savoir
Sarakolé, Bambara, et Senoufo avec respectivement 23,5%, 17,6% et 17,6%.
Ceci pourrait s’expliquer par le fait que les Sarakolé ont plus accès aux soins de
santé et les Bambara sont l’ethnie majoritaire dans le district de Bamako.
DJEUGOUE NGALEU paulette Thèse de médecine
67
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
6.3 Aspects cliniques.
Le motif de consultation le plus fréquent était l’augmentation isolée du
volume mammaire 70,6% des cas. Ce qui pourrait s’expliquer par le fait qu’il
s’agit d’un préjudice esthétique conduisant plus rapidement en consultation.
La durée d’évolution de la gynécomastie était estimée entre 1 et 3 ans dans
52,9% des cas ce qui est superposable aux résultats trouvés par SIDIBE[2] qui a
une tranche d’évolution située entre 2 et 5 ans majoritaire.
La population dont l’IMC était supérieur à la normale était d’environ
52,9% ceci pourrait s’expliquer par le fait qu’il peut y avoir un excès probable
d’aromatisation estrogénique au cours de prise pondérale chez des hommes
ayant une répartition du tissu adipeux de type gynoïde.
La localisation de la gynécomastie était bilatérale dans 88,2% contre 5,9%
pour les localisations unilatérales gauche et droite chacune. Ces données sont
identiques à celles retrouvées par LECLERE et Col [1], SIDIBE [2], et
VASSEUR [48] qui ont trouvé respectivement 82 %, 53,3% et 75% de
localisation bilatérale. Ceci corroborant l’étiologie hormonale prédominante de
la gynécomastie.
Tableau XV: Comparaison de la Topographie de la gynécomastie en
fonction des auteurs
Auteurs Bilatérale Unilatérale
SIDIBE [2] 53,33% 46,26%
VASSEUR [48] 75% 25%
LECLERE ET COL [1] 82% 18%
MALI notre étude 88,2% 11,8%
La mastodynie a été retrouvée chez deux patients (n=2) soit 11,8% de nos
patients qui ne présentait une gynécomastie que depuis moins d’un an. Ceci
pourrait s’expliquer par les réactions inflammatoires et d’hyperplasie dans le
sein au début de la gynécomastie.
DJEUGOUE NGALEU paulette Thèse de médecine
68
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Chez quatre (n=4) de nos patients soit 23,5% des cas il y’a une notion de
galactorrhée retrouvée à l’interrogatoire et à l’examen physique. Ces résultats
sont légèrement supérieurs à ceux retrouvés par SIDIBE [2] qui a objectivé 5 cas
sur 27 soit environ 18,5%.Cette différence pourrait s’expliquer par le fait que la
galactorrhée n’avait pas été recherchée dans tout son échantillon.
6.4 Aspects paracliniques, étiologiques et thérapeutiques
L’exploration paraclinique a été demandée de façon systématique, elle n’a
pas été effective dans tous les cas. Dans certains cas nous avons dû réorienter
les examens complémentaires en fonction de contexte clinique. Nous avons
réalisé un dosage de la testostérone dans 94% des cas, l’œstradiol et la LH
dans 64,7% des cas. La prolactine a été dosée dans 88% des cas, la βHCG dans
13 cas soit 76,5% des cas.
Sur le plan Radiologique, 76,4% des patients de notre série ont réalisé une
mammographie. L’échographie testiculaire a été faite dans 29,4%.
L’orientation clinique et le profil hormonal ont parfois suscité la réalisation
d’un scanner cérébral et d’une radiographie de la selle turcique.
Le diagnostic de gynécomastie sénile a été posé dans 11,8% des cas. Les deux
patients concernés étaient âgés de 57ans.
Le taux de prolactine est revenu deux fois au dessus de la normale.
Nous avons retenu le diagnostic de gynécomastie pubertaire chez 35,3% des
cas. Ceci concorde avec les données la littérature qui s’accordent sur le fait que
la gynécomastie est le plus souvent pubertaire. [1, 2, 48, 49, 50,51].
Nous avons retrouvé trois cas d’hypogonadisme dont un (1) en rapport avec le
Syndrome de Kleinefelter. SIDIBE n’a pas retrouvé d’hypogonadisme.
HAOUAT et Col ont retrouvé trois (3) cas d’hypogonadisme dont un est en
rapport avec un syndrome de Kleinefelter.
Notre enquête a trouvé un cas gynécomastie médicamenteuse conséquence d’un
traitement antirétroviral à base de Stavudine. D’après Meerkotter D [52], la
survenue de gynécomastie dans la population des patients sous trithérapie
antirétrovirale serait de 2,8%. Toutefois, ce ne sont pas toutes les molécules qui
sont responsables de gynécomastie les principales seraient les inhibiteurs de
protéases et la stavudine.
Sur le plan thérapeutique la testostérone a été la molécule la plus
fréquemment utilisée (53% des cas), très souvent sous forme de
dihydrotestostérone. Ceci probablement à cause de son effet double : à distance
DJEUGOUE NGALEU paulette Thèse de médecine
69
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
sur l’axe hypothalamo-hypophysaire, et locale sur le sein. Quelque fois, pour un
effet maximum, elle a été utilisée en association avec le tamoxifène qui a une
action anti œstrogénique.
Les aspects évolutifs étaient mal connus, puisque la majorité des patients ont
été perdus de vue après l’instauration du traitement.
DJEUGOUE NGALEU paulette Thèse de médecine
70
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
CONCLUSION
La gynécomastie est une prolifération bénigne de la glande mammaire de
l’homme qui résulte d’un déséquilibre entre androgènes et les œstrogènes.
L’augmentation du volume mammaire ne suffit pas pour porter le diagnostic de
gynécomastie. Elle est physiologique à certains âges de la vie, soit secondaire, à
la prise de médicaments ou à des maladies entraînant une baisse des androgènes
ou une élevation des oestrogènes. En absence de cause évidente, le bilan associe
une évaluation des fonctions rénales, hépatique et thyroïdienne ainsi qu’un
dosage de la LH, de la β-hCG, de l’estradiol et de la testostérone totale.
Notre étude a porté sur les aspects cliniques paracliniques et thérapeutiques
des gynécomasties en pratique hospitalière à Bamako. Les résultats retrouvés ne
présentent pas un caractère particulier par rapport à ceux retrouvés dans la
littérature en Afrique.
Nous avons noté la prépondérance des gynécomasties idiopathiques, par
conséquent l’abstention thérapeutique a été très fréquente.
Toutefois il ne faudrait pas oublier que des cancers peuvent être à l’origine des
gynécomasties et par conséquent un bilan minimum doit être réalisé face à ce
symptôme à la moindre suspicion. Cela permettrait de ne pas passer à côté des
formes graves.
DJEUGOUE NGALEU paulette Thèse de médecine
71
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
Recommandations :
De cette étude peuvent être tirées quelques recommandations adressées à
l’ensemble des acteurs du système de santé national.
Au Gouvernement et au Ministère de la santé :
Faire des campagnes pour inciter les populations à consulter tôt.
Subventionner des examens complémentaires pour une meilleure
exploration des pathologies
Mettre à la disposition des hôpitaux des laboratoires pouvant réaliser les
dosages hormonaux.
Organiser des formations du personnel de santé sur la prise en charge des
gynécomasties.
Aux Médecins traitants :
Meilleure tenue des dossiers des patients pour un meilleur suivi.
Faire le bilan nécessaire au diagnostic étiologique pour ne pas passer à
côté des formes secondaires graves.
Aux patients
Consulter plus tôt devant une toute pathologie
S’investir d’avantage pour la réalisation des examens complémentaires.
Revenir aux rendez-vous des médecins pour le contrôle.
DJEUGOUE NGALEU paulette Thèse de médecine
72
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
REFERENCES BIBLIOGRAPHIQUES
1. Leclère FMP, Spies A, Vogt PM La gynécomastie, ses étiologies et sa
prise en charge chirurgicale : y a-t-il une différence entre les cas
bilatéraux et unilatéraux ? Ann chir plas.2008 ; 53 : 255-261
2. Sidibe EH. Les gynécomasties à Dakar (à propos de 30 cas), Androl.
2001 ;11,2 : 63-68.
3. Bosquet F, Sert C, Casanova S et Trevidic P. Gynécomasties. Encycl
Méd Chir (Elsevier, Paris), Endocrinologie-Nutrition, 10-034-G-10, 1996,
5p.
4. Mazouzi H. Les étiologies des gynécomasties. Diabetes & Metabolism
[en ligne] 2007 Mars ; [consulté le 10 nov 2010] ; 33 :112. Consultable à
L’URL : http://www.em-consulte.com/article/81584.
5. Haouat E, Hadj Ali I, Mchirgui N, Khiari K, Lakhoua Y,
Cheikhrouhou H et Al. Les gynécomasties non médicamenteuses : étude
descriptive de 22 patients. [en ligne] Consultable à
l’URL : www.endocrinologie.org.tn/pdf/sousse.doc.
6. Pujol P, Maudelonde T. Physiologie et Physiopathologie de la glande
Mammaire. - Encycl Méd Chir (Elsevier, paris), glandes nutrition, 10-
034-E-10, 1997
7. Sakakura TY, Sakagami Y, Nishizuka Y. Dual origin of
mesenchymal tissues participating in mouse mammary gland
embryogenesis. Dev Biol 1982 ; 91 : 202-207
8. Dabelow A. Die Milchdrüse. In: Handbuch des mikroskopischen
Anatomie des Menschen. Berlin : Springer-Verlag, 1987 ; (vol 3) : 277-
485
9. Vorherr H. Development of the female breast. In: The breast. New York
: Academic Press, 1974: 1-19
10. Durnberger H, Kratochwil K. Specificity of tissue interaction and
origin of mesenchymal cells in the androgen response of the embryonic
mammary gland. Cell 1980 ; 19 : 465-471
DJEUGOUE NGALEU paulette Thèse de médecine
73
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
11. Anbazhagan R, Bartek J, Monaghan P, Gusterson BA. Growth
and development of the human infant breast. Am J Anat 1991
; 192 : 407-417
12. McKiernan JF. Breast development in the newborn. Arch Dis
Child 1981 ; 56 : 525-529
13. Wheryha G, Leclère J. Physiologie et exploration fonctionnelle du
testicule endocrine- Editions techniques- Encycl. Med. Chir. (Paris-
France), Endocrinologie, nutrition, 10-032-A-10 ; 1994, 9p.
14. Kuhn J, Sibert L. Les pathologies du vieillissement masculin.
Montrouge, F, John Libbey Eurotext, 2002:165p.
15. Mooradian AD, Morley JE, Korenman SG. Biological actions of
androgens. Endocr Rev, 1987; 8: 1-28.
16. Brown TR. Androgen Action. In: Contemporary Endocrinology:
Androgens in Health and Disease. Bagatell CJ, Bremner WJ, Totowa,
Humana Press Inc., 2003: 23-44.
17. Tostain J, Rossi D, Martin PM. Physiologie des androgènes chez
l’homme adulte. Progr Urol. 2004; 14 : 685-688.
18. Gompel A, Mowszowicz I, et Pouatout Ph. Pseudohermaphrodismes
masculins. Editions techniques. Encycl. Méd. Chir. (Paris),
Endocrinologie-Nutrition, 10-033-B-10, 1993, 8p.
19. Marieb EN. Anatomie et physiologie humaines. Traduction de la 4ème
édition américaine. Paris : DeBoeck Université ; 1999.
20. Rommerts F. Testosterone: An overview of biosynthesis, transport,
metabolism and non genomic actions. In: Testosterone: Action,
Deficiency, Substitution. Nieschlag E, Behre HM, Berlin, Springer-
Verlag, 1998: 1-31.
21. Stocco DM. A StAR search: implications in controlling steroidgenesis.
Biol Reprod, 1997; 56: 328-336.
22. Stocco DM. Tracking the role of a star in the sky of the new millennium.
Mol Endocrinol, 2001; 15: 1245-1254.
23. King SR, Manna PR, Ishii T, Syapin PJ, Ginsberg SD, Wilson K, et
Alii. An essential component in steroid synthesis, the steroidogenic acute
DJEUGOUE NGALEU paulette Thèse de médecine
74
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
regulatory protein, is expressed in discrete regions of the brain. J
Neurosci, 2002; 22: 10613-10620.
24. Li H, Papadopoulos V. Peripheral-type benzodiazepine receptor function
in cholesterol transport. Identification of a putative cholesterol
recognition/interaction amino acid sequence and consensus pattern.
Endocrinology, 1998; 139: 4991-4997.
25. Baulieu EE. Neuroactive neurosteroids: dehydroepiandrosterone and
dehydroepiandrosterone sulfate. In: DHEA a Comprehensive Review.
Thijssen J., Nieuwenhuyse H, eds, Carnforth,UK, Parthenon Publishing,
1999: 35-68.
26. Labrie F, Belanger A, Luu-the V, Simard J, Lin S, Cusan L, et AL :
Role of DHEA transformation into androgens and estrogens in peripheral
interactive tissues. In: DHEA a Comprehensive Review. Thijssen J,
Nieuwenhuyse H, Carnforth,UK, Parthenon Publishing, 1998: 38-54.
27. Vermeulen A. Physiopathology of dehydroepiandrosterone and its
sulfate. In: DHEA a Comprehensive Review. Thijssen J, Nieuwenhuyse
H, Carnforth, Parthenon Publishing, 1999: 13-34.
28. Arlt W, Haas J, Callies F, Reincke M, Hubler D, Oettel M, et Alii.
Biotransformation of oral dehydroepiandrosterone in elderly men:
significant increase in circulating estrogens. J Clin Endocrinol Metab,
1999; 84: 2170-2176.
29. Winters SJ, Dalkin AC. Neuroendocrine control of testicular function.
In: Male Hypogonadism: Basic, Clinical, and Therapeutic Principles.
Winters SJ, Totowa, NJ, Humana Press Inc., 2004: 1-21.
30. Rommerts F. Testosterone: An overview of biosynthesis, transport
metabolism and non genomic actions. In: Testosterone: Action,
Deficiency, Substitution. Nieschlag E., Behre HM,Cambridge, Cambridge
University Press, 2004: 1-37.
31. Jost A. Sur le rôle des gonades foetales dans la différenciation sexuelle
somatique de l'embryon de lapin. C R Assoc Anat 1947 ; 34 : 255-262
32. Blyth B, Duckett JJ. Gonadal differentiation: a review of the
physiological process and influencing factors based on recent
experimental evidence. J Urol 1991;145: 689-694
DJEUGOUE NGALEU paulette Thèse de médecine
75
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
33. Tostain J, Rossi D. Physiologie du déficit androgénique lié à l’âge. In:
Physiologie des androgènes : de l’homme Adulte à l’Homme vieillissant.
Prog en Urol 2004 ; 14 : 661-677.
34. Pariente JL et coll. Gynécomasties .Progrès en urologie[en ligne]
1999,9[consulté le 12 /12/2009] ; pages 1132 à 1135 ; consultable à
l’URL : http://www.urofrance.org/fileadmin/documents/data/PU/1999/PU
-1999-00091132/TEXF-PU-1999-00091132.PDF
35. Meyer P. Evaluation et prise en charge d’une gynécomastie. Rev Med
Sui. 2009 ; 5, 198 : 783-787.
36. Tostain J, Rossi D. Physiologie du déficit androgénique lié à l’âge. In:
Physiologie des androgènes : de l’homme Adulte à l’Homme vieillissant.
Prog en Urol 2004 ; 14 : 661-677.
37. Pages A, Ramos J. Contribution à l’étude des gynécomasties. A propos
de 122 cas. Ann. Pathol., 1984; 4 : 137-142
38. D. Casanova D, Magalon G. Traitement chirurgical des gynécomasties.
J. Chir. (Paris), 1997 ; 134, 2 : p. 76-79
39. Di Raimondo CH, Roach A, Meador C. Gynecomastia from
exposure to vaginal estrogen cream. N Engl J Med 1980
; 302 : 1089-1090
40. Caron PH, Duyemes JM, Pourrat J, Conte JJ, Louvet
JP Gynécomastie et insuffisance rénale chronique en hémodialyse
périodique. Mise en évidence d'une diminution de la fraction libre de
testostérone. Rev Med Intern 1984 ; 5 : 110-113
41. Garcin JM, Brunot J, Vicens JL, Gauthier D. Diagnostic
étiologique des gynécomasties. Intérêt de l'échotomographie
testiculaire. Presse Med 1986 ; 15 : 1241
42. Bercovici JP, Nahoul K, Ducasse M, Tater D, Kerlan V, Scholler
R Leydig cell tumor with gynecomastia : further studies - the recovery
after unilateral orchidectomy. J Clin Endocrinol Metab 1985
; 61 : 957-962
43. Tseng A, Horning S, Freiha F, Resser K, Hannigan J, Torti F.
Gynecomastia in testicular cancer patients. Cancer 1985
; 55 : 2534-2538
DJEUGOUE NGALEU paulette Thèse de médecine
76
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
44. Glen D, Braunstein MD. Gynecomastia. N Eng J M 2007; 9, 357;12
:1229-1237.
45. Pugeat M, Thivolet CH, Reida AM, Dechaud H, Forest MG,
Tourniaire J. Mécanismes d'action de la dihydrotestostérone
administrée par voie percutanée dans le traitement de la
gynécomastie. Rev Fr Endocrinol Clin 1988 ; 29 : 606-611
46. Tashkandi M, Al-Qattan MM, Hassanain JM, Hawary MB, Sultan
M. The surgical management of hight-grade gynecomastia. Ann Plast
Surg 2004; 53: 17–20.
47. Pensler JM, Yost MJ. Gynecomastia: Treatment, [en ligne] 2004 Avril.
[consulté le 20 novembre 2010] ; 1(1) consultable à
l’URL : http://emedicine.medscape.com/article/1273437-treatment.
48. D. Casanova D, Magalon G. Traitement chirurgical des gynécomasties.
J. Chir. (Pa ris), 1997 ; 134, 2 : p. 76-79
49. Vasseur C. Martinot V, Hodin E, Patenotre P, Pellerin P.
Gynécomastie. Prise en charge diagnostique et thérapeutique : A propos
de 52 cas. Ann Chir. 1998 ; 52, 2 : 161-184.
50. Roux S. Conduite à tenir en cas de gynécomastie. Rev. Prat., 1986 ; 346 :
25-28.
51. Al-Qattan M, Hassanain J, Mahmoud S, El-Shayeb A, Tashkandi M,
Al-Kattan WM. On the Neglected Entity of Unilateral Gynecomastia.
Ann plast surgery. 2005 Septembre; 3, 55: 255-257.
52. Meerkotter D. Gynaecomastia associated with highly active antiretroviral
therapy (HAART) J of Radiol 2010 Juillet; 4, 7: 34-40
53. Kuhn JM. La Gynécomastie. In Traité Endocrinologie. Philippe Chanson,
Jacques Young.2007, Flammarion. Paris:651-653.
DJEUGOUE NGALEU paulette Thèse de médecine
77
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
FICHE SIGNALITIQUE
NOM : DJEUGOUE NGALEU
PRENOM : Paulette
TITRE DE LA THESE : Contribution à l’étude de la gynécomastie en pratique
hospitalière à Bamako au Mali.
ANNEE DE SOUTENANCE : 2011
VILLE DE SOUTENANCE : Bamako
PAYS D’ORIGINE : Cameroun
LIEU DE DEPOT : Bibliothèque de la Faculté de Médecine, de Pharmacie et
d’Odonto-Stomatologie du Mali.
SECTEURS D’INTERETS : Endocrinologie; Chirurgie esthétique et thoracique ;
Gynécologie ; Santé publique.
RESUME
La gynécomastie La gynécomastie est une pathologie masculine définie par une
prolifération glandulaire bénigne de tissu mammaire.
Nous avons mené une étude rétrospective et prospective qui s’est étendue de Janvier
2005 à Novembre 2010 visant à évaluer les aspects socio-démographiques, cliniques et
étiologiques des gynécomasties en consultation endocrinologique à Bamako au Mali.
Les cas de gynécomasties ont représenté 0,93% des dossiers des patients ayant
consulté dans les services soumis à notre étude. Parmi les 17 cas qui ont fait l’objet de
notre étude, 43% des patients ont consulté à l’adolescence. La moyenne d’âge a été de
25,9 ans. Dans près de 53% des cas les patients consultent entre un et trois ans
d’évolution. La gynécomastie a été bilatérale dans 88,2% des cas. Les gynécomasties
unilatérales gauches et droites ont eu le même pourcentage soit 5,9%des cas. Nous
avons eu 4 cas de galactorrhée. Elles sont physiologiques dans la plus part des cas
(35% pubertaires, et, sénile dans 6% des cas). Nous avons eu 3 hypogonadismes et un
cas de gynécomastie iatrogénique. Aucun traitement n’a été proposé chez 7 patients,
un traitement à base de testostérone a été instauré chez 52,9% patients.
MOTS CLES : Gynécomastie ; Troubles hormonaux ; tumeurs testiculaires Afrique ;
Mali.
DJEUGOUE NGALEU paulette Thèse de médecine
78
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
FICHE D’ENQUETE No…
Age : Profession : Ethnie:
Poids : Taille : IMC :
Antécédents :
-Familiaux de gynécomastie : Oui [ ] Non [ ]
-Personnels de gynécomastie pendant l’adolescence : Oui [ ] Non [ ]
-Personnels de prise médicamenteuse Oestrogènes
Androgènes
Anti androgènes : Ketoconazole [ ] Spironolactone [ ]
Cimétidine [ ]
Toxiques : haschish [ ] Marijauna [ ]
Oestrogénomimétiques : Digoxine [ ] Isoniazide [ ]
Antidopaminergiques Sulpiride [ ] métocloprzmide [ ]
tiapride [ ] phénotiazine [ ] riperidone[
]
Chimiothérapie anti-néoplasique [ ]
Inhibiteus del’uricosynthèse : Allopurinol [ ]
Traitement Anti HIV : Indinavir [ ] Stavudine [ ]
Autre Préciser………………………………………………
Topographie de la gynécomastie
- Unilatérale gauche [ ]
- Unilatérale droite [ ]
- Bilatérale [ ]
Ecoulement mamelonaire : Oui [ ] Non [ ]
Pilosité Normale : Oui [ ] Non [ ]
Présence de nodules Testiculaires : Oui [ ] Non [ ]
Présence de nodule thyroïdien : Oui [ ] Non [ ]
DJEUGOUE NGALEU paulette Thèse de médecine
79
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
LH Normale [ ] Elevée [ ] Basse [ ] Non
faite [ ]
β- HCG Normale [ ] Elevée [ ] Basse [ ] Non
faite [ ]
Oestradiol : Normale [ ] Elevée [ ] Basse [ ] Non
faite [ ]
Testostéronémie Normale [ ] Elevée [ ] Basse [ ] Non
faite [ ]
Prolactinémie Normale [ ] Elevée [ ] Basse [ ] Non
faite [ ]
Mammographie :
Echographie Mammaire
Echographie testiculaire
Diagnostic retenu :
- Tumeur testiculaire germinale [ ]
- Tumeur extratesticulaire [ ]
- Cancer HCG sécrétant [ ]
- Tumeur à Prolactine [ ]
- Tumeur de Leydig ou de sertoli [ ]
- Cancer de la surrénale [ ]
- Hypogonadisme primaire [ ]
- Hypogonadisme secondaire [ ]
Traitement reçu
- Tamoxifène [ ]
- Dihydrotestostérone [ ]
- Testolactone [ ]
- Référence en chirurgie [ ]
- Abstention thérapeutique [ ]
DJEUGOUE NGALEU paulette Thèse de médecine
80
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
SERMENT D’HYPOCRATE
En présence des Maîtres de cette faculté, de mes chers condisciples, devant
l’effigie d’Hippocrate, je promets et je jure, au nom de l’Etre Suprême,
d’être fidèle aux lois de l’honneur et de la probité dans l’exercice de la
médecine.
Je donnerai mes soins gratuits à l’indigent et n’exigerai jamais un salaire au
dessus de mon travail.
Je ne participerai à aucun partage clandestin d’honoraires.
Admis à l’intérieur des maisons, mes yeux ne verront pas ce qui s’y passe,
ma langue taira les secrets qui me seront confiés et mon état ne servira pas
à corrompre les mœurs, ni à favoriser le crime.
Je ne permettrai pas que des considérations de religions, de nations, de
races, de partie ou de classe sociale viennent s’interposer entre mon devoir
et mon patient.
Je garderai le respect absolu de la vie humaine dès la conception.
Même sous la menace, je n’admettrai pas de faire usage de mes
connaissances médicales contre les lois de l’humanité.
Respectueux et reconnaissant envers mes maîtres, je rendrai à leurs enfants
l’instruction que j’ai reçue de leurs pères.
Que les hommes m’accordent leurs estimes si je suis fidèle à mes
promesses !
Que je sois couvert d’opprobre et méprisé de mes confrères si j’y manque !
Je le jure !
DJEUGOUE NGALEU paulette Thèse de médecine
81
Contribution à l’étude de la gynécomastie en pratique hospitalière à Bamako au Mali
NOM : DJEUGOUE NGALEU
PRENOM : Paulette
TITRE DE LA THESE : Contribution à l’étude de la
gynécomastie en pratique hospitalière à Bamako au
Mali.
ANNEE DE SOUTENANCE : 2011
VILLE DE SOUTENANCE : Bamako
PAYS D’ORIGINE : Cameroun
LIEU DE DEPOT : Bibliothèque de la Faculté de Médecine, de Pharmacie et
d’Odonto-Stomatologie du Mali.
SECTEURS D’INTERETS : Endocrinologie; Chirurgie esthétique et thoracique ;
Gynécologie ; Santé publique.
RESUME
La gynécomastie La gynécomastie est une pathologie masculine définie par une
prolifération glandulaire bénigne de tissu mammaire.
Nous avons mené une étude rétrospective et prospective qui s’est étendue de Janvier
2005 à Novembre 2010 visant à évaluer les aspects socio-démographiques, cliniques et
étiologiques des gynécomasties en consultation endocrinologique à Bamako au Mali.
Les cas de gynécomasties ont représenté 0,93% des dossiers des patients ayant
consulté dans les services soumis à notre étude. Parmi les 17 cas qui ont fait l’objet de
notre étude, 43% des patients ont consulté à l’adolescence. La moyenne d’âge a été de
25,9 ans. Dans près de 53% des cas les patients ont consulté entre un et trois ans
d’évolution. La gynécomastie a été bilatérale dans 88,2% des cas. Les gynécomasties
unilatérales gauches et droites ont eu le même pourcentage soit 5,9% des cas. Nous
avons eu 4 cas de galactorrhée. Les gynécomasties ont été physiologiques dans la plus
part des cas (35% pubertaires, et, sénile dans 6% des cas). Nous avons eu 3
hypogonadismes et un cas de gynécomastie iatrogénique. Aucun traitement n’a été
proposé chez 7 patients, un traitement à base de testostérone a été instauré chez
52,9% patients.
MOTS CLES : Gynécomastie ; Troubles hormonaux ; Afrique ; Mali.
DJEUGOUE NGALEU paulette Thèse de médecine
82
Vous aimerez peut-être aussi
- Adénomes Hypophysaires GonadotropesDocument11 pagesAdénomes Hypophysaires GonadotropesyaalaPas encore d'évaluation
- 14P32 PDFDocument69 pages14P32 PDFAnonymous KasgItFPas encore d'évaluation
- Dit MNH Sein AtteintDocument126 pagesDit MNH Sein AtteintÎmę NęPas encore d'évaluation
- Evaluation Des Infections Parasitaires Dans Le Village de Kalifabougou: MaliDocument102 pagesEvaluation Des Infections Parasitaires Dans Le Village de Kalifabougou: Maliawafaye0310Pas encore d'évaluation
- Etude Epidemiologique, Clinique Et Therapeutique de L'Anemie Sur Grossesse Au Csref de KadioloDocument93 pagesEtude Epidemiologique, Clinique Et Therapeutique de L'Anemie Sur Grossesse Au Csref de KadioloEngwataPas encore d'évaluation
- Etude de L'Alimentation Des Basketteurs Au Cours Des Preparations PrecompetitivesDocument86 pagesEtude de L'Alimentation Des Basketteurs Au Cours Des Preparations PrecompetitivesMomo SyllaPas encore d'évaluation
- 23P157Document120 pages23P157abdoukt01Pas encore d'évaluation
- Memoire Des DR Fatoumata MaigaDocument66 pagesMemoire Des DR Fatoumata MaigaDalila Miloud-AbidPas encore d'évaluation
- TheseDocument89 pagesTheseSoumaïla CoulibalyPas encore d'évaluation
- 19M451Document89 pages19M451Noussaiba ElhaskouriPas encore d'évaluation
- Etude Du Traitement Traditionnel de L'Hypertension Arterielle Au MaliDocument139 pagesEtude Du Traitement Traditionnel de L'Hypertension Arterielle Au MaliDiallo SafaiouPas encore d'évaluation
- Université Cheikh InfantileDocument111 pagesUniversité Cheikh InfantileACID100% (1)
- These: Université Des Sciences, Des Techniques Et Destechnologies de BamakoDocument111 pagesThese: Université Des Sciences, Des Techniques Et Destechnologies de Bamakomatthieu kabeyaPas encore d'évaluation
- 15M102Document81 pages15M102monijeviaPas encore d'évaluation
- Thèse de Docteur en MédecineDocument102 pagesThèse de Docteur en MédecineYacouba DembelePas encore d'évaluation
- 21M116Document81 pages21M116Koké Lamine TraoréPas encore d'évaluation
- Aspects Epidemiologiques de La Retinopathie Diabetique Au Centre de Sante de Reference de La Commune Iv Du District de BamakoDocument101 pagesAspects Epidemiologiques de La Retinopathie Diabetique Au Centre de Sante de Reference de La Commune Iv Du District de BamakoZaki RakiaPas encore d'évaluation
- 12M337 PDFDocument116 pages12M337 PDFAllebarim MonaPas encore d'évaluation
- Etude DES Accouchements: Au Centre de Sante Communautaire de SanghaDocument132 pagesEtude DES Accouchements: Au Centre de Sante Communautaire de SanghaAugustin Kazadi (Augustin docta)Pas encore d'évaluation
- M. Ibrahima CISSE: Titre de ThèseDocument91 pagesM. Ibrahima CISSE: Titre de Thèsekatimere GastonPas encore d'évaluation
- Cap PF BamakoDocument86 pagesCap PF Bamakodamien cyrPas encore d'évaluation
- Etude de La Coinfection Vih - BK Au CentreDocument101 pagesEtude de La Coinfection Vih - BK Au Centretaty mintaPas encore d'évaluation
- THESE_CHEICKNA_corrige_18-10-23.Document125 pagesTHESE_CHEICKNA_corrige_18-10-23.cheicknadoukara87Pas encore d'évaluation
- 15M20Document86 pages15M20nathan mutonji kanongePas encore d'évaluation
- UntitledDocument121 pagesUntitledMahefa Serge RakotozafyPas encore d'évaluation
- These: Appendicite Aiguë, Aspects Diagnostic Et Thérapeutique Au CS Réf de OuéléssébougouDocument81 pagesThese: Appendicite Aiguë, Aspects Diagnostic Et Thérapeutique Au CS Réf de OuéléssébougouNasrallah AhlamPas encore d'évaluation
- Mémoire Sur URO-TDMDocument91 pagesMémoire Sur URO-TDMgirez tayoPas encore d'évaluation
- 15M273 PDF JsessionidDocument95 pages15M273 PDF JsessionidHerby BayoliPas encore d'évaluation
- Motifs de Consultation en Gynécologie Au CHU Gabriel Touré: TheseDocument126 pagesMotifs de Consultation en Gynécologie Au CHU Gabriel Touré: Thesefefago7978100% (1)
- 11M228 PDFDocument85 pages11M228 PDFSawoulou celest Dopavogui100% (1)
- 12M167 PDFDocument95 pages12M167 PDFKalabatakaraPas encore d'évaluation
- Thèse Etude Phytochimie Et Activités BioDocument141 pagesThèse Etude Phytochimie Et Activités BioJosianny Joseph100% (1)
- Gestion Du Frein Labial Maxillaire - 2Document128 pagesGestion Du Frein Labial Maxillaire - 2nessyPas encore d'évaluation
- Faculté de Médecine Et D'odontostomatologie: (FMOS)Document71 pagesFaculté de Médecine Et D'odontostomatologie: (FMOS)Kami LyaPas encore d'évaluation
- Titre: M. Gberi Emgbang ArnaudDocument62 pagesTitre: M. Gberi Emgbang ArnaudEmmanuel OwonaPas encore d'évaluation
- Par MR: Gnizin Dit Sebou DIARRA: Audit Des Deces Maternels Et Neonatals Dans Le District Sanitaire de KolokaniDocument176 pagesPar MR: Gnizin Dit Sebou DIARRA: Audit Des Deces Maternels Et Neonatals Dans Le District Sanitaire de KolokaniMathieu SAYEPas encore d'évaluation
- FOUTSE 161rj832ws181prn910wpqci THDocument310 pagesFOUTSE 161rj832ws181prn910wpqci THlaurainetemgouaPas encore d'évaluation
- 185 BRAVO - CopieDocument99 pages185 BRAVO - CopieAmurukuch N TimmuzghaPas encore d'évaluation
- 06M295Document85 pages06M295amédée junior wawaPas encore d'évaluation
- Prostatite Chronique: Aspect: Epidemio-Clinique Et Therapeutique Au Service D'Urologie de L'Hopital Gabriel ToureDocument88 pagesProstatite Chronique: Aspect: Epidemio-Clinique Et Therapeutique Au Service D'Urologie de L'Hopital Gabriel ToureWollPas encore d'évaluation
- Gestion de Stocks Des Medicaments Essentiels Au Niveau de La Pharmacie Hospitaliere Du Chu PR Bocar Sidy Sall de KatiDocument92 pagesGestion de Stocks Des Medicaments Essentiels Au Niveau de La Pharmacie Hospitaliere Du Chu PR Bocar Sidy Sall de KatiAnas El FarissiPas encore d'évaluation
- Université Des Sciences, Des Techniques Et Des Technologies de Bamako Faculté de Médecine Et D'OdontostomatologieDocument115 pagesUniversité Des Sciences, Des Techniques Et Des Technologies de Bamako Faculté de Médecine Et D'OdontostomatologieEbbah Med SalemPas encore d'évaluation
- Evaluation Des Activités D'hématologie Au Service de Médecine Et D'endocrinologie de L'hôpital Du MaliDocument78 pagesEvaluation Des Activités D'hématologie Au Service de Médecine Et D'endocrinologie de L'hôpital Du MaliBalayira Bakary100% (1)
- 05P25Document198 pages05P25kalaouiPas encore d'évaluation
- 15M147 PDFDocument139 pages15M147 PDFWilson BentoPas encore d'évaluation
- D Sidibé, Palu Kalifabg CscomDocument70 pagesD Sidibé, Palu Kalifabg CscomYacouba DembelePas encore d'évaluation
- These: TitreDocument95 pagesThese: TitreDieu Peut Tout100% (1)
- 2019 Medecine MaraisSarahDocument43 pages2019 Medecine MaraisSarahevarinejiomoPas encore d'évaluation
- Infection Urinaire Bacterienne Chez Les Enfants de 2 A 15 Ans A L'Hopital Nianankoro Fomba de SegouDocument83 pagesInfection Urinaire Bacterienne Chez Les Enfants de 2 A 15 Ans A L'Hopital Nianankoro Fomba de SegouAissa SadounePas encore d'évaluation
- MaliDocument140 pagesMaliYa-Dioubane GuèyePas encore d'évaluation
- Etude de Facteurs Influençant La Qualite de La PDFDocument96 pagesEtude de Facteurs Influençant La Qualite de La PDFAndré SOMEPas encore d'évaluation
- 15M74Document94 pages15M74Majja DPas encore d'évaluation
- WWW Bibliosante MLDocument115 pagesWWW Bibliosante MLjarrhelhounnassoPas encore d'évaluation
- Résultat de L'examen Cytobactériologique Des Liquides Péritonéaux Au Centre Hospitalier Universitaire Du Point GDocument121 pagesRésultat de L'examen Cytobactériologique Des Liquides Péritonéaux Au Centre Hospitalier Universitaire Du Point GHadjer GouabiPas encore d'évaluation
- Mem10 10Document45 pagesMem10 10mossusjoseph4Pas encore d'évaluation
- Par M. Adama KONE: Présentée Et Soutenue Publiquement Le... / / 2018 Devant La Faculté de Pharmacie Du MaliDocument99 pagesPar M. Adama KONE: Présentée Et Soutenue Publiquement Le... / / 2018 Devant La Faculté de Pharmacie Du MaliAminata DoumbiaPas encore d'évaluation
- Memoire DES DR Rakki M'BAYE EVALUATION DES CONNAISSANCES, ATTITUDESDocument77 pagesMemoire DES DR Rakki M'BAYE EVALUATION DES CONNAISSANCES, ATTITUDESJordy BalyahamwaboPas encore d'évaluation
- Flore et végétation: Plantes médicinales et éléments de gestion du Conservatoire botanique M. Adanson (Mbour-Sénégal)D'EverandFlore et végétation: Plantes médicinales et éléments de gestion du Conservatoire botanique M. Adanson (Mbour-Sénégal)Évaluation : 5 sur 5 étoiles5/5 (1)
- Un scalpel pour tout bagage: Mémoires d'un chirurgien pédiatre nomadeD'EverandUn scalpel pour tout bagage: Mémoires d'un chirurgien pédiatre nomadePas encore d'évaluation
- Gynécomastie en Pratique Clinique Pour Les Urologues: OriginalienDocument5 pagesGynécomastie en Pratique Clinique Pour Les Urologues: OriginalienIbrahimPas encore d'évaluation
- Gynécomastie de L'adolescent: Prise en Charge Médico-ChirurgicaleDocument2 pagesGynécomastie de L'adolescent: Prise en Charge Médico-ChirurgicaleIbrahimPas encore d'évaluation
- Evaluation Et Prise en Charge GynécomastiteDocument5 pagesEvaluation Et Prise en Charge GynécomastiteIbrahimPas encore d'évaluation
- Gynécomastie de L'adolescent: Prise en Charge Médico-ChirurgicaleDocument3 pagesGynécomastie de L'adolescent: Prise en Charge Médico-ChirurgicaleIbrahimPas encore d'évaluation
- Polycopié Physiopath Repro Dr. ALLAOUA Sofia Amel 2021Document84 pagesPolycopié Physiopath Repro Dr. ALLAOUA Sofia Amel 2021IbrahimPas encore d'évaluation
- Llopis Benoît. Thèse D'exercice de Pharmacie (UPJV)Document120 pagesLlopis Benoît. Thèse D'exercice de Pharmacie (UPJV)IbrahimPas encore d'évaluation
- GynecomastieDocument4 pagesGynecomastieIbrahimPas encore d'évaluation
- Oestroguide 2.0Document24 pagesOestroguide 2.0artagenPas encore d'évaluation
- 2011 PSPM Kedah Biologi 2 W AnsDocument39 pages2011 PSPM Kedah Biologi 2 W Ansjee2kk50% (2)
- Embryogenese Humaine DR MONZANGO Livre À Imprimer 2022 OKDocument154 pagesEmbryogenese Humaine DR MONZANGO Livre À Imprimer 2022 OKJosué FanguPas encore d'évaluation
- Qu'est-Ce Que L'hormone Folliculostimulante (FSH) ?Document2 pagesQu'est-Ce Que L'hormone Folliculostimulante (FSH) ?cou couPas encore d'évaluation
- QCM 5Document15 pagesQCM 5ayissiPas encore d'évaluation
- 612756d3d8477la Reproduction Chez Les Mammiferes SVT TerminaleDocument6 pages612756d3d8477la Reproduction Chez Les Mammiferes SVT TerminaleAmour ConfiancePas encore d'évaluation
- Coccinelle SVT Bac SC SXP OcrDocument225 pagesCoccinelle SVT Bac SC SXP OcrOmar KandePas encore d'évaluation
- La Reproduction-WPS OfficeDocument14 pagesLa Reproduction-WPS OfficeFelix AssemanPas encore d'évaluation
- Cours ModifphysioDocument46 pagesCours ModifphysioPierre DIONOUPas encore d'évaluation
- 2.. - Cours Rep Masc Eleves CopieDocument13 pages2.. - Cours Rep Masc Eleves CopieAbderahmen Haj DahmenPas encore d'évaluation
- HF Cours 4 1Document5 pagesHF Cours 4 1Pathe ThionganePas encore d'évaluation
- TD Embryologie Organes Genitaux Masculins Et SpermatogeneseDocument3 pagesTD Embryologie Organes Genitaux Masculins Et Spermatogenesejulien KoudouPas encore d'évaluation
- Leçon 11, Regulation Hormonale Du Fonctionnement DesDocument7 pagesLeçon 11, Regulation Hormonale Du Fonctionnement DesDertPas encore d'évaluation
- QCMs Physiologie (Q35) (I1)Document18 pagesQCMs Physiologie (Q35) (I1)Horn RatanaPas encore d'évaluation
- Biologie Animale GametogeneseDocument23 pagesBiologie Animale GametogeneseRodo KoulPas encore d'évaluation
- Thèse 2Document25 pagesThèse 2Julie BrachetPas encore d'évaluation
- Chap 1 QCM 2Document10 pagesChap 1 QCM 2Makram BouzidiPas encore d'évaluation
- 08.09 Regulation Hormones Sexuelles Mã LesDocument2 pages08.09 Regulation Hormones Sexuelles Mã LesRyan BoucettaPas encore d'évaluation
- Hypogonadisme FémininDocument4 pagesHypogonadisme FémininSoumaya SanhajiPas encore d'évaluation
- Adnomes Hypophysaires Ou Tumeurs Neuroendocrines Hypophysaires - Actualits Et ConsensusDocument17 pagesAdnomes Hypophysaires Ou Tumeurs Neuroendocrines Hypophysaires - Actualits Et ConsensusBOUBAKER BENTOUMIPas encore d'évaluation
- 1 La Spermatogenese CoursDocument11 pages1 La Spermatogenese CoursNoahPas encore d'évaluation
- Cours - 3 Les Régulation Hormonale de La MétabolismeDocument9 pagesCours - 3 Les Régulation Hormonale de La Métabolismemiss anthropocenePas encore d'évaluation