Académique Documents
Professionnel Documents
Culture Documents
Exercices Sur Les Acides Et Bases Faibles PDF
Transféré par
Ambroise KOLOMATitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices Sur Les Acides Et Bases Faibles PDF
Transféré par
Ambroise KOLOMADroits d'auteur :
Formats disponibles
Ult_t ttU-1NIUUt
Cours à domicile: Wahab DIOP - 775136349
,, _iSEYDINA LI MAMOU LAYE AnnéescoiBire: 2016-2017
Cellule de Sciences Physiques
GuÉ di awaye - Dakar
Classe: TS2
SERIE iYiXEÙL7CES SUN C7: ACIDES CI' BASES FA/DL~ COUPLES ACIDE/BASE-CONSTANTED'ACIDITE 1
. . -· ·· •
Er CLASSIFICATION DES COUPLES ACIDE/BASE
. . -.-·-·-··------ ---·-··- -·- - - ' ----·- - - - - --- -·-- ·--·--- -·~ -----~·--·-- - ---···•'"°' -· .
EXERCICE 1:
On prépare une solution en mettant une masse m = 0,32g de chlorure d'ammonium dans un volume V -.: 100 mL
d 'eau sans var iation de volume. Le pH de la solution obtenue est pH = 5,2,
1 I Montrer que l'ion ammonium est un acide faible.
2. / Ecrire l',_;quation de la réaction de dissolution du chlorure d'ammonium et celle de l'ion ammonium avec l'eau.
'.1,/ Calculer la concentration molaire des espèces chimiques présentes dans la solution.
1 / Défini•· la constante d'acidité Ka associée à l'équation de cette réaction. Calculer sa valeur ainsi que son pKa.
S I En dé 1:!uire l'espèce prédominante dans la solution (On ne tiendra pas compte des ions chlorure) .
_kXERCI .::E 2~
1
Donnée: Acide éthanoïque Ka = 1,8.1 o-s. i
Une ~olution est formée d'acide éthanoïque à 0,1 mol.L 1 On en prélève 10 mL et on complète à 100 mL avec de
l'eau pure. 011 obtient ain si une solution S'. On prélève 50 mL de S' et on complète à 500 mL toujours avec de l'eau
pun :. On obtient la solution S''.
J I ( .:alculer la concentration de chaque solution S' et S" .
2/ Ecrire l'équation-bilan de la réaction de l'acide avec l'eau.
3/ Calculer pour les trois solutions le coefficient de dissociation a, a' et a". Conclure.
t)j;_ERÇICE 3:
-, I Tracer les zones de prédominance relatives aux couples NtV/NH?o et CH 3 -COOH/CH:: -COO-
On donne: pKa(NH{' /NH3) = 9,2 ; pKa(CHs -COOH/CHs-COO·) = 4,8.
?./ 011 mélange un volume V 1 c:: 50 mL de solution de chlorure d'ammonium de concentration
C 1 • l ,0. 10· 1 1110!.L-1 avec un volume V?. == 50 mL de solution d'éthanoate de sodium de concentration
C '. • l ,0 -10 1 mol.L-1 • Le pH est égal à 7.
Sans calcul, indiquer les espèces chimiques majoritaires présentes dans le mélange .
3/ faire l'inve ntaire de toutes les espèces chimiques présentes dans le mélanse et calculer leurs concentnitions .
Vé rifier le résultat de la question précédente.
EXERCICE 4:
U11e solution aqueuse d'acide 2-bromopropanoïque noté HA 1 de concentration molaire C :c: 5. J 0 -2 mol.L · 1 a un
pl 1 2,2 . Une solution aqueuse d'acide 3-bromopropanoïque noté HA 2 de même concentration molai re que la
solution précédente a un pH "-' 2,7 .
1 / ·Ecrire les équations-bilan relatives aux actions des deux acides sur l'eau.
21 Calculer les concentrations des espèces chimiques présentes dans chaque solution.
3/ Calculer les coefficients de dissociation a1 et a2 des deux acides HA 1 et HA2 dans les solutions étudiées.
La comparaï'son des valeurs de a 1 et a 2 suffit-elle pour classer les acides HA 1 et HAz suivant leur force ? Justifier Ici
n~ponse. .'
4 ! Calculer pKA 1 et pK.~2 relatifs aux deux couples .
SI On do nne le tableau suivant à compléter:
Acides 1· Acid~- -
_ rre>EID!_C>1que _JT___~~1!.!...'P_
~- -Acide:C:C!E_~~q!!_e
2,,2- .. I
-- _ ---
. Acide 2,3- .. [ HA1
_ -~b_!_()1!_l02_1:9E..af!~19.!J:~-- __ . _ - · _
Î
}
HA2
p!(:A · . __ j_!.9 __ ----- -- - --- - --·- ,, __},Ê ____ -- --- _ ___ ---- -. -~!.~-- - -- - -- - - _ ___ ••••.• i
a/ Cl asser, par force croissante , les cinq acides.
b / [n déduire J'influence sur leur force:
..,. du nombre d'atomes de brotne dans la molécule ;
..,. de la position des atomes de bron~e dans la molécule
EXERCICI:.5:
Donnée : pKa( CH3COO-/ CH3COOH) ::: 4,8
On considère une solution d'acide éthanoïquc de concentration Ca ,·= 10-2 11101.I,- 1.
l / Ecrire l'équation-bilan de la réaction de l'acide éthanoïque avec l'eau.
2/ /\,fontrer que le pH de cette solution peut se mettre sous la forme: pH= _L (pKa - logCa).Calculer sa valeur.
Î
(111admettra que la solution d 'acide n'est ni trop dihiée ni trop concentrée,
?,/ Calculer Je coeffici ent d'ionisation a de l'acide éthanoïque dans cette solu.tion.
EXERCICE 6:
On dissout 0, 1 mc lc de chlorure d'ammonium dans F eau pure, de façon à obtenir llitre de solution ; le pH de la
solution obtenue est égal à 5,1.
' j
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
1 / Ca 1.culer les .c oncentrations en mol.L-1, ·.les espèces chimiques présentes dans cette solution; en déduire le pka du
coup le i\: I-L1 +/ Nrh.
~ / On di::sout dé!• ,s l'eau pure un acide fa ible, l'hélianthine, dont on schématise la formule par R- S03H.
a/ Ecrire J'èqu:\tion de cette réaction aw ;c l'eau.
b / Le pka du cou pie correspondant à l'hélianthine est 3,5. Comparer la force de l'acide R - S03H à celle de ! 'acide
du couple NH ,+/Nrh
3/ La forme acide du couple correspondant à, l'hélianthine donne à la solution une couleur rose si sa concentration
est au moins lO fois supérieure à ceJl;~ de la forme basique.
La forme basique du couple corresr ondant à, l'hélianthine donne à la solution une couleur jaune si sa concentration
est au moins l O fois supérieure à c .elle de la forme acide.
f,11 ag issant sur le pH de la soluti .on de l'hélianthine, on peut faire varier la concentration des deux formes acide et
bnsiquc en présence.
Ddcrrniner pour quelles valew :s du pH la solution de l'hélianthine a d'une part, la coloration nette de la forme
basique .
On rappelle que le pka d'un , -0uple acide base donnée est indépendant de la présence d'autres espèces chimiques.
,1 / <.."'ln ajoute à la solution df _ chlorure d 'ammonium étudiée quelques gouttes de la solution d'hélianthine. i •
Le pH cle cette solution n'e.< ,t pas modifié par cette adjonction. Quelle est la couleur observée ?
EXERCICE 7:
Donnée$.;
~ Détermination dv Jl._~ du couple acide ! base:
Afin de déterminer le pKa d'un couple acide base, noté AH/ A·, on mesure ie pH de solutions contenant les dcu x
espèces conjuguées de cc couple. On utilisera une solution S 1 contenant l'espèce A· de concentration molaire
C1 : 0, 1 11101 IL et une solution S:i contenant 1'espèce AH, de concentration C 2 :.cc O, 1 mol.L · 1 •
Avec un pH-mètre, on mesu re le pH de plusieurs 111,~Ian.ges réalisés dans des béchers. V 1 représente le volume de S 1
et V , celu i cte S:, .
~1 ~~-~~
1 I Calculer la concentration des espèces chim'1ques présentes dans le mélange M 2 et montrer que
(A-] _ Vi
[Ali] - Vz
2/ Comp lète ',e tableau suivant:
_Mélanges
r',;
r
l"!
I/ Ili
l1
1'
1
' Vi)
1og t-
. Vz
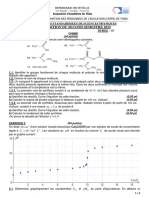
3/ 1 'raœr la courbe donnant le pH en fonction de log(~).
Eche.lJe: lem pour 0,1 unité d~ log; lem pour lpH
,J / admettant le résultat de la question 1 /, déduis de la courbe la relation qui existe entre le pH et log( [A-1)
F. 11
[AH]
5/ [ c1 ire l'équation bilan associée à la réaction entre l'acide AH et l'eau. En déduire la constante d'acidité Ka ctu
couple /\ H/ A- puis la relation liant le ·pH de la solution et le pKa de ce cou pie.
f,/ Déduire des questions précéde11t·es une valeur approchée du pKa de ce couple .
..,.. f,fon_tification du couple acide b2'Se:
JI rr~c iser les couples acide/bas,.:: du tableau que Fon peut éliminer à l'issue de l'étude précédente.
21 On a pesé 1,85 g d'acide AH pour réaliser 250ml. de solution S2 c\e concentration O, 1 rnol/L.
al Déterminer la masse molaire du composé AH.
b/ Identifier Je couple AH/ A- .
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Vous aimerez peut-être aussi
- Je me prépare aux examens du ministère en mathématiques: Es-tu prêt à passer le test ?D'EverandJe me prépare aux examens du ministère en mathématiques: Es-tu prêt à passer le test ?Évaluation : 4 sur 5 étoiles4/5 (1)
- Mati Kadri Enseignant de Sciences PhysiquesDocument68 pagesMati Kadri Enseignant de Sciences PhysiquesSoumana100% (2)
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- Fascicule Recueil D'exercices de Chimie Et de Physique Classe de Terminale C, D - Proposé Par Monsieur Cor Ndong, Professeur de Sciences PhysiquesDocument91 pagesFascicule Recueil D'exercices de Chimie Et de Physique Classe de Terminale C, D - Proposé Par Monsieur Cor Ndong, Professeur de Sciences PhysiquesSadia Orthniel100% (1)
- 1cm3jftoi 866968Document2 pages1cm3jftoi 866968bipPas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- Brochure de Chimie TSMDocument53 pagesBrochure de Chimie TSMOūs Mān BeretePas encore d'évaluation
- Travaux Diriges de Chimie Terminale C Et D Annee 2016/2017 AlcoolsDocument2 pagesTravaux Diriges de Chimie Terminale C Et D Annee 2016/2017 Alcoolspublicité en flopOfficielPas encore d'évaluation
- Ph-Solution Aqueuse-Autoprotolyse de L'eau-TsDocument2 pagesPh-Solution Aqueuse-Autoprotolyse de L'eau-TsSeydina WadePas encore d'évaluation
- Acide CarboxyDocument2 pagesAcide CarboxyMamane Issa Tahirou0% (1)
- Série D'exercices - Physique Chimie - 1ère As MR YoussefDocument2 pagesSérie D'exercices - Physique Chimie - 1ère As MR YoussefMed Brini100% (1)
- COMPOSITION HARMO SCPH 1S1 2019 - Wahabdiop-1Document3 pagesCOMPOSITION HARMO SCPH 1S1 2019 - Wahabdiop-1el hadji malick DioumPas encore d'évaluation
- Fascicule - PC - Tle DDocument40 pagesFascicule - PC - Tle DSteven OuedraogoPas encore d'évaluation
- Cahier de ChimieDocument40 pagesCahier de ChimieAzazia100% (3)
- C1.Les Alcools - TS2.2021 PDFDocument2 pagesC1.Les Alcools - TS2.2021 PDFMouhamadou Tidiane Seck100% (3)
- Epreuve Comp TS2 Sem2 2022Document4 pagesEpreuve Comp TS2 Sem2 2022Mamadou KanePas encore d'évaluation
- BAC - PC S2-Fascicule BCM-1Document92 pagesBAC - PC S2-Fascicule BCM-1Idrissa Sankhare100% (2)
- Correction Epreuve Devoir Departemental Sciences Physiques TS2Document6 pagesCorrection Epreuve Devoir Departemental Sciences Physiques TS2Mame cheikh DiopPas encore d'évaluation
- D1 1S2 2022 LSLL - WahabdiopDocument2 pagesD1 1S2 2022 LSLL - WahabdiopThiouto Sow100% (1)
- DEVOIR Phy-Chimie TLE DDocument2 pagesDEVOIR Phy-Chimie TLE DNguettia Yao jean Daniel Adou60% (5)
- 1S PhysiqueDocument12 pages1S PhysiquePFEPas encore d'évaluation
- Serie 5 Et 6 Solution Aqueuse Acide Fort Base ForteDocument7 pagesSerie 5 Et 6 Solution Aqueuse Acide Fort Base ForteCheujeu chaldouPas encore d'évaluation
- Serie AlcoolDocument5 pagesSerie AlcoolPFE100% (2)
- Alcool Amine Acide CarboxDocument5 pagesAlcool Amine Acide CarboxEssohanam AwatePas encore d'évaluation
- Travail Et PuissanceDocument7 pagesTravail Et Puissanceamath ndiayePas encore d'évaluation
- 22 BACblanc PHYSCHIMIE TD DrenDabouDocument4 pages22 BACblanc PHYSCHIMIE TD DrenDabouFétigué Ouatt100% (1)
- Serie 1 Chimie Renf T°s1 S2Document4 pagesSerie 1 Chimie Renf T°s1 S2bip100% (1)
- Application D BasesDocument16 pagesApplication D BasesBabacarDiagoPas encore d'évaluation
- Série D'exercices - Chimie PH Des Solutions AqueusesDocument4 pagesSérie D'exercices - Chimie PH Des Solutions AqueusesBaccari100% (2)
- TD Amine AcidesCarboxyliques 2020 LSLL - Wahab DDocument4 pagesTD Amine AcidesCarboxyliques 2020 LSLL - Wahab DOumou Khaïry Diop100% (1)
- Cahier de PhysiqueDocument59 pagesCahier de PhysiqueAzazia100% (4)
- Devoir II 1ere s1 Ltye 2017 2018Document2 pagesDevoir II 1ere s1 Ltye 2017 2018Mamadou saliou Ba100% (4)
- CompositionDocument2 pagesCompositionGus ِPas encore d'évaluation
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoPas encore d'évaluation
- TD Solutions Aqueuses - Acide Fort Base Forte PH 2016Document6 pagesTD Solutions Aqueuses - Acide Fort Base Forte PH 2016Oumar Traoré100% (2)
- Acide CarboxyliqueDocument7 pagesAcide CarboxyliqueBabacarDiagoPas encore d'évaluation
- TD Mouvements2020lsll - Wahab Diop 0001Document4 pagesTD Mouvements2020lsll - Wahab Diop 0001Ibrahima DiopPas encore d'évaluation
- Série D'exercice 3S ALcools 2018Document3 pagesSérie D'exercice 3S ALcools 2018Ghada Daddou100% (4)
- Niass PCDocument48 pagesNiass PCndiayePas encore d'évaluation
- Devoir Surveille N°1 1ere D Et TD 2022-2023Document4 pagesDevoir Surveille N°1 1ere D Et TD 2022-2023YVESPas encore d'évaluation
- D4 1S2 2019 LSLL Wahabdiop PDFDocument2 pagesD4 1S2 2019 LSLL Wahabdiop PDFAminata100% (2)
- PC 1ere CD-C4 Le BenzeneDocument9 pagesPC 1ere CD-C4 Le BenzeneSanéPas encore d'évaluation
- Serie 01 Les Alcenes Et Alcynes-1Document2 pagesSerie 01 Les Alcenes Et Alcynes-1Cheikhna Mohamed100% (1)
- ProjectileDocument6 pagesProjectileOumar Traoré50% (2)
- AttachmentDocument155 pagesAttachmentFabrice KontchouPas encore d'évaluation
- Fascicule Premiere SDocument53 pagesFascicule Premiere SMamadou saliou BaPas encore d'évaluation
- Correction TDDocument5 pagesCorrection TDBasmã AlilechePas encore d'évaluation
- Top Exos PhysiqueDocument33 pagesTop Exos PhysiqueDavid KientegaPas encore d'évaluation
- Serie 1 2 3 Les Alcools Les Amines Et Les Acides Carboxyliques T°sDocument15 pagesSerie 1 2 3 Les Alcools Les Amines Et Les Acides Carboxyliques T°smor seck100% (5)
- D2 1S2 2015 LSLL Sujet WahabdiopDocument1 pageD2 1S2 2015 LSLL Sujet WahabdiopFy Ezahana100% (2)
- TD Alcanes 2017 LSLL WahabdiopDocument2 pagesTD Alcanes 2017 LSLL Wahabdiophamd kabore100% (1)
- Chimie OrganiqueDocument1 pageChimie OrganiquePFEPas encore d'évaluation
- Fascicule Chimie Ts 2018Document43 pagesFascicule Chimie Ts 2018Sylvestre Christ100% (1)
- CO1 TS1 2016 Lolb Wahabdiop-1Document4 pagesCO1 TS1 2016 Lolb Wahabdiop-1Med Brini0% (1)
- Acide CarboxiliqueDocument3 pagesAcide CarboxiliquePFE100% (3)
- Dev 1 2S - Lmba - Lbyk PDFDocument1 pageDev 1 2S - Lmba - Lbyk PDFAhmadou NiassPas encore d'évaluation
- c2s - Generalites Sur Les Solutions AqueusesDocument7 pagesc2s - Generalites Sur Les Solutions Aqueusesacademie archimede100% (1)
- Fiche N°2-PhyqDocument3 pagesFiche N°2-Phyqabdalhaqq100% (1)
- PC Tle DDocument56 pagesPC Tle DBoukaré SawadogoPas encore d'évaluation
- Calcul Poteau Poutre - l'ELU Et ELSDocument8 pagesCalcul Poteau Poutre - l'ELU Et ELSAmbroise KOLOMAPas encore d'évaluation
- Dqe Eamau 15 03 2019 DefinitifDocument9 pagesDqe Eamau 15 03 2019 DefinitifAmbroise KOLOMAPas encore d'évaluation
- Devinettes D Afrique PDPDocument2 pagesDevinettes D Afrique PDPAmbroise KOLOMAPas encore d'évaluation
- Deco-Ic CVDocument2 pagesDeco-Ic CVAmbroise KOLOMAPas encore d'évaluation
- Synthèse Sur MTD de SoudureDocument4 pagesSynthèse Sur MTD de Soudurehaouache khPas encore d'évaluation
- Thermistance - WikipédiaDocument18 pagesThermistance - WikipédiaFétigué OuattPas encore d'évaluation
- Rapportdestage Rodrigue Kabange L2Document11 pagesRapportdestage Rodrigue Kabange L2gloire kabangePas encore d'évaluation
- CH 4 Maintenance Des LubrifiantsDocument8 pagesCH 4 Maintenance Des Lubrifiantsasma sallemPas encore d'évaluation
- RESUMEN EIE1 - Memoire - v3 - Descriptioin Du ProjectDocument10 pagesRESUMEN EIE1 - Memoire - v3 - Descriptioin Du ProjectMohammed LounisPas encore d'évaluation
- TP Operation UnitaireDocument9 pagesTP Operation UnitaireBòû ChŔâ ÑePas encore d'évaluation
- DTU 40 45 Edition 2002 1Document92 pagesDTU 40 45 Edition 2002 1CHANZYPas encore d'évaluation
- 615-Formation IWT (Part 4c)Document19 pages615-Formation IWT (Part 4c)Chokri AtefPas encore d'évaluation
- Purepox SOLVA-FIX-PLITDocument1 pagePurepox SOLVA-FIX-PLITHASSANE SAHNOUNPas encore d'évaluation
- TP RDM 2Document4 pagesTP RDM 2Nasro DjePas encore d'évaluation
- DevoirDocument1 pageDevoirRabab TamouhPas encore d'évaluation
- NASSER Djibo Souley Abdoul PDFDocument94 pagesNASSER Djibo Souley Abdoul PDFOmar100% (1)
- Definition en ChimieDocument2 pagesDefinition en ChimieIdrissa SankharePas encore d'évaluation
- Dosage BetonDocument3 pagesDosage Betonchristian54Pas encore d'évaluation
- Carnet Soudeur PDFDocument41 pagesCarnet Soudeur PDFrac mediaPas encore d'évaluation
- TP Separation de Lacide Benzoique Et Du 1 NaphtolDocument8 pagesTP Separation de Lacide Benzoique Et Du 1 NaphtolJojo BoubPas encore d'évaluation
- Afin de Protéger Le Soudeur Et Éviter QuDocument3 pagesAfin de Protéger Le Soudeur Et Éviter QubarhoumsrasraPas encore d'évaluation
- Tampons 2eme PartieDocument14 pagesTampons 2eme PartieELYES CHOUCHENEPas encore d'évaluation
- MécaniqueComposites Chapitre 10-DéverrouilléDocument9 pagesMécaniqueComposites Chapitre 10-DéverrouilléSeniora AnnaPas encore d'évaluation
- Expose Audrey Et Clara DiffuserDocument4 pagesExpose Audrey Et Clara Diffuser7000dyvezahxoPas encore d'évaluation
- Doctorat BelhouchetDocument184 pagesDoctorat Belhouchetfootball goalPas encore d'évaluation
- M1165 PDFDocument12 pagesM1165 PDFMohamedPas encore d'évaluation
- 04 - FDS Emulsions de Bitume ModifiéDocument15 pages04 - FDS Emulsions de Bitume ModifiéarbiPas encore d'évaluation
- La Protection Cathodique: Examen de TP CM11Document13 pagesLa Protection Cathodique: Examen de TP CM11Justin LhommePas encore d'évaluation
- Ch3 - Matériaux DiélectriquesDocument23 pagesCh3 - Matériaux DiélectriquesMãl Îk100% (2)
- TotalSourceCatalog BatteryDocument43 pagesTotalSourceCatalog BatteryPedro LopezPas encore d'évaluation
- HD Catalogue FRDocument21 pagesHD Catalogue FRousmanePas encore d'évaluation
- B4 Fixations-en-acier-inoxydable-ISO-3506Document3 pagesB4 Fixations-en-acier-inoxydable-ISO-3506lecaudeydidierPas encore d'évaluation
- Bio-TP Seal®: Un Matériau Et Une IngénierieDocument16 pagesBio-TP Seal®: Un Matériau Et Une IngénierieMohamed MohamedPas encore d'évaluation
- Chapitre 4-Transitions de Phases Dun Corps PurDocument24 pagesChapitre 4-Transitions de Phases Dun Corps PurbfbrfvlfrerPas encore d'évaluation