Académique Documents
Professionnel Documents
Culture Documents
QCM - Medecine ChimieMr SABOUR 2023
Transféré par
SABOUR MOHAMMEDTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
QCM - Medecine ChimieMr SABOUR 2023
Transféré par
SABOUR MOHAMMEDDroits d'auteur :
Formats disponibles
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 1:SUIVI TEMPOREL D’UNE TRANSFORMATION CHIMIQUE (2022)
On verse dans un volume V = 2.10−4 m3 d’une solu-
tion SB d’hydroxyde de sodium de concentration CB =
10mol.m−3 et on y ajoute a` l’instant t = 0s une quantité
égal nE de méthanoate de méthyle. On suppose que le
volume reste inchangé (V = 2.10−4 m3 ). on modélise la
UR
on
réaction qui se produit par l’équation chimique :
–
HCO2 CH3(l) + HO(aq) −−→ HCO2 – (aq) + CH3 OH(l)
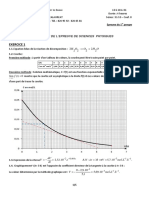
La courbe de la figure ci-contre, représente les variations
de la conductivité σ en fonction du temps. l’expression
BO
de la conductivité est σ = 0, 25 − 72x en (S.m−1 )
néglige l’effet de H3 O+ sur la conductivité du mélange et 75÷ 52=
= 1, 44 conductivit´e molaire ionique
λi des ions pr´esents dans le mélange
ion Na+ HO – HCO2 –
SA
λenmS.m2 .mol−1 5, 01 19, 9 5, 46
1. La valeur de l’avancement maximal est :
A: xM = 2.10−4 mol B: xM = 2.10−3 mol
C: xM = 1.10−4 mol D: xM = 1.10−3 mol E: xM = 3.10−3 mol
2. la valeur du temps de demi-réaction est :
Mr
A: t1/2 = 36min B: t1/2 = 32min C: t1/2 = 20min D:t1/2 = 12min E: t1/2 = 10min
3. L’expression de la vitesse volumique de la réaction est :
1 dσ 1 dσ
A: v = − 72V . B: v = − 36V .
dt dt
1 dσ 1 dσ 1 dσ
C: v = − V . D: v = − 32V . E: v = − 42V .
DE
dt dt dt
4. la valeur de la vitesse volumique à la datet = 0s est :
A: v = 1, 23mol.m−3 .min−1 B:v = 0, 82mol.m−3 .min−1
C:v = 1, 05mol.m−3 .min−1 D: v = 0, 52mol.m−3 .min−1 E: v = 0, 32mol.m−3 .min−1
EXERCICE 2: SOLUTION AQUEUSE D’ACIDE ETHANOÏQUE
S
une solution aqueuse S d’acide éthanoı̈que de concentration molaire C = 1.10−3 mol.L−1 a une
E
conductivité σ = 5, 2ms.m−1
Données : on néglige l’effet de [HO− ] et 52 ÷ 391 = 0, 133. 10 0,63 =4,26
CH
ion H3 O+ CH3 CO2 –
2 −1
λ(mS.m .mol ) 35, 0 4, 1
1. La valeur de la concentration effective [H3 O+ ] en mol.L−1 dans la solution est :
FI
A: 1, 33.10−3 B: 1, 33.10−2 C:1, 33.10−6 D: 1, 33.10−4 E: 1, 33.10−5
2. On dilue la solution 10fois pour obtenir une solution (S1 ) de pH = 4, 37 le taux d’avancement
dans la solution (S1 ) est :
A: τ = 0, 133 B: τ = 0, 0, 42 C: τ = 0, 260 D: τ = 0, 013 E: τ = 0, 426
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 1
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 3 : SOLUTION AQUEUSE D’ACIDE METHAOÏQUE
Soit une solution aqueuse d’acide méthanoı̈que HCOOH de concentration C, on note kA la constante
d’acidité du couples (HCOOH/HCOO – )
1. le taux d’avancement final lors de la réaction de HCOOH avec l’eau a pour expression :
UR
1 1
A: τ = B: τ =
1 + 10 pH−pk A 1 − 10pkA −pH
1 1 1
C: τ = pk −pH
D: τ = −(pk
E:τ =
1 + 10 A 1 + 10 A + pH) 1 + 10pkA +pH
BO
2. l’expression de la concentration C est :
A: 10−pH + 10pkA +2pH B: 10−pH + 10pkA −2pH
C: 10−pkA + 10−2pH D: 10−pH + 102pH+pkA E: 10−2pH + 10pkA −pH
SA
EXERCICE 4 : RÉACTION ENTRE L’ACIDE ETHANOÏQUE ET L’AMMONIAC
On réalise un mélange équimolaire d’acide éthanoı̈que CH3 COOH et d’ammoniac NH3 de quantité
commune ni . L’équation modélisant la réaction qui a leiu est :
CH3 COOH + N H3 ⇌ CH3 COO− + N H4+ (1)
Mr
on donne : pkA (CH3 COOH/CH3 CO− ) = pkA1 et pkA (NH4 + /NH3 = pkA2 ) .
1. L’expression de la constante de le réaction étudiée est:
A: k = 10pkA2 +pkA1 B: k = 10pkA1 −pkA2
kA2
C: k = D: k = kA1 × kA2 E: k = 10pkA2 −pkA1
kA1
DE
2. L’expression de l’avancement final de cette réaction est :
√ √
ni . k ni (1 + k
A: xf = √ B: xf = √
1 +√K K√ √
ni . k (1 + k) k
C: xf = √ D:xf = √ E: xf = √
1− K ni . K ni (1 + K)
S
EXERCICE 5 :CRITÈRE D’ÉVOLUTION D’UN SYSTÈME CHIMIQUE
HE
on considère un système chimique obtenu en mélangeant:
V1 = 15mL d’une solution d’acide borique H3 BO3 de concentration C1 = 1, 10.10−2 mol.L−1
V2 = 15mL d’une solution de borate de sodium (Na+
C
–
aq + H2 BO3 aq ) de concentration C2 =
−2 −1
1, 20.10 mol.L
FI
V3 = 10mL d’une solution de methylamine CH3 NH2 de concentration C3 = 2, 00.10−2 mol.L−1
V4 = 10mL d’une solution de chlorure de méthylammonium (CH3 NH3 + aq + Claq
–
) de concen-
tration C4 = 1, 50.10−2 mol.L−1
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 2
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 5 :CRITÈRE D’ÉVOLUTION D’UN SYSTÈME CHIMIQUE
L’équation de la réaction modélisant la transformation qui se produit est:
H3 BO3 + CH3 N H2 ⇌ H2 BO3− + CH3 N H3+ (2)
données : pkA (H3 BO3 / H2 BO3 – ) – pkA1 – 9, 20 et pkA (HCH3 NH3 + /CH3 NH2 ) – pkA2 – 10, 7
UR
√ 725
10 = 3, 16 , log( 2775 ) = −0, 58 et log( 3075
375
) = 0, 9
1. La valeur du quotient de la réaction à l’état initial est:
A: Qr,i = 0, 918 B: Qr,i = 1, 22 C: Qr,i = 1, 318 D: Qr,i = 0, 818 E: Qr,i = 1
BO
2. L’avancement final de la réaction est xf = 1, 275.10−4 mol. Le pH du mélange est:
A: pH = 10, 1 B: pH = 11, 1 C: pH = 9, 95 D: pH = 8, 1 E: pH = 5, 1
SA
EXERCICE 6 : PILE CADMIUM/ARGENT
On réalise une pile (Cadmmium/Argent) en utilisant
une lame d’argent Ag plongée dans une solution de nitrate d’argent (Ag+ + NO3 – ) de concen-
tration C1 = 0, 4mol.L−1 de volume V = 250mL Mr
une lame de cadmium Cd plongée dans une solution de nitrate de cadmium (Cd2+ + 2 NO3 – )
de concentration C2 = 0, 2mol.L−1 de même de volume V = 250mL.
Les deux solutions sont reliées par un pont salin.
On branche entre les deux électrodes un conducteur ohmique en série avec un ampèremètre
et un interrupteur ouvert. à t = 0s on ferme l’interrupteur un courant constant d’intensité I
circule dans le circuit.
DE
données : M (Ag) = 108g/mol , la valeur de la constante associée à l’équation chimique :
2 Ag+ + Cd ↽ −− 2+
− 2 Ag + Cd est k = 5.1040 à 25◦ C. La quantité de matière immergée de de
−⇀
l’électrode consommable est en excès et F est la constante de faraday
1. L’expression de l’avancement de la réaction lors de la réaction lors du fonctionnement de la
pile à un instant t est:
S
F 2F F I It It
A: x = B: x = x= C: x = D:x = E: x =
It It It Ft F 2F
HE
2. A l’instant t1 on a [Ag + ] = 8.10−2 mol.L−1 et [Cd2+ = 0, 36mol.L−1 , la valeur du quotient de
réaction est :
A: Qr = 1, 25 B: Qr = 45, 6 C: Qr = 56, 2 D: Qr = 4, 56 E: Qr = 5, 62
C
3. La valeur de la masse déposer sur l’électrode d’argent lorsque la pile sera usée m(Ag) est :
FI
A: m(Ag) = 5, 398g B: m(Ag) = 1, 078mg
C: m(Ag) = 1, 078g D: m(Ag) = 10, 787mg E: m(Ag) = 10, 787g
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 3
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 7 :CONTR ÔLE D’ÉVOLUTION D’UN SYSTEME CHIMIQUE
On réalise un mélange équimolaire n0 = 0, 12mol d’un acide A et d’un alcool B. on ajoute quelque
goutes d’acide sulfurique et quelques grains de pierre ponce le dispositif expérimental utilisé est
représenté sur la figure d’en bas . A la fin de la transformation on obtient mE = 12, 64gd’un ester
E. Données : 79 ÷ 39 = 2.
UR
BO
SA
1. le dispositif utilisé pour préparer cet ester s’appelle :
A: Montage de distillation fractionnée B: Montage du chauffage à reflux
C:Montage d’hydrodistillation D: Montage d’extraction par solvant
E: Montage de chauffage sous vide
2. L’acide A utilisé est:
Mr
A:L’ acide butanoı̈que B:L’ acide 3-methylbutanoı̈que
C: L’acide pentanoique D: acide propanoique E:L’ acide 2-methyl butanoique
3. La valeur de la constante d’équilibre associée à cette réaction est
A: K = 3, 85 B: K = 4, 5 C: K = 4, 2 D: K = 3, 8 E: K = 4
DE
4. La valeur du rendement de la réaction est
A: 65% B: 69% C: 67% D: 64% E: 68%
5. Lors de la synthèse industriel de l’ester (E) on préfère utiliser un autre réactif (D) à la place
de (A), pour que la réaction soir rapide et totale la formule semi-développée du réactif (D)
est:
ES
CH
FI
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 4
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
Université Internationale Abulcasis des Sciences de la Santé 2022
Cocher la ou les bonnes réponses exactes sur la ou les cases correspondantes de la
grille. L’usage de tout dispositif électronique est strictement interdit
EXERCICE 8 : (UIASS 2022) ETUDE D’UNE SOLUTION AQUEUSE D’ACIDE
BENZOÏQUE
UR
On prépare une solution (SA ) d’acide benzoı̈que C6 H5 COOH de concentration CA et on mesure son
pH Données kA (C6 H5 COOH/C6 H5 COO – ) – KA ), log3, 15 = 0, 5 et log6, 3 = 0, 8.
BO
1. L’expression de la constante d’équilibre K associée à la réaction de C6 H5 COOH avec l’eau en
fonction du tau d’avancement final τ et de la concentration CA est:
τ τ2 CA τ 2 CA τ
A: K = B: K = C: K = D: K =
CA (1 − τ ) CA (1 − τ ) 1−τ 1−τ
SA
2. la concentration CA vérifie la relation :
A: 10−pkA (10−pH + 1) B:102−pkA (10−pH − 10−pKA )
C:10−ph (10−pH + 10−pKA ) D: 10−pH (10pKA −pH + 1)
A l’aide des mesure des pH des solutions aqueuses d’acide
benzoı̈que de concentrations différentes C on détermine le tau
Mr
d’avancement final τ dans chaque solution .
τ2
la courbe ci-contre représente les variation de en fonction
1τ
1
de .
C
DE
3. La valeur de la constante d’équilibre K est :
A: 3, 15.10−3 B: 6, 3.10−4 C: 6, 3.10−5 D: 3, 15.10−5
4. La valeur du pKA (C6 H5 COOH/C6 H5 COO− ) est :
A: 3, 8 B: 4, 2 C: 9, 2 D: 4, 8
ES
CH
FI
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 5
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE T9 :(UIASS) LA PILE
ealise la pile Argent-Nickel
ARGENT-NICKELOn r´ formée des couples : Ag+ /Ag et Ni2+ /Ni. l’équation bilan de la
réaction du fonctionnement de cette pile est :2 Ag+ + Ni −−→ 2 Ag + Ni2+ La pile débite un courant
électrique d’intensité I = 10mA pendant une durée ∆t = 50min. On donne : la constante de
faraday F = 9, 65.104 C.mol−1 et 3 × 108 = 1, 68 × 193.
UR
1. Lors du fonctionnement de cette pils :
A: il y a oxydation du nickel à la cathode
B: il y a réduction des ions nickel Ni2+ à l’anode
BO
C: L’électrode d’argent est le pôle positif de la pile
D: le courant électrique circule , à l’intérieur de la pile de l’électrode du N i vers celle de Ag
2. le schéma conventionnel de cette pile est :
SA
A: ( – )Ni/Ni2+ //Ag+ /Ag ( +) B: ( +)Ag/Ag+ //Ni2+ / Ni( – )
C: ( – )Ag/Ag+ //Ni2+ / Ni ( +) D: ( – )Ni/Ni2+ //Ag/Ag+ ( +)
3. Après la durée de focntionnement ∆t l’expression de ol’avancement x = est :
F × ∆t I × ∆t 2I × ∆t I × ∆t
A:x = B: x = C: x = D:x =
2I F F 2F
Mr
4. La variation de la masse d’argent, pendant la durée ∆t est :
A: ∆m(Ag) = 16, 8mg B: ∆m(Ag) = −16, 8mg
C: ∆m(Ag) = −33, 6mg D: ∆m(Ag) = 33, 6mg
DE
EXERCICE 10 : (UIASS) ÉTUDE D’UNE SOLUTION AQUEUSE D’AMMONIAC
On dispose d’une solution commerciale (SD ) d’ammoniac NH3 de concentration molaire CD contenue
dans un détergent.On prend un volume de ce détergent et on le dilue 100 fois, on obtient ainsi une
solution (SB ) de pH = 10, 6.
On dose un volume VB = 20mL de la solution (SB ) par une solution aqueuse (SA ) d’acide chlorhy-
drique (H3 O+ + Cl – ) de concentration CA = 2.10−2 mol.L−1 . Le volume versé à l’équiavalence est
S
VE = 10mL. Données: Ke est le produit ionique de l’eau pKe = 14; 100,6 = 4.
HE
1. La valeur de la concentration molaire CD est :
A: CD = 1mol.L−1 B: CD = 10−2 mol.L−1 C: CD = 10−4 mol.L−1 D: CD = 10mmol.L−1
2. Le pourcentage des molécules d’ammoniac NH3 dans la solution (SB ) est :
C
A:N = 4% B: 96% C: 5.10−5 % D:100%
FI
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 6
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 11: (UIASS 2022)ÉTUDE D’UNE RÉACTION ESTÉRIFICATION
Pour synthétiser l’éthanoate d’éthyle, un technicien de
laboratoire a préparé une série de tubes à essai contenant
chacun n0 = 60mmol d’alcool pur et n0 = 60mmol
d’acide pur. Après avoir scellé les tubes, le techniciens
UR
les a placés simultanément dans un bain marie régulé à
100◦ C à la date t = 0s. l’équation de la réaction qui a
lieu dans chaque tube:
C2 H4 O2(l) + C2 H5 OH(l) −
↽−
BO
−⇀
− C4 H6 O2(l) + H2 O(l)
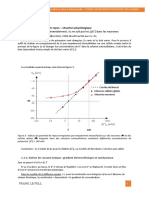
la courbe de la figure ci-contre représente l’évolution de
la quantité de matière nAC d’acide restante dans chaque
tube en fonction du temps.
SA
1. La constante d’équilibre K associée à cette réaction est :
A: K = 10 B: K = 4 C: K = 0, 1 D:K = 0, 25
2. La valeur du rendement r de cette réaction est:
A: r = 75% B:r = 50% C: r = 33% D:r = 67%
Mr
3. Parmi les moyens utilisés pour augmenter le rendement de la réaction
A: utiliser un montage de chauffage à reflux
B: utiliser un montage de distillation qui extrait l’ester au fur et à mesure
que la réaction progresse
C: Utiliser un anhydride d’acide au lieu de l’acide correspondant
D:Introduire l’un des réactifs en excès
DE
4. La valeur du temps de demi-réaction t1/2 de la réaction étudiée est :
A: 8h B:4h C: 240min D:480min
5. Au cours de la réaction d’estérification
A: La quantité de ma tière finale de l’ester formé diminue en éliminant l’eau
S
B: La valeur du temps de réaction diminu si on utulise un catalyseur
C: La valeur du quotient de réaction augmente au cours du temps
D:La vitesse de la réaction diminue au cours de l’évolution temporelle du système
E
CH
FI
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 7
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 12: ENSA (2022)
1. Quel est le nom de la mol´ecule suivante
A: 1 − methyl1 − methylethanol
B: 2 − methylbutane − 2 − ol
C: 2 − hydroxy2 − methylbutane
UR
D: 1, 1 − dimethylpropane − 1 − ol
à fin d’étudier une électrodéposition du cuivre sur une
bague métallique, on réalise l’expérience suivante. La
bague plongé dans une solution contenant des ions Cu2 +
BO
est reliée à la cathode l’anode est en cuivre. la bague
et l’électrode de cuivre sont reliés à un générateur qui
débite un courant I = 400mA pendant 1h.
On donne: La constante de Faraday F = 96500C.mol−1
SA
et M (Cu) = 63, 5g.mol−1 .
2. La quantité de matière d’électrons qui a circulé dans le circuit est proche de
A:1, 5.10−2 mol B: 3, 1.10−2 mol C: 4, 5.10−2 mol D:6, 0.10−2 mol
3. La masse du cuivre déposée sur la bague pendant la même durée est proche de :
Mr
A:940mg B:440mg C: 460mg D:470mg
4. On mélange dans un becher deux solutions d’acide chlorhydriques (S1 ) et (S2 de pH différents.
100mL de (S1 ) de pH1 = 3 et 400mL de (S2 ) de pH = 4 . Dans ce mélange la concentration
finale de l’ion H3 O+ est:
A:[H3 O+ ] = 2, 8.10−3 mol.L−1 B:[H3 O+ ] = 2, 8.10−4 mol.L−1
DE
C: [H3 O+ ] = 8, 2.10−3 mol.L−1 D:[H3 O+ ] = 8, 2.10−4 mol.L−1
5. On donne li bilan d’électrolyse d’une solution très concentrée de chlorure de sodium :
2 Na(aq) + + 2 Cl(aq)
– –
+ 2 H2 O(l) −−→ Cl2(gaz) + H2(gaz) + 2 HO(aq) + 2 Na(aq) +
ES
une cellule industrielle fonctionne sous une tension U = 3, 8V avec une intensité I = 4, 5.104 A
Données : couples mis en jeu Cl2 /Cl – et H2 O/H2 ; volume molaire VM = 30L.mol−1 et la
constante de faraday F = 96500C.mol−1 . déterminer les volume de dichlore et de dihydrogène
produits pendant un jour et qui ont une même valeur, plus proche de : cocher la bonne réponse
CH
A: 400m3 B:450m3 C: 500m3 D:600m3
FI
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 8
Mr SABOUR CHIMIE EN MÉDECINE-ENSA BACHELIERS ET BAC+1
EXERCICE 13: ENSA (2021)
1. Le dosage de 20mL d’une solution d’hydroxyde de potassium KOH n´ecessite 16mL d’une
solution, d’(acide chlorhydrique à 10− 1mol.L−1 . On donne M (KOH) = 56g.mol−1 . la masse
d’hydroxyde potassium solide dissoute pour préparer 250mL de la solution basique vaut :
A: 1, 12g B:1, 12mg C: 11, 2g D:11, 2mg
UR
2. En faisant réagir un corps A et d’éthanol On a obtenu , par réaction, totale et rapide , du
propanoate d’éthyle .Le corps A est
A: l’acide propanoı̈que B:le chlorure d’éthanoyle
BO
C: l’acide étanoı̈que D:Le chlorure de propanoyle
On considère la pile : (-) Ni/Ni2+ ||Ag+ / Ag (+)
En fonctionnement la pile débite un courant électrique d’intensité I durant 1h.
SA
Les données: F = 96500C.mol−1 et m(Ag) = 108g.mol−1 .
3. Sachant que la valeur de l’avancement de la réaction au bout d’1h de fonctionnement est
18.10−5 mol , La valeur de l’intensité du courant est alors proche de :
A: 9, 00mA B:9, 50mA C: 10, 00mA D:10, 50mA
4. La variation de la masse de l’électrode d’argent est proche de :
Mr
A: 15mg B:17mg C: 19mg D:21mg
5. soit un volume V = 200mL d’une solution aqueuse d’acide éthanoı̈que CH3 COOH de concen-
tration C = 3.10−2 mol.L−1, son pH à 25◦ C vaut pH = 3, 4 ( 10−3,4 = 4.10−4 ) il y a eu une
réaction acido-basique entre les couples CH3 COOH / CH3 COO – et H3 O+ / H2 O
le nombre de mol en CH3 COOH restant à la fonc de la réaction est :
DE
A: 5, 92.10−3 B:9, 60.10−4 C: 8, 6.10−3 D:5, 13.10−3
EXERCICE 14: ENSA(2019)
On r´ealise une pile avec les couples Au3+ /Au et Cu2+ /Cu.
[cu2+ ]i et [Au3+ ]i sont les concentration initiales des ions. un ampèremètre montre le passage du
S
courant de la demi-pile d’or vers la demi-pile de cuivre.
HE
1. Choisir la proposition correcte :
A: Les électrons circulent de la demi-pile de cuivre vers la demi-pile à l’or.
B: Il y a réduction sur l’électrode de cuivre
C: Dans la pile les cations vont de la demi-pile à l’or vers la demi-pile de cuivre
C
D:La cathode est l’électrode de cuivre
2. Le quotient de la réaction à l’état initial s’exprime par :
FI
[cu2+ ]i 3 [cu2+ ]i 2 [cu2+ ]i [Au3+ ]i 2
A: Qi = B:Qi = C: Qi = D:Qi =
[Au3+ ]i 2 [Au3+ ]i 3 [Au3+ ]i [Cu2+ ]i 3
fiches de Mr SABOUR pour futures médecins et ingénieurs Page 9
Vous aimerez peut-être aussi
- 2008 Polynesie Exo1 Correction Acides 7ptsDocument3 pages2008 Polynesie Exo1 Correction Acides 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- Epreuve Du 1: Corrige de L'Epreuve de Sciences PhysiquesDocument8 pagesEpreuve Du 1: Corrige de L'Epreuve de Sciences PhysiqueslionelPas encore d'évaluation
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- Correction de DSN2 Bac 2020..Document3 pagesCorrection de DSN2 Bac 2020..dahnenanisPas encore d'évaluation
- TD Chimie Analytique 2 AnneeDocument11 pagesTD Chimie Analytique 2 AnneeMeryem ZouarhiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeDocument9 pagesExamen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeMohamed SaidiPas encore d'évaluation
- 2005 Antilles Sujet Exo2 Ka 6 5ptsDocument3 pages2005 Antilles Sujet Exo2 Ka 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Corrige Bac Normale Physique Chimie PC FrancaisDocument4 pagesCorrige Bac Normale Physique Chimie PC FrancaiselmehdiPas encore d'évaluation
- C3Chim - Transformations - Limitees - Exercices - Sabatier PDFDocument5 pagesC3Chim - Transformations - Limitees - Exercices - Sabatier PDFAzizElheni0% (1)
- Série 1 - Équilibre ChimiqueDocument6 pagesSérie 1 - Équilibre ChimiqueMed RT100% (1)
- Titres de L'eauDocument10 pagesTitres de L'eauعمر الفاروق صانع حضارةPas encore d'évaluation
- TP D'éléctrochimieDocument7 pagesTP D'éléctrochimieHanou BouPas encore d'évaluation
- TD 4 Avec Corrigé de Chimie Des SolutionsDocument7 pagesTD 4 Avec Corrigé de Chimie Des SolutionsETUSUP100% (1)
- Correction Examen NationaleDocument10 pagesCorrection Examen NationaleYanrique RPas encore d'évaluation
- Killian - 2022 - Tp1Document9 pagesKillian - 2022 - Tp1amandine gaianiPas encore d'évaluation
- Transformatios Dans Les 2 SensDocument2 pagesTransformatios Dans Les 2 Sensyassineria276Pas encore d'évaluation
- 8 PHDocument7 pages8 PHAzumi ChanPas encore d'évaluation
- Cinetique Chimique M.ndoye LdaDocument6 pagesCinetique Chimique M.ndoye LdaHamidou DiattaPas encore d'évaluation
- 4-Corrige Bac Blanc SP s2Document6 pages4-Corrige Bac Blanc SP s2el hadji thierno dioumPas encore d'évaluation
- 04 PH Tau CorrectionDocument4 pages04 PH Tau CorrectionChartier JulienPas encore d'évaluation
- Marolet MaDocument5 pagesMarolet MamedsalemeddahPas encore d'évaluation
- Conductimetrie Ex4Document3 pagesConductimetrie Ex4Gueye OusmanePas encore d'évaluation
- PC C2017 CorDocument10 pagesPC C2017 Corrktm.avotraPas encore d'évaluation
- Exos21 Acides BasesDocument4 pagesExos21 Acides BasesSohaib LaminePas encore d'évaluation
- Exercices Transformations Acide BaseDocument4 pagesExercices Transformations Acide BaseNaouma ChahdPas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFSaifeddine MakniPas encore d'évaluation
- Exercices 2Transformations Liées à Des Réactions Acido – Basiques Dans Une Solution AqueuseDocument1 pageExercices 2Transformations Liées à Des Réactions Acido – Basiques Dans Une Solution Aqueuselabiadsihame73Pas encore d'évaluation
- SDM 1Document3 pagesSDM 1la physique selon le programme FrançaisPas encore d'évaluation
- Exercice Chimie 02Document3 pagesExercice Chimie 02matmatijamelPas encore d'évaluation
- Corrigé Serie D 2021Document7 pagesCorrigé Serie D 2021ChristellePas encore d'évaluation
- Série 1 - équilibre Chimique (WWW - Pc1.ma)Document6 pagesSérie 1 - équilibre Chimique (WWW - Pc1.ma)b01554837Pas encore d'évaluation
- 2007 USA Exo1 Correction Azote 6 5ptsDocument4 pages2007 USA Exo1 Correction Azote 6 5ptsmyriamdibbPas encore d'évaluation
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Correction DcoDocument3 pagesCorrection DcomohmedPas encore d'évaluation
- C4 Correction Exercices AciditeDocument5 pagesC4 Correction Exercices AciditeAndrés Tobías Mba MICHA ALENEPas encore d'évaluation
- TP5' ChimieDocument2 pagesTP5' Chimiebouaiedanissa61Pas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- Sem 1 S10405Document4 pagesSem 1 S10405jamjamalPas encore d'évaluation
- TD1 Description Et Évolution-1 À 10 CorrDocument10 pagesTD1 Description Et Évolution-1 À 10 CorrmpofPas encore d'évaluation
- Equilibre ChimiqueDocument5 pagesEquilibre ChimiqueJabri ImenePas encore d'évaluation
- Devoir de Controle n2 20212022bac Math DefDocument5 pagesDevoir de Controle n2 20212022bac Math Defshyalien646Pas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- Acide Et Base - Dosage (Récupération Automatique)Document39 pagesAcide Et Base - Dosage (Récupération Automatique)Driss Droussi100% (3)
- Corrige Bac PC Serie s1 2013 PDFDocument6 pagesCorrige Bac PC Serie s1 2013 PDFngariPas encore d'évaluation
- Sans TitreDocument3 pagesSans TitreouidadPas encore d'évaluation
- Corrige de L'Epreuve de Sciences PhysiquesDocument6 pagesCorrige de L'Epreuve de Sciences PhysiquesKéitaPas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- 2016 AmSud Exo2 Correction Benzaldehyde 9ptsDocument5 pages2016 AmSud Exo2 Correction Benzaldehyde 9ptsShanthini JekumarPas encore d'évaluation
- Cine Tique 2Document22 pagesCine Tique 2momos55Pas encore d'évaluation
- Corrige s2 2014Document7 pagesCorrige s2 2014GueyePas encore d'évaluation
- EXAM BLANC 1SEM 2BAC SM BIOF ESCALADE 16-01-2024Document8 pagesEXAM BLANC 1SEM 2BAC SM BIOF ESCALADE 16-01-2024othmane.zaariPas encore d'évaluation
- 2009 Afrique Exo1 Correction Pomme 6 5ptsDocument2 pages2009 Afrique Exo1 Correction Pomme 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Correction DS ExempleDocument4 pagesCorrection DS ExempleAngélique GUAZPas encore d'évaluation
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- 2007 09 National Exo1 Correction Iode 6 5ptsDocument4 pages2007 09 National Exo1 Correction Iode 6 5ptsYoussef Ismaili alaouiPas encore d'évaluation
- 2007 Antilles Exo1 Correction BenzoateMethyle 5.5ptsDocument3 pages2007 Antilles Exo1 Correction BenzoateMethyle 5.5ptsHafid Tlemcen Rossignol PoètePas encore d'évaluation
- Correction National 2019 - SM - NDocument10 pagesCorrection National 2019 - SM - NProf YOUSSEF MOUJAHID أستاذ يوسف مجاهدPas encore d'évaluation
- Simili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023Document10 pagesSimili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- Devoir PC 14Document2 pagesDevoir PC 14Salih officielPas encore d'évaluation
- Devoir Blanc 2 Bac PCDocument2 pagesDevoir Blanc 2 Bac PCSABOUR MOHAMMEDPas encore d'évaluation
- Devoir 1 BiofDocument3 pagesDevoir 1 BiofSABOUR MOHAMMEDPas encore d'évaluation
- Bac 2012 SM1 ofDocument14 pagesBac 2012 SM1 ofSABOUR MOHAMMEDPas encore d'évaluation
- Devoir N°1 Physique 1 OCTOBRE 2022Document1 pageDevoir N°1 Physique 1 OCTOBRE 2022SABOUR MOHAMMEDPas encore d'évaluation
- Quantité de Matière 1Document2 pagesQuantité de Matière 1SABOUR MOHAMMEDPas encore d'évaluation
- ONDES EXERCICES CHOISIS PAR MR SABOURDocument3 pagesONDES EXERCICES CHOISIS PAR MR SABOURSABOUR MOHAMMEDPas encore d'évaluation
- Controle 1 PDFDocument1 pageControle 1 PDFTALAIPas encore d'évaluation
- TRANSFORMATION DebutDocument2 pagesTRANSFORMATION DebutSABOUR MOHAMMEDPas encore d'évaluation
- Diagnostique 1bac MR SabourDocument2 pagesDiagnostique 1bac MR SabourSABOUR MOHAMMED100% (1)
- Quantité de Matière 1Document2 pagesQuantité de Matière 1SABOUR MOHAMMEDPas encore d'évaluation
- Astuces de CinétiqueDocument1 pageAstuces de CinétiqueSABOUR MOHAMMEDPas encore d'évaluation
- Ondes RevisionDocument5 pagesOndes RevisionSABOUR MOHAMMEDPas encore d'évaluation
- QCM Elec 1Document3 pagesQCM Elec 1SABOUR MOHAMMEDPas encore d'évaluation
- QCM Elec 2Document3 pagesQCM Elec 2SABOUR MOHAMMEDPas encore d'évaluation
- Bou6265 PDFDocument145 pagesBou6265 PDFOumaima BdzPas encore d'évaluation
- Energie ReticulaireDocument8 pagesEnergie Reticulaireimad essaidyPas encore d'évaluation
- Dosage Colorimétrique de L'élément Fer Dans Le Vin - Énoncé (TS)Document6 pagesDosage Colorimétrique de L'élément Fer Dans Le Vin - Énoncé (TS)ulysse974Pas encore d'évaluation
- Chapitre 4 PDFDocument10 pagesChapitre 4 PDFArsène KekpenaPas encore d'évaluation
- TP ElectrochromieDocument17 pagesTP Electrochromie123456789Pas encore d'évaluation
- Dosage Sulfate de Cuivre Spect Cu Cond SO4Document4 pagesDosage Sulfate de Cuivre Spect Cu Cond SO4Mohamed El gharbiPas encore d'évaluation
- Document Pédagogique Mis À La Libre DispositionDocument4 pagesDocument Pédagogique Mis À La Libre Dispositionchh1960Pas encore d'évaluation
- Cours de Geologie Exogene (Ic1)Document33 pagesCours de Geologie Exogene (Ic1)eva gratiePas encore d'évaluation
- Cours Solubilite-PrecipitationDocument12 pagesCours Solubilite-PrecipitationAkrasiaPas encore d'évaluation
- 2014 Physique Chimie Juin 2014Document8 pages2014 Physique Chimie Juin 2014NamelessPas encore d'évaluation
- Terre DécoloranteDocument61 pagesTerre Décoloranteazeety lm100% (3)
- Cours 1 de Chimie Des Solutions Chapitre 1 ConductimétrieDocument47 pagesCours 1 de Chimie Des Solutions Chapitre 1 ConductimétrieRaouia MakhloufPas encore d'évaluation
- D'une: Cu SODocument2 pagesD'une: Cu SOThe KuuPas encore d'évaluation
- 4 6037250590990402206 PDFDocument8 pages4 6037250590990402206 PDFIkeoPas encore d'évaluation
- 06 Chapitre 1Document52 pages06 Chapitre 1Abde TamPas encore d'évaluation
- Calcul TacDocument3 pagesCalcul TacChérif DzPas encore d'évaluation
- Sa1 (1) 2021Document8 pagesSa1 (1) 2021Clement HergéPas encore d'évaluation
- Biophysique Ue3Document455 pagesBiophysique Ue3sassia zaidiPas encore d'évaluation
- 1ers - DS 5 - Chapitres 10Document4 pages1ers - DS 5 - Chapitres 10Massilya HmPas encore d'évaluation
- L'atome Et L'anionDocument4 pagesL'atome Et L'anionEL mekki NajidPas encore d'évaluation
- Annale Bac 2011 Sces Phy.1Document119 pagesAnnale Bac 2011 Sces Phy.1wilfried zadoc kouadioPas encore d'évaluation
- Controle 4 Atomesions 3eDocument4 pagesControle 4 Atomesions 3ehelene.helene5656Pas encore d'évaluation
- Piles Électriques - Piles ActivablesDocument6 pagesPiles Électriques - Piles ActivablesBENMESSAOUDPas encore d'évaluation
- Examen Normalise 3eme Annee College Physique 2020 - 1Document2 pagesExamen Normalise 3eme Annee College Physique 2020 - 1ghita7mezPas encore d'évaluation
- DNB Blanc Janvier 2018Document3 pagesDNB Blanc Janvier 2018ShadyPas encore d'évaluation
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 pagesAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Élaboration Du MétalDocument16 pagesÉlaboration Du MétalbelkacemPas encore d'évaluation
- CM 3Document9 pagesCM 3Orchide PurplePas encore d'évaluation
- Fi Chier Etude Danger I CpeDocument266 pagesFi Chier Etude Danger I CpeEmile Dzidjinyo Jr.Pas encore d'évaluation
- Contrôle 15 (PR Hamza Khaldoune)Document2 pagesContrôle 15 (PR Hamza Khaldoune)manounemaryame19Pas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Cahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesD'EverandCahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesPas encore d'évaluation
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Cancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsD'EverandCancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- L'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaD'EverandL'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- La pensée dirigée: Traité sur le raisonnement et les logiquesD'EverandLa pensée dirigée: Traité sur le raisonnement et les logiquesÉvaluation : 5 sur 5 étoiles5/5 (2)