Académique Documents
Professionnel Documents
Culture Documents
Exercices 9 Réactions Acido - Basiques Dans Une Solution Aqueuse (PR Hammou Mouna)
Transféré par
messi 10100%(1)100% ont trouvé ce document utile (1 vote)
127 vues1 pageTitre original
Exercices 9 réactions acido – basiques dans une solution aqueuse ( Pr hammou mouna )
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
100%(1)100% ont trouvé ce document utile (1 vote)
127 vues1 pageExercices 9 Réactions Acido - Basiques Dans Une Solution Aqueuse (PR Hammou Mouna)
Transféré par
messi 10Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
WWW.PCTIZNIT.
COM
CHIMIE / Unité :2
LA TRANSF.
CHIMIQUE EST-ELLE
TOUJOURS TOTALE
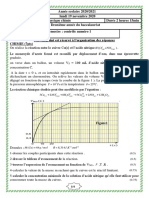
1) L’acide hypochloreux a pour formule HOCl(aq). Sa base conjuguée ClO-(aq)
est appelée ion hypochlorite.
Le document ci-contre représente les pourcentages des espèces chimiques
acide et base du couple HOCl/ClO - en fonction du pH pour une solution
1.1) Déterminer graphiquement la valeur numérique de la constante pKA du
couple HClO / ClO-.
2.1) Laquelle des deux courbes (a) ou (b) correspond à l'hypochlorite?
3.1) Écrire l'équation de la réaction de HClO avec de l'eau.
4.1) On considère une solution d'acide hypochloreux de pH=5. déterminer
le taux d’avancement de la réaction dans la solution .
2 ) Nous mélangeons V1 = 20mL de solution aqueuse S1 d'acide hypochloreux de concentration C1 = 10-2mol/L avec le
volume V2 =10mL de solution aqueuse S2 d'hydroxyde de sodium de concentration C1 = C2. On mesure le pH de la
solution et on trouve pH = 7,2
donnée à 25 °C: pKe = 14.
1.2) Ecrire l'équation de la réaction de l'acide hypochloreux avec les ions hydroxyde.
[ ]
2.2) Trouver la valeur de [ ]
dans le mélange et déterminer l'avancement finale de la réaction.
3.2) Exprimer la constante d'équilibre K associée à de la réaction d'acide hypochloreux et les ions hydroxyde en fonction
de pKe et Ka constante d'acidité de HClO / ClO-, puis calculer leur valeur numérique. Que concluez-vous?
1) L’acide hypochloreux a pour formule HOCl(aq). Sa base conjuguée ClO-(aq)
est appelée ion hypochlorite.
Le document ci-contre représente les pourcentages des espèces chimiques
acide et base du couple HOCl/ClO - en fonction du pH pour une solution
1.1) Déterminer graphiquement la valeur numérique de la constante pKA du
couple HClO / ClO-.
2.1) Laquelle des deux courbes (a) ou (b) correspond à l'hypochlorite?
3.1) Écrire l'équation de la réaction de HClO avec de l'eau.
4.1) On considère une solution d'acide hypochloreux de pH=5. déterminer
le taux d’avancement de la réaction dans la solution .
2 ) Nous mélangeons V1 = 20mL de solution aqueuse S1 d'acide hypochloreux de concentration C1 = 10-2mol/L avec le
volume V2 =10mL de solution aqueuse S2 d'hydroxyde de sodium de concentration C1 = C2. On mesure le pH de la
solution et on trouve pH = 7,2
donnée à 25 °C: pKe = 14.
1.2) Ecrire l'équation de la réaction de l'acide hypochloreux avec les ions hydroxyde.
[ ]
2.2) Trouver la valeur de [ ]
dans le mélange et déterminer l'avancement finale de la réaction.
3.2) Exprimer la constante d'équilibre K associée à de la réaction d'acide hypochloreux et les ions hydroxyde en fonction
de pKe et Ka constante d'acidité de HClO / ClO-, puis calculer leur valeur numérique. Que concluez-vous?
1) L’acide hypochloreux a pour formule HOCl(aq). Sa base conjuguée ClO-(aq)
est appelée ion hypochlorite.
Le document ci-contre représente les pourcentages des espèces chimiques
acide et base du couple HOCl/ClO - en fonction du pH pour une solution
1.1) Déterminer graphiquement la valeur numérique de la constante pKA du
couple HClO / ClO-.
2.1) Laquelle des deux courbes (a) ou (b) correspond à l'hypochlorite?
3.1) Écrire l'équation de la réaction de HClO avec de l'eau.
4.1) On considère une solution d'acide hypochloreux de pH=5. déterminer
le taux d’avancement de la réaction dans la solution .
2 ) Nous mélangeons V1 = 20mL de solution aqueuse S1 d'acide hypochloreux de concentration C1 = 10-2mol/L avec le
volume V2 =10mL de solution aqueuse S2 d'hydroxyde de sodium de concentration C1 = C2. On mesure le pH de la
solution et on trouve pH = 7,2
donnée à 25 °C: pKe = 14.
1.2) Ecrire l'équation de la réaction de l'acide hypochloreux avec les ions hydroxyde.
[ ]
2.2) Trouver la valeur de [ ]
dans le mélange et déterminer l'avancement finale de la réaction.
3.2) Exprimer la constante d'équilibre K associée à de la réaction d'acide hypochloreux et les ions hydroxyde en fonction
de pKe et Ka constante d'acidité de HClO / ClO-, puis calculer leur valeur numérique. Que concluez-vous?
www.hammoumouna.jimdo.com
WWW.PCTIZNIT.COM
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- Examen National Physique Chimie SPC 2011 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2011 Normale SujetHassanHajjiPas encore d'évaluation
- 2006 Asie Exo1 Sujet pHPKA 4ptsDocument1 page2006 Asie Exo1 Sujet pHPKA 4ptsla physique selon le programme FrançaisPas encore d'évaluation
- Sujet de Révision N°04Document14 pagesSujet de Révision N°04BI biPas encore d'évaluation
- 6129e5eb55e8ddevoir 19 Physique Chimie Niveau Terminale D LyceeDocument1 page6129e5eb55e8ddevoir 19 Physique Chimie Niveau Terminale D LyceeAhemed kapirePas encore d'évaluation
- 10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursDocument2 pages10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursMrt KikxPas encore d'évaluation
- DS3 1BAC FR Prof - Filali (WWW - Pc1.ma)Document2 pagesDS3 1BAC FR Prof - Filali (WWW - Pc1.ma)عماد UgghvvPas encore d'évaluation
- Série D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahDocument6 pagesSérie D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahMôlkà Trabelsi0% (1)
- Devoir de Contrôle N°2 - Sciences Physiques - Bac Mathématiques (2016-2017) MR Jalel CHAKROUNDocument5 pagesDevoir de Contrôle N°2 - Sciences Physiques - Bac Mathématiques (2016-2017) MR Jalel CHAKROUNwalidPas encore d'évaluation
- MR Amara: Devoir de Contrôle N°1 ChimieDocument10 pagesMR Amara: Devoir de Contrôle N°1 ChimieFadhel Fourat BoughanmiPas encore d'évaluation
- Devoir Maison #01Document3 pagesDevoir Maison #01Amine AlaoUii AlaouiPas encore d'évaluation
- Bac Blanc PC&SM 02 2024 MR SABOURDocument6 pagesBac Blanc PC&SM 02 2024 MR SABOURاستاذك في الفيزياء100% (1)
- Sciencesphysiqueg1 2018sujetDocument4 pagesSciencesphysiqueg1 2018sujetThamer SaiihiPas encore d'évaluation
- 02 - Solutions Electrolytiques Et ConcentrationsDocument4 pages02 - Solutions Electrolytiques Et ConcentrationsionelbudPas encore d'évaluation
- CHIMIE (7 Points)Document3 pagesCHIMIE (7 Points)Ghaid Mahmoudi0% (1)
- Examen Blanc Abrar 4Document7 pagesExamen Blanc Abrar 4Jamal ChahiriPas encore d'évaluation
- Devoir de Contrôle N°1 2010 2011 (Ben Dahmene) (Midoun)Document5 pagesDevoir de Contrôle N°1 2010 2011 (Ben Dahmene) (Midoun)ddddPas encore d'évaluation
- Série 1Document4 pagesSérie 1saidisalma412Pas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebPas encore d'évaluation
- Lycée Ibn Hazm Physique Cours: 10 Comportement Globale D'un CircuitDocument12 pagesLycée Ibn Hazm Physique Cours: 10 Comportement Globale D'un CircuitAmine TananPas encore d'évaluation
- 01 Bac Physchimie D Ci PDFDocument3 pages01 Bac Physchimie D Ci PDFSarah Amah AdomPas encore d'évaluation
- Acido Basiques Cours TitrageDocument16 pagesAcido Basiques Cours Titrageالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Akkari ds1Document5 pagesAkkari ds1Mhamed CherchariPas encore d'évaluation
- Ds1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Document4 pagesDs1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Zaid ChPas encore d'évaluation
- Sujet Rév N°4Document6 pagesSujet Rév N°4Roua TliliPas encore d'évaluation
- Ph14-Mouvement Plan - 2Document7 pagesPh14-Mouvement Plan - 2Nour-DineAhrouyPas encore d'évaluation
- Serie Cinetique Chimique 2015 2016 PDFDocument4 pagesSerie Cinetique Chimique 2015 2016 PDFjbeliee jbeliPas encore d'évaluation
- Equilibre chimique3PCDocument3 pagesEquilibre chimique3PCKhalid AwtmPas encore d'évaluation
- DC N°1 4 EME 2023 Lycée OkbaDocument3 pagesDC N°1 4 EME 2023 Lycée OkbaSalah ZahouaniPas encore d'évaluation
- Devoir de Synthese N - 1-2Document5 pagesDevoir de Synthese N - 1-2Med BriniPas encore d'évaluation
- Devoir - TN Dynamique de Translation Et Énergie Cinétique 2023 2014 (Mtarrab Badr) (Douz)Document3 pagesDevoir - TN Dynamique de Translation Et Énergie Cinétique 2023 2014 (Mtarrab Badr) (Douz)ssgPas encore d'évaluation
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARwalidPas encore d'évaluation
- Dc3 Sadiki 2014 MathsDocument3 pagesDc3 Sadiki 2014 Mathslemia100% (1)
- Série 2 - Décroissance RadioactiveDocument4 pagesSérie 2 - Décroissance RadioactiveMųhąmmęd DąrįfPas encore d'évaluation
- dc1 4eme Sadiki08-09Document3 pagesdc1 4eme Sadiki08-09ben zayed aliPas encore d'évaluation
- 5devoir de Synthèse N°1Document5 pages5devoir de Synthèse N°1Wassim Ben TanfousPas encore d'évaluation
- Controle À DomicileDocument4 pagesControle À DomicileZineb BicharPas encore d'évaluation
- WWW Devoir TN PDFDocument9 pagesWWW Devoir TN PDFBechir Ben MezhoudPas encore d'évaluation
- Devoir 1 BiofDocument3 pagesDevoir 1 BiofImane Eddoha100% (1)
- Dev Controle2 4eme SCDocument4 pagesDev Controle2 4eme SCSahbi Mabrouki YamenPas encore d'évaluation
- 4e DS2 2008 2009Document4 pages4e DS2 2008 2009Fethi FerchiouPas encore d'évaluation
- B Blan 2021 (SP)Document7 pagesB Blan 2021 (SP)HAMADA1972Pas encore d'évaluation
- 1.les Oscillations Libres Amorties - 1Document4 pages1.les Oscillations Libres Amorties - 1Abderahmen Haj DahmenPas encore d'évaluation
- Série D'exercices - Physique Le Dipôle RC - Bac Toutes Sections (2016-2017) MR GOUIDER ABDESSATARDocument2 pagesSérie D'exercices - Physique Le Dipôle RC - Bac Toutes Sections (2016-2017) MR GOUIDER ABDESSATARMohamed El Ouahdani100% (2)
- Dipole Rc-Cinetique Chimique: Exercice 1Document2 pagesDipole Rc-Cinetique Chimique: Exercice 1Alaoui Amine0% (1)
- Devoir de Controle 1 2020Document3 pagesDevoir de Controle 1 2020khalifakarouiPas encore d'évaluation
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimPas encore d'évaluation
- Sujet RL RCDocument3 pagesSujet RL RCMohamed El OuahdaniPas encore d'évaluation
- Devoir de Physique BacDocument7 pagesDevoir de Physique BachamadioPas encore d'évaluation
- Chute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof OthmaneDocument18 pagesChute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof Othmanemohamedelhafhouf2006Pas encore d'évaluation
- 2010 AmNord Exo2 Sujet Electricite 5 5ptsDocument3 pages2010 AmNord Exo2 Sujet Electricite 5 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Révision Et Coltrol 2Document5 pagesRévision Et Coltrol 2Arfa Bouchta67% (3)
- Dosage Acido Basique PCDocument3 pagesDosage Acido Basique PCKhalid AwtmPas encore d'évaluation
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument12 pagesSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDboudhar mohamed0% (1)
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 pagesSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Pas encore d'évaluation
- Serie Acide BaseDocument5 pagesSerie Acide Basebenmaleksamir84Pas encore d'évaluation
- UV Visible CoursDocument10 pagesUV Visible CoursNadjmo Ben MessaoudPas encore d'évaluation
- Cours 1Document13 pagesCours 1Ikram GrPas encore d'évaluation
- MIF 214 Ingestion de Produits CaustiquesDocument6 pagesMIF 214 Ingestion de Produits CaustiquesFouad RyukPas encore d'évaluation
- TD GravimétrieDocument1 pageTD GravimétrieAbderrahmane AmzidPas encore d'évaluation
- Les Produits Laitiers Préparés Par Fermentation LactiqueDocument2 pagesLes Produits Laitiers Préparés Par Fermentation LactiqueSöû SøùSøú MîãPas encore d'évaluation
- Traitements de SurfaceDocument4 pagesTraitements de SurfaceOualidPas encore d'évaluation
- AmianteDocument10 pagesAmianteYoucef BoukitPas encore d'évaluation
- Chapitre 10 CeramiqueDocument3 pagesChapitre 10 Ceramiqueomar sahamoudiPas encore d'évaluation
- E4.1 Étanchéité Toiture Terrasse Et Toiture InclinéeDocument90 pagesE4.1 Étanchéité Toiture Terrasse Et Toiture Inclinéesam hadPas encore d'évaluation
- st160065 PDFDocument84 pagesst160065 PDFYoucefPas encore d'évaluation
- NF Iso 21438-1Document40 pagesNF Iso 21438-1Aziz ElkhayariPas encore d'évaluation
- Facture Proforma de Prestation 2 FofanaDocument2 pagesFacture Proforma de Prestation 2 FofanaHostel Aladin LodgePas encore d'évaluation
- PROPRIETES THERMIQUES - LA DILATATION THERMIQUE - 5ac - 230308 - 161220Document24 pagesPROPRIETES THERMIQUES - LA DILATATION THERMIQUE - 5ac - 230308 - 161220Oumayma HdioudPas encore d'évaluation
- 4 Les Gisements HydrothermauxDocument5 pages4 Les Gisements HydrothermauxIbrahim Bichara AbdelkerimPas encore d'évaluation
- Les Différents Types de Peinture MuraleDocument5 pagesLes Différents Types de Peinture MuraleJean Jacques BelyPas encore d'évaluation
- Instrukcja SpeedexDocument2 pagesInstrukcja SpeedexGabi RodriguezPas encore d'évaluation
- Monoxyde de DihydrogèneDocument5 pagesMonoxyde de DihydrogèneTestPas encore d'évaluation
- Pfe Sameh Maizi .EAEEDocument157 pagesPfe Sameh Maizi .EAEEManong Sheguey100% (1)
- Guide Terre ExcaveesDocument12 pagesGuide Terre ExcaveesAlae IdPas encore d'évaluation
- Acide UriqueDocument1 pageAcide UriqueKadri BrahimPas encore d'évaluation
- AminesDocument3 pagesAminesOumar TraoréPas encore d'évaluation
- Additifs Et Contaminants L3 ANPDocument74 pagesAdditifs Et Contaminants L3 ANPÍşm ÀílPas encore d'évaluation
- Concours 2013 (+sol.) Proposition EPSTTDocument19 pagesConcours 2013 (+sol.) Proposition EPSTTNidal BestPas encore d'évaluation
- Polymérisation en Émulsion GMP 18Document17 pagesPolymérisation en Émulsion GMP 18mennanesalaheddinePas encore d'évaluation
- HerbicideDocument74 pagesHerbicidengolo konePas encore d'évaluation
- Cours de Biochimie: Enzymologie ApprofondieDocument90 pagesCours de Biochimie: Enzymologie ApprofondieTemtem HmPas encore d'évaluation
- Fontes À Graphite Sphéroïdal FGS 400-18A Et FGS 600-3A Spécifications TechniquesDocument4 pagesFontes À Graphite Sphéroïdal FGS 400-18A Et FGS 600-3A Spécifications TechniquesIna IoanaPas encore d'évaluation
- Cours 1 MinéralogieDocument6 pagesCours 1 MinéralogieabdoPas encore d'évaluation
- Licence 2 (Parcours Physique-Chimie) Année 2016-2017 TD2: Alcanes, Alcènes Et Alcynes Exercice 1Document3 pagesLicence 2 (Parcours Physique-Chimie) Année 2016-2017 TD2: Alcanes, Alcènes Et Alcynes Exercice 1Najimou Alade TidjaniPas encore d'évaluation
- Pile de DanielleDocument3 pagesPile de DanielleAnis NissouPas encore d'évaluation
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- La Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeD'EverandLa Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation