Académique Documents
Professionnel Documents
Culture Documents
B5.2 Correction Sujet TP1 - Dosage Par Étalonnage Et Incertitude
Transféré par
penelopeouali2006Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
B5.2 Correction Sujet TP1 - Dosage Par Étalonnage Et Incertitude
Transféré par
penelopeouali2006Droits d'auteur :
Formats disponibles
TP1 DOSAGE PAR ÉTALONNAGE DU SÉRUM PHYSIOLOGIQUE -
CORR
S’APPROPRIER
1) Ampèremètre en série et voltmètre en
dérivation.
2) Distance entre les plaques : 4,1 cm
Largeur des plaques : 2,5 cm
Hauteur d’immersion : 4,2 cm
Tension : U = 7,34 V
Intensité : I = 32,9 mA
G = I / U = 32,9 / 7,34 = 4,48 mS
Kcell = L / S = 4,1 / (4,2 x 2,5) = 0,39 cm-1
3) Conductivité :
LI
σ = Kcell G =
SU
-3
4,1 x 32.9 x 10 -1
σ = = 1750 μS. cm
4,2 x 2,5 x 7,34
4) u(σ) = 35 μS.cm-1
5) La conductivité mesurée vaut 1524 μS.cm-1 et le z -score vaut 6,5. L’écart entre la valeur
théorique et la valeur expérimentale est de 6,5 incertitudes. L’écart est assez important,
supérieur à la valeur de 2 mais les valeurs expérimentales restent du bon ordre de grandeur.
REALISER
À l’aide du matériel disponible, compléter le tableau pour ci – dessous en indiquant le
volume de solution mère à prélever pour réaliser 100 mL de chaque solution fille.
Solution fille S1 S2 S3 S4
Concentration Ci en
2,5 x 10-3 2,0 x 10-3 1,0 x 10-3 5,0 x 10-4
mol.L-1
Volume Vi de solution
25 20 10 5,0
mère à prélever en mL
Conductivité μS/Cm 301 248 128 59
Lors d’une dilution la quantité de matière prélevée à la solution mère se retrouve dans la
solution fille. Donc : Cm x Vm = Cf x Vf donc Vm = Cf x Vf / Cm = 0,001 x 100 / 10-2 = 10 mL.
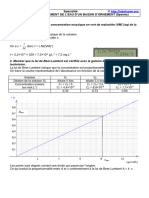
On obtient le graphique une droite d’étalonnage d’équation : y = 122261.x donc σ =122261.C
La mesure de la conductivité du sérum dilué 80 fois donne : σS = 256 μS.cm-1.
On a donc pour le sérum physiologique dilué :
Cs,dilué = σS / k = 256 / 122261 = 2,09 x 10-3 mol.L-1.
Spécialité physique – chimie
Conductivité (μS/cm)
350
300
f(x) = 122260.869565217 x
R² = 0.999585873167969
250
Conductivité (μS/cm)
200
150
100
50
0
0 0.0005 0.001 0.0015 0.002 0.0025 0.003
Concentration (mol/L)
ANALYSER
6) Cs = 80 x Cs,dilué donc Cs = 80 x 2,09 x 10-3 = 1,67 x 10-1 mol.L-1 car le sérum est dilué 80 fois.
Cm = Cs x MNaCl = 1,67 x 10-1 x 58,5 = 9,78 g.L-1
7)
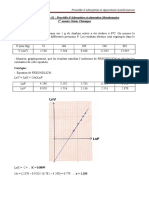
Groupe 1 2 3 4 5 Moyenne Écart type
-1
Cm (g.L ) 9,78 9,36 9,36 11,8 12,7 10,60 1,57
Incertitude de type A : u(Cm) = 7,0 x 10-1 g.L-1
Pour comparer à la valeur théorique on calcule : z = 2,28.
Donc l’écart entre la valeur théorique et la valeur expérimentale est de 2,28 fois l’incertitude.
Les valeurs sont un peu éloignées (en dessous de 2 c’est mieux) mais restent cohérentes.
VALIDER
8) On considère une solution de chlorure de sodium. Soit C la concentration en soluté apporté
dans la solution. Comme NaCl(s) Na+(aq) + Cl-(aq) alors si CNaCl = C alors [Na+] = C et [Cl-] = C.
La loi de Kohlrausch implique : σ = λNa+ . [Na+] + λCl-.[Cl-] = (λNa+ + λCl-).C.
9) On déduit de l’expression précédente : σ = (5,0 x 10-3 + 7,6 x 10-3).C = 12,6 x 10-3.C
Avec C en mol.m-3 et σ en S.m-1.
Pour pouvoir comparer au coefficient directeur que vous avez obtenu graphiquement, il faut
convertir C en mol.L-1 et la conductivité doit être donnée en μS.cm-1.
Pour C : 1 mol.m-3 = 10-3 mol.L-1 => C(mol.m-3) = C(mol.L-1) x 103
Pour σ : 1 S.m-1 = 106 μS.m-1 = 104 μS.cm-1 => σ(S.m-1) = σ(μS.cm-1) x 10-4
Donc σ(μS.cm-1) x 10-4 = 12,6 x 10-3 x C(mol.L-1) x 103 donc
σ(μS.cm-1) = 12,6 x 10-3 x C(mol.L-1) x 103 / 10-4 = 12,6 x 104 C(mol.L-1) = 1,26 x 105.C
Expérimentalement on obtient une courbe de tendance d’équation : y = 1,22 x 105.x. On en
déduit que : σ(μS.cm-1) = 1,22 x 105.C(mol.L-1). Cette valeur est proche de la valeur théorique.
Spécialité physique – chimie
Vous aimerez peut-être aussi
- B5.2 Correction Sujet TP1 - Dosage Par Étalonnage Et IncertitudeDocument2 pagesB5.2 Correction Sujet TP1 - Dosage Par Étalonnage Et Incertitudepenelopeouali2006Pas encore d'évaluation
- TP5Document3 pagesTP5RDM56Pas encore d'évaluation
- CR Electro 9Document22 pagesCR Electro 9Mer IemPas encore d'évaluation
- TP1 Electochimie 3émé AnnéeDocument10 pagesTP1 Electochimie 3émé AnnéeLïnâ ExØtîc DõlĽPas encore d'évaluation
- Corrige Td1 Uv Visible TsaDocument5 pagesCorrige Td1 Uv Visible TsaELAssaliAziz100% (4)
- Correction TP N°2 Le Dosage Par Étalonnage Spectrophotométrique-CorrigéDocument2 pagesCorrection TP N°2 Le Dosage Par Étalonnage Spectrophotométrique-Corrigéjad mamouPas encore d'évaluation
- 6 - S4 Corrigé S1Document4 pages6 - S4 Corrigé S1Oussam Ouadidi100% (2)
- ch02 61 Exos SupDocument6 pagesch02 61 Exos SupskanderPas encore d'évaluation
- S4 - Conductance Et Conductivité - 1BAC - IntDocument5 pagesS4 - Conductance Et Conductivité - 1BAC - Intchakourali67Pas encore d'évaluation
- 2017 Metropole Exo3 Spe Correction 5ptsDocument2 pages2017 Metropole Exo3 Spe Correction 5ptsantoineheude78Pas encore d'évaluation
- Corrigé+d... PDF SectroDocument25 pagesCorrigé+d... PDF SectroMohamed Belbaraka100% (3)
- TP4 ChimieDocument8 pagesTP4 ChimieJean gabriel MouchePas encore d'évaluation
- S4 Conductance Et Conductivité 1BAC IntDocument5 pagesS4 Conductance Et Conductivité 1BAC Intwassimelagri39Pas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- Solution-TD1 Chimie Des Solutions L2 GPDocument3 pagesSolution-TD1 Chimie Des Solutions L2 GPsoumiagpoPas encore d'évaluation
- Lycée Pilote Sfax DC 3 2009 CorrigéDocument2 pagesLycée Pilote Sfax DC 3 2009 CorrigéMaram BouaskerPas encore d'évaluation
- Des Ex Cour de Chimie ElectrochimieDocument21 pagesDes Ex Cour de Chimie ElectrochimieImene GhmrPas encore d'évaluation
- MMMMMDocument7 pagesMMMMMslimi khairaPas encore d'évaluation
- Chemie 1Document1 pageChemie 1Jose YoussefPas encore d'évaluation
- Biophysique TD Corriges Diffusion Dans La Phase LiquidesDocument4 pagesBiophysique TD Corriges Diffusion Dans La Phase LiquidesYacine AchPas encore d'évaluation
- Fiche de TD N 3 Ex. 1Document3 pagesFiche de TD N 3 Ex. 1Elaziouti AbdelkaderPas encore d'évaluation
- Chap N 6C ELEVE Exercices Conductimetrie Correction 0Document3 pagesChap N 6C ELEVE Exercices Conductimetrie Correction 0Samira ElAllaoui100% (2)
- Conductance Et Conductivité 1BAC Int EL AAMRANIDocument5 pagesConductance Et Conductivité 1BAC Int EL AAMRANIfatima marradoPas encore d'évaluation
- Nouha Ramadan Terminal S 2010-AmSud-Exo1-Correction-Lumiere-7ptsDocument2 pagesNouha Ramadan Terminal S 2010-AmSud-Exo1-Correction-Lumiere-7ptsrihab100% (1)
- Exo 1S ConductimetrieDocument1 pageExo 1S ConductimetriePatrick RAzafimahaleoPas encore d'évaluation
- 6 S4 Corrige S1Document4 pages6 S4 Corrige S1Chimiste ChimistePas encore d'évaluation
- Chimie Des Électrolytes TD Corrigé 01Document4 pagesChimie Des Électrolytes TD Corrigé 01moh mohPas encore d'évaluation
- TP - Physique MpsiDocument3 pagesTP - Physique MpsiTom DukatenzeilerPas encore d'évaluation
- Exercices Corrigés Chimie Des Électrolytes SMC s3Document21 pagesExercices Corrigés Chimie Des Électrolytes SMC s3yassine100% (3)
- Page Garde TP MpcaDocument11 pagesPage Garde TP MpcaMalak DamichePas encore d'évaluation
- 4 5926758966708146676Document9 pages4 5926758966708146676nadjibben.2525Pas encore d'évaluation
- 2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsDocument2 pages2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsAmina EnnPas encore d'évaluation
- Série N°6Document2 pagesSérie N°6Jihad ELPas encore d'évaluation
- 5 Exercice Mesure de La Conductance 2Document1 page5 Exercice Mesure de La Conductance 2younesebahsayinPas encore d'évaluation
- TD 4 CorrigéDocument7 pagesTD 4 CorrigéecosysPas encore d'évaluation
- Corrigé Série 1électrochimie 23-24Document10 pagesCorrigé Série 1électrochimie 23-24Soumia BakhtaPas encore d'évaluation
- Mesure de La ConductanceDocument1 pageMesure de La Conductancemarouane100% (1)
- TP3.1 Chimie Générale Spectro UV-VisDocument4 pagesTP3.1 Chimie Générale Spectro UV-VisGaetan BenoitPas encore d'évaluation
- Travaux Diriges GPC 402Document6 pagesTravaux Diriges GPC 402Benito BenitoPas encore d'évaluation
- Série N°6Document2 pagesSérie N°6Jihad ELPas encore d'évaluation
- Exercices Loi de Beer Lambert CORRECTION PDFDocument1 pageExercices Loi de Beer Lambert CORRECTION PDFTitoPas encore d'évaluation
- Exercices ConductivitéDocument4 pagesExercices ConductivitéAya AyaaaPas encore d'évaluation
- Chapitre 4 Applications Poteau À TreillisDocument26 pagesChapitre 4 Applications Poteau À TreillisAmir Mohammed el amine AmriPas encore d'évaluation
- Exercices Conductance Et ConductiviteDocument2 pagesExercices Conductance Et Conductiviteالغزيزال الحسن EL GHZIZAL Hassane84% (19)
- Cours & Exercices Mesure de Quantités de Matière Par ConductimétrieDocument6 pagesCours & Exercices Mesure de Quantités de Matière Par ConductimétrieAmine AlaoUii AlaouiPas encore d'évaluation
- Physique 2 Électricité Et Magnétisme Serway Chapitre 5 Solutions DétailléesDocument28 pagesPhysique 2 Électricité Et Magnétisme Serway Chapitre 5 Solutions DétailléesDave100% (1)
- 04 - Exercices ConductivitéDocument5 pages04 - Exercices Conductivitéakala katia100% (1)
- DS 7 266 2023-2024 37Document5 pagesDS 7 266 2023-2024 37ernestlemajeurPas encore d'évaluation
- Applications Poteau À Treillis Pour Envoie en LigneDocument26 pagesApplications Poteau À Treillis Pour Envoie en Ligne5pzpz7tm2pPas encore d'évaluation
- Corrigé de La Série 1 de CorrosionDocument8 pagesCorrigé de La Série 1 de CorrosionRabeh BenzadaPas encore d'évaluation
- Correction - Td3 - Semi - ConducteursDocument4 pagesCorrection - Td3 - Semi - ConducteursSamah AmeuriPas encore d'évaluation
- Devoir 1 pc2 PDFDocument6 pagesDevoir 1 pc2 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Série Dexercices 02Document3 pagesSérie Dexercices 02BENGUERBA YacinePas encore d'évaluation
- Exos Physik CorrectionDocument8 pagesExos Physik CorrectionChrist NyakeyPas encore d'évaluation
- DSI 2013 CorDocument6 pagesDSI 2013 Coralain nguyenPas encore d'évaluation
- Travaux Diriges de La Serie 1Document1 pageTravaux Diriges de La Serie 1alamranimalika7Pas encore d'évaluation
- Brochure Nissan Urvan N350 15 PlacesDocument14 pagesBrochure Nissan Urvan N350 15 PlaceskonePas encore d'évaluation
- Les Approches Managériales Basées Sur Les Parties PrenantesDocument4 pagesLes Approches Managériales Basées Sur Les Parties PrenantesNohaila BencherquiPas encore d'évaluation
- Exercice 3Document1 pageExercice 3test lili100% (1)
- Catalogue OKOFEN 2018 2019Document68 pagesCatalogue OKOFEN 2018 2019joseph38Pas encore d'évaluation
- Serveur D'impression Sous Windows 2003Document6 pagesServeur D'impression Sous Windows 2003Issam BammouPas encore d'évaluation
- MicrobiologieDocument5 pagesMicrobiologieInes FirasPas encore d'évaluation
- Manuel C2Document140 pagesManuel C2Daniel AndriamananaPas encore d'évaluation
- CH1 (Introduction Au SI) PDFDocument17 pagesCH1 (Introduction Au SI) PDFEL OUAZZANI PRINTPas encore d'évaluation
- Programme Maths cm2Document1 pageProgramme Maths cm2gorguy100% (1)
- World of Warcraft - Wrath of The Lich King - Arthas, My SonDocument4 pagesWorld of Warcraft - Wrath of The Lich King - Arthas, My SonAdrian Angel LagrecaPas encore d'évaluation
- 2M120 TD 2016 ch1 Codes CorrecteursDocument2 pages2M120 TD 2016 ch1 Codes CorrecteurskokiPas encore d'évaluation
- Phrases À Remettre Dans L'ordreDocument9 pagesPhrases À Remettre Dans L'ordreSylvie DinisPas encore d'évaluation
- Secours en Cours de RouteDocument32 pagesSecours en Cours de Routeantonio59100Pas encore d'évaluation
- Chapitre 3 Ressources Réserves PlanificationDocument10 pagesChapitre 3 Ressources Réserves PlanificationAdlanePas encore d'évaluation
- ProjetDocument4 pagesProjetEya AwadiPas encore d'évaluation
- TP Controle Optimal PDFDocument29 pagesTP Controle Optimal PDFHamza El-houariPas encore d'évaluation
- DRAFT - Cours OCO - Part1Document32 pagesDRAFT - Cours OCO - Part1Khennoune WissamPas encore d'évaluation
- Laddition Des Nombres Entiers CM2Document8 pagesLaddition Des Nombres Entiers CM2chantal.aboujaoudehPas encore d'évaluation
- Examen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Document7 pagesExamen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Mar IemPas encore d'évaluation
- Laboratoire Biolab Bamako - Recherche GoogleDocument1 pageLaboratoire Biolab Bamako - Recherche GoogleAlou CoulibalyPas encore d'évaluation
- Les Corriges Essai District Kanel Jan 2024 - 061004Document8 pagesLes Corriges Essai District Kanel Jan 2024 - 061004souleymanehousnaPas encore d'évaluation
- RapportDocument125 pagesRapportKawtar L AzaarPas encore d'évaluation
- Corrige Serie5Document4 pagesCorrige Serie5Chef FatimaPas encore d'évaluation
- ContexteDocument2 pagesContextehibaouafi502Pas encore d'évaluation
- QP1C General 1 PDFDocument5 pagesQP1C General 1 PDFSamson KlouganPas encore d'évaluation
- Método de Violino - CajatiDocument41 pagesMétodo de Violino - CajatiWalmir PaiãoPas encore d'évaluation
- Transformateurs MonophasésDocument51 pagesTransformateurs MonophasésDo OuPas encore d'évaluation
- 1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Document16 pages1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Mohamed Hechmi JERIDIPas encore d'évaluation
- RIB CopieDocument1 pageRIB CopieAbdoulaye CisséPas encore d'évaluation
- 5-Focales-Episode-2-Planification Et RégulationDocument42 pages5-Focales-Episode-2-Planification Et RégulationTaffyd MaertinsPas encore d'évaluation