Académique Documents
Professionnel Documents
Culture Documents
Dosaaaaaaage PDF
Dosaaaaaaage PDF
Transféré par
Řachida LkTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Dosaaaaaaage PDF
Dosaaaaaaage PDF
Transféré par
Řachida LkDroits d'auteur :
Formats disponibles
Acides et Bases en solution aqueuse
Acides
Exercice 1
Calculer le pH d’une solution d’acide chlorhydrique de concentration 0,05 mol.L-1
Exercice 2
L’acide nitrique est un acide fort. On dissout dans un litre de solution aqueuse 1,26 g d’une
solution commerciale d’acide nitrique à 50% (richesse en masse). Soit S1 la solution
obtenue.
1. Calculer la concentration en acide nitrique de la solution S1.
2. Faites l’inventaire de toutes les espèces présentes dans S1 et calculer leurs
concentrations.
3. Donner la valeur du pH de la solution aqueuse S1.
On dilue la solution S1 précédente au dixième dans une fiole jaugée de 200,0 mL. On obtient
la solution S2.
1. Quel volume de solution S1 doit-on prélever ? Quelle verrerie doit-on utiliser ?
2. Quel est le pH de la solution S2 ?
Exercice 3
Une solution d’acide nitrique a un pH=3,3. Déterminer les concentrations molaires des
espèces chimiques de la solution et calculer la concentration molaire initiale en acide
nitrique.
Exercice 4
1. Pour un composé gazeux, le volume molaire est de 24 L.mol-1 dans les conditions
normales de température
a. Donner la définition du volume molaire.
b. Pourquoi ne précise-t-on pas le type de composé ?
2. On dissout 1 mL de HCl gazeux (volume mesuré dans les conditions normales de
température et de pression) dans de l’eau. On étend cette solution à 5,00 litres. Quel
est le pH de la solution obtenue ? Cette solution est diluée au 100ème. Que devient le
pH ?
Exercice 5
Quel volume d’eau distillée faut-il ajouter à 40 mL d’une solution d’acide chlorhydrique de
pH=1,7 pour obtenir une solution de pH=2,4 ?
Exercice 6
Calculer le pH de la solution obtenue en mélangeant 2 litres d’acide chlorhydrique à 0,05
mol.L-1 et 3 litres d’acide nitrique à 0,15 mol.L-1.
J.-L. Dormieux / RNChimie 02/06/2008 1/8
Exercice 7
Calculer le pH d’une solution d’acide chlorhydrique de concentration 0.04 mol.L-1.
Calculer le pH d’une solution d’acide éthanoïque de concentration 0.04 mol.L-1.
(pKa(CH3COOH/ CH3COO-) = 4,8).
Comparer.
Exercice 8
On considère une solution d’acide acétylsalicylique (pKa = 3,5) de concentration c0 mol.L-1.
a. Ecrire l’équation de la réaction entre l’ acide acétylsalicylique et l’eau.
b. Calculer le pH d’une solution de l’acide acétylsalicylique (pKa = 3,5) de concentration
c0 mol.L-1 dans le cas où c0= 0,01 mol.L-1 et c0= 0,001 mol.L-1.
Formule de l’acide acétylsalicylique :
Exercice 9
Toutes les solutions sont à 25°C. Le produit ionique de l’eau est Ke= 10-14.
Une solution d’acide propanoïque de concentration c1= 0, 330 mol.L-1 a un pH égal à 2,7.
1. Calculer les concentrations molaires de toutes les espèces chimiques contenues
dans cette solution.
2. En déduire le pKa du couple CH3CH2COOH/ CH3CH2COO-.
3. Définir et calculer le coefficient de dissociation de l’acide propanoïque de cette
solution.
Exercice 10
Calculer le pH d’une solution de chlorure d’ammonium de concentration 0,1 mol.L-1. Le pKa
du couple NH4+/NH3 est de 9,2
Bases
Exercice 11
Calculer le pH d’une solution d’hydroxyde de potassium de concentration 0.05 mol.L-1.
Exercice 12
L’ion hypochorite ClO- possède un caractère basique au sens de Bronsted. La constante
d’acidité de son couple acido-basique est Ka1= 3,2 10-8.
Soit une solution S1 de concentration en ions hypochorites c= 6,7 10-2 mol.L-1.
1. Quelle est la formule de l’acide dont la base conjuguée est l’ion hypochlorite ?Définir
la constante d’acidité Ka1.
2. Tracer l’allure du diagramme de prédominance relatif au couple.
J.-L. Dormieux / RNChimie 02/06/2008 2/8
3. Le pH de la solution S1 est égal à 10,9. Exprimer la relation entre le pH et pKa1. Que
vaut la concentration en acide conjugué ?
L’activité bactéricide et virucide de l’ion hypochorite est cent fois moins importante que celle
de son acide conjugué. La liqueur de Daquin préparée en pharmacie est un mélange
contenant la solution S1 et d’autres espèces chimiques dont 0,238 mol.L-1 d’ions
hydrogénocarbonate HCO3-. Ce mélange contient pour le colorer et le stabiliser vis-à-vis de
la lumière du permanganate de potassium.
4. L’ion hydrogénocarbonate est l’acide du couple HCO3-/CO32- (pKa2 = 10,3). Montrer
qu’une réaction acido-basique peut avoir lieu entre l’ion hydrogénocarbonate et les
ions hydroxyde. Ecrire l’équation de cette réaction.
5. Exprimer et calculer la constante d’équilibre de cette réaction.
6. Le pH de la solution de Daquin est égal à 9,4. Pourquoi est-il inférieur au pH de la
solution S1 ? Calculer la nouvelle valeur du rapport des concentrations en base ClO-
et en acide conjugués.
7. En déduire une justification de l’utilisation de la liqueur de Daquin plutôt que l’eau de
Javel (solution S1) pour aseptiser et désinfecter les plaies et les muqueuses.
Exercice 13
L’hydroxyde de calcium est une dibase forte dont la solubilité dans l’eau est de 1.85g.L-1 à
20°C. Calculer le pH d’une solution saturée.
Exercice 14 (Bac 1990)
Le fluorure d’hydrogène est un acide faible de pKa= 3.2.
1. On dispose d’une solution A de HF de concentration molaire 0.1 mol.L-1.
a. Faire le bilan des espèces chimiques présentes en solution.
b. Calculer leurs concentrations molaires en justifiant les approximations éventuelles.
c. Calculer le pH de A.
2. Une solution contient 0.050 moles de fluorure de potassium par litre. Etablir la
relation donnant le pH de B. Calculer ce pH.
Exercice 15 (Bac 1987)
1. Calculer le pH d’une solution aqueuse d’éthanoate de sodium dont la concentration 0.1
mol.L-1 en démontrant la relation utilisée et en justifiant les approximations faites.
2. Calculer les concentrations en ions hydroxyde [HO-] et en acide acétique [CH3COOH].
3. Calculer la fraction d’éthanoate de sodium protoné en pourcentage molaire.
4. A 100 mL de la solution d’éthanoate de sodium à 0.1 mol.L-1, on ajoute 40 mL d’acide
chlrohydrique à une concentration 0.25 mol.L-1. Calculer le pH de la solution obtenue.
Donnée : pKa(CH3COOH/CH3COO-) = 4.7
J.-L. Dormieux / RNChimie 02/06/2008 3/8
Exercice 16 (Bac 1986)
1. Soit une solution S de cyanure de potassium de concentration molaire 0.3 mol.L-1.
Calculer le pH de cette solution S.
2. A 20 mL de S, on ajoute 30 mL d’une solution d’acide chlorhydrique à 0.15 mol.L-1.
On obtient une solution S1. Calculer le pH de S1.
3. Données : Ka(HCN/CN-) = 4.9 10-10.
Exercice 17 (Bac 1980)
1. Quel volume de gaz d’ammoniac pris dans les conditions normales de température
et de pression faut-il dissoudre dans 300 mL d’eau pour que le pH obtenue soit de
10.92 ?
2. Quel est le volume d’une solution à 0.15 mol.L-1 d’acide nitrique (acide fort), faut-il
ajouter à la solution précédente pour obtenir l’équivalence ?
3. Calculer le pH de cette nouvelle solution ainsi obtenue.
Données : pKa(NH4+/NH3) = 9.25
Volume molaire : 22400 cm3 (conditions normales)
Polyacides
Exercice 18
Déterminer le pH d’une solution aqueuse de dioxyde de carbone de concentration 1.0 10-2
mol.L-1.
Indiquer sur un graphe les domaines de prédominance (au seuil des 10%) des différentes
formes acides et basiques correspondant à la solution de dioxyde de carbone.
pKa du dioxyde de carbone : 6,4 ; 10,2
Exercice 19
On a une solution d’acide sulfureux H2SO3 de concentration C0 = 0.01 mol.L-1. On y ajoute
des pastilles de soude (variation de volume négligeable) jusqu’à ce que le pH soit égal à 5,0.
Exprimer [H2SO3] et [SO32-] en fonction de HSO3-. Calculer ces trois concentrations.
Exercice 20
1. Tracer le diagramme de prédominance de H3SO4 dont les pKa sont 2,2 ; 7,0 ; 11,6.
2. Calculer le pH d’une solution de concentration 0.1 mol.L-1 d’arséniate de sodium
Na3AsO4.
3. Calculer le pH d’une solution de concentration 0.1 mol.L-1 de dihydrogénoarséniate de
sodium NaH2AsO4.
J.-L. Dormieux / RNChimie 02/06/2008 4/8
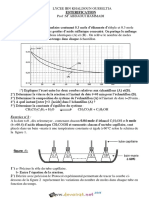
Exercice 21 : Bac 2004 : Dosage d’une solution d’acide phosphorique
1. L’acide phosphorique H3PO4 est un triacide. Les forces de chacune de ses acidités sont
suffisamment différentes pour qu’on puisse les doser séparément. On considère une solution
(S) de cet acide.
1.1. Placer sur un axe gradué en unité de pH de 0 à 14 les espèces prédominantes de cet
acide.
1.2. Le pH de la solution (S) est de 2,1.
1.2.1. Indiquer les espèces majoritaires issues de l'acide phosphorique dans (S) ; justifier la
réponse.
1.2.2. Donner, sans aucun calcul, le coefficient de dissociation de l'acide phosphorique dans
(S).
2. On procède au dosage de la solution (S) par une solution d'hydroxyde de sodium (soude).
On relève les valeurs du pH de la solution en fonction du volume de soude versé.
La courbe de dosage comporte deux sauts de pH correspondant aux deux équivalences E1
(V1, pH1) et E2 (V2, pH2).
2.1. Étude de la première équivalence.
2.1.1. Indiquer l'espèce majoritaire qui impose le pH à la première équivalence E1.
2.1.2. Expliquer pourquoi cette espèce est un ampholyte en écrivant les équations de ses
réactions avec l’eau.
2.1.3. Sans justifier, donner l’expression littérale du pH à la première équivalence E1, puis
calculer pH1, valeur du pH à l'équivalence E1.
2.2. Étude de la deuxième équivalence.
2.2.1. Écrire l’équation de la réaction de dosage entre E1 et E2.
2.2.2. Calculer la constante KR de cette réaction ; commenter le résultat.
2.2.3. Indiquer l'espèce majoritaire qui impose le pH à la deuxième équivalence E2.
2.2.4. Sans justifier, donner l’expression littérale du pH à la deuxième équivalence E2, puis
calculer pH2, valeur du pH à l'équivalence E2.
2.3. Étude de la réaction de dosage après la deuxième équivalence.
2.3.1. Écrire l’équation de la réaction de dosage après la deuxième équivalence
2.3.2. Calculer la constante KR de cette réaction ; commenter le résultat.
2.3.3. Indiquer quelle est la conséquence de ce résultat sur la courbe tracée.
Données (à 25 °C)
pK1 (H3PO4 /H2PO4-) = 2,1
pK2 (H2PO4-/ HPO42-) = 7,2
pK3 (HPO42-/ PO43-) = 12,4
Produit ionique de l’eau à 25 °C : pKe = 14,0
Solutions tampons
Exercice 22
Calculer le pH d’une solution contenant 0,02 mol.L-1 d’acide acétique et 0,04 mol.L-1
d’acétate de sodium.
Données : pKa(CH3COOH/CH3COO-) = 4,8
J.-L. Dormieux / RNChimie 02/06/2008 5/8
Exercice 23
Calculer le pH du mélange suivant :
-V1 =200 mL d’une solution d’ammoniaque de concentration c1=0,020 mol.L-1.
-V1 =400 mL d’une solution de chlorure d’ammonium de concentration c2=0,015 mol.L-1.
Données : pKa(NH4+/NH3) = 9,2
Exercice 24
Calculer le pH de la solution obtenue par dissolution dans 500 mL d’eau déminéralisée de :
-0,60 g de dihydrogénophosphate de sodium (M= 119,98 g.mol-1)
-1,42 g d’hydrogénophopshate de disodium (M= 141,96 g.mol-1)
Données : pKa (dihydrogénophosphate/ hydrogénophophate) = 7,2
Exercice 25
Montrer qu’en mélangeant 100 mL d’acide acétique à 0,10 mol.L-1 et 100 mL de soude à
0,040 mol.L-1, on obtient une solution tampon. Calculer son pH.
Exercice 26
Quels volumes V1 d’une solution d’acide chlorhydrique à la concentration 0,010 mol.L-1 et V2
d’une solution de cyanure de potassium à la concentration 0,010 mol.L-1 faut-il verser pour
préparer 100 mL d’une solution de pH=8,5 ?
Données : pKa(HCN/CN-) = 9,3
Exercice 27
1. A 100 mL d’une solution (S) contenant 0,1 mol.L-1 d’acide acétique et 0,1 mol.L-1
d’acétate de sodium, on ajoute 10 mL d’une solution d’acide chlorhydrique à 0,1
mol.L-1. Calculer la variation de pH de (S). Comparer à ce que serait la variation de
pH si on ajoutait la même quantité d’acide fort dans 100 mL d’eau pure.
2. Quelle est la variation du pH si on dilue la solution au dixième ?
Exercice 28
Données (à 25 °C)
pKa du couple NH4+/NH3 : 9,2
Masse molaire du chlorure d’ammonium, NH4Cl : M = 53,5 g.mol-1
Produit ionique de l’eau : Ke = 1,0 10-14
1. Indiquer les propriétés d’une solution tampon.
2. Écrire les équations des réactions de l’ammoniac et de l’ion ammonium avec l’eau.
3. Calculer la valeur du rapport des concentrations [NH3]/[NH4+] dans le mélange
tampon lorsque le pH est égal à 10,0.
J.-L. Dormieux / RNChimie 02/06/2008 6/8
4. Déterminer la masse de chlorure d’ammonium NH4Cl à dissoudre, sans variation
notable de volume, dans un litre de solution d’ammoniac à 2,00 mol.L-1 pour réaliser
une solution tampon de pH = 10,0. Justifier les éventuelles approximations.
5. La solution tampon ainsi préparée est utilisée pour réaliser un dosage
complexométrique à un pH voisin de 10.
Le bécher de dosage contient initialement 80,0 mL de la solution tampon précédente
et la prise d’essai à doser ; à l’équivalence du dosage complexométrique, le volume
dans le bécher est de 100 mL. La réaction de dosage a alors libéré 2,0 × 10-3 mole
d’ions H3O+.
5.1. Écrire l’équation de la réaction des ions H3O+ avec la solution tampon ; montrer
qu’elle est pratiquement totale.
5.2. Déterminer alors les concentrations en NH3 et en NH4+ à l’équivalence du dosage
complexométrique.
5.3. Calculer, à l’équivalence du dosage complexométrique, la nouvelle valeur du pH.
Commenter le résultat en faisant apparaître le rôle de la solution tampon.
Exercice 29 : Dosage d’une solution d’acide propanoïque
Dans un volume Va = 50,0 mL d’une solution A d’acide propanoïque de concentration
molaire Ca = 0,20 mol.L-1, on ajoute progressivement une solution B d’hydroxyde de sodium
de concentration Cb = 0,10 mol.L-1.
1. Étude de la solution A
1.1. Écrire l’équation de la réaction de l’acide propanoïque avec l’eau.
1.2. Calculer le pH de la solution d’acide propanoïque. Toutes les relations utilisées
seront justifiées.
2. Étude de la solution à l’équivalence du dosage.
2.1. Écrire l’équation de la réaction de dosage.
2.2. Indiquer si la solution obtenue à l’équivalence est acide, basique ou neutre. La
réponse est à justifier sans calcul.
2.3. Calculer le volume Ve de solution B d’hydroxyde de sodium versé pour atteindre
l’équivalence.
3. Étude de la solution S obtenue à la demi-équivalence du dosage.
3.1. Faire l’inventaire des espèces chimiques majoritaires présentes dans la solution
S.
3.2. Écrire la relation entre [C2H5COO-] et [C2H5COOH], dans la solution S, sans tenir
compte de la réaction de ces espèces avec l’eau ; en déduire le pH de la solution
S.
3.3. Préciser le nom et les propriétés de cette solution.
3.4. Il est possible de réaliser une solution de même pH que la solution S en
mélangeant deux solutions parmi celles proposées dans le tableau ci-dessous, en
utilisant les concentrations et les volumes indiqués.
Solution 1 Propanoate de Concentration molaire C1 = 0,05 mol.L-1 Volume V1 = 1,00 L
sodium
Solution 2 Hydroxyde de sodium Concentration molaire C2 = 0,05 mol.L-1 Volume V2 = 0,50 L
Solution 3 Acide chlorhydrique Concentration molaire C3 = 0,05 mol.L-1 Volume V3 = 1,00 L
Solution 4 Acide chlorhydrique Concentration molaire C4 = 0,05 mol.L-1 Volume V4 = 0,50 L
Indiquer le mélange à effectuer, en justifiant la réponse par un calcul de quantité de matière.
J.-L. Dormieux / RNChimie 02/06/2008 7/8
Données (à 25 °C)
Produit ionique de l’eau : pKe = 14,0
Constante d’acidité du couple C2H5COOH/C2H5COO: pKa = 4,9
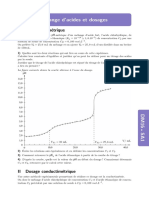
Exercice 30 : Conductimétrie
On souhaite déterminer la constante d’acidité du couple acide acétique / ion acétate (ou
acide éthanoïque / ion éthanoate) à l’aide d’une mesure conductimétrique.
On appelle constante de cellule k le rapport de la conductance G et de la conductivité σ de la
solution. On peut donc écrire la relation : G = k.σ . Dans les conditions de l’expérience, la
constante de cellule vaut k = 2,5.10–3 m .
Dans un bécher, on verse un volume V0 = 100 mL d'une solution S0 d’acide acétique, de
concentration C0 = 1,00.10–3 mol.L–1. On immerge la cellule d’un conductimètre. Celui-ci
mesure une conductance de valeur G = 11,5 µS.
On note λ la conductivité molaire ionique de l’ion oxonium H3O+ et λ’ la conductivité molaire
ionique de l’ion acétate CH3CO2–.
Données :
On rappelle l’expression de la conductivité σ en fonction des concentrations effectives des
espèces ioniques Xi en solution : σ = Σ λi [Xi]
Conductivités molaires ioniques à 25°C (conditions de l’expérience) :
λ = 3,5.10–2 S.m2.mol–1 ; λ’ = 4,1.10–3 S.m2.mol–1
Dans cette solution, la faible concentration des ions hydroxyde HO– rend négligeable leur
participation à la conduction devant celle des autres ions.
1. La conductance de la solution est-elle changée si on modifie l'un des paramètres suivants
en gardant les autres identiques :
- la concentration apportée c0
- le volume V0 de la solution
- la température de la solution.
Pour chacun des paramètres, justifier la réponse.
2. Ecrire l'équation de la réaction modélisant la transformation entre l'acide acétique et l'eau.
3. Donner l'expression du quotient de réaction à l'équilibre Qr,éq associé à l'équation
précédente et en déduire une relation entre l'avancement final Qr,éq, xfinal, c0 et V0.
4. Donner l'expression de G, conductance de la solution et en déduire une relation entre G et
l'avancement final xfinal. Calculer la valeur de xfinal en mol.
5. Calculer le taux d'avancement final. La transformation peut-elle être considérée comme
totale ?
6. Constante d'acidité :
6.1. Calculer Qr,éq.
6.2. En déduire la constante d'acidité KA et le pKA du couple acide acétique/ion acétate.
6.3. La valeur de Qr,éq est-elle modifiée si on utilise une solution plus diluée ? Justifier.
J.-L. Dormieux / RNChimie 02/06/2008 8/8
Vous aimerez peut-être aussi
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 pagesCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyPas encore d'évaluation
- TD Tampon 2013 lsll-WahabDiopDocument4 pagesTD Tampon 2013 lsll-WahabDiopFy EzahanaPas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- Brochure de Chimie TSM Tse (1) - 1Document46 pagesBrochure de Chimie TSM Tse (1) - 1Elhadj BahPas encore d'évaluation
- Dosage Acide Base IndicDocument3 pagesDosage Acide Base IndicAs Ma50% (2)
- Oxydation Des AlcoolDocument3 pagesOxydation Des AlcoolJacobPas encore d'évaluation
- Cours Dosage Acido-BasiqueDocument10 pagesCours Dosage Acido-BasiqueOussama ElfaqyrPas encore d'évaluation
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- Chimie PDFDocument6 pagesChimie PDFleilaPas encore d'évaluation
- Renforcement PH - Acide Fort Et Tampon 2022Document5 pagesRenforcement PH - Acide Fort Et Tampon 2022GueyePas encore d'évaluation
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- Chimie TD Force Acide BaseDocument3 pagesChimie TD Force Acide BaseJunior Le PyromanePas encore d'évaluation
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 pagesSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- Exo Chimie TS2 CorrigéDocument102 pagesExo Chimie TS2 Corrigéy7mdwxk9x6Pas encore d'évaluation
- Acides Et Bases de BronstedDocument2 pagesAcides Et Bases de BronstedSmaali Faouzi Smaali100% (1)
- Exercice Corrigé - Dosage D'un Acide Fort Avec Une Base Faible (Allure de La Courbe PH F (Va)Document5 pagesExercice Corrigé - Dosage D'un Acide Fort Avec Une Base Faible (Allure de La Courbe PH F (Va)Baye ModouPas encore d'évaluation
- AvancementDocument3 pagesAvancementbaatout oumaymaPas encore d'évaluation
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoPas encore d'évaluation
- Alcools Amines Renf AT 22Document6 pagesAlcools Amines Renf AT 22Émile Michel FayePas encore d'évaluation
- TD Acide Base 24 Fevrier 2016Document10 pagesTD Acide Base 24 Fevrier 2016Tkra G Sil100% (1)
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 pagesDM16 1112 - Dosage PH Metrique Es PDFEmma LovaPas encore d'évaluation
- Mélange en SocieteDocument28 pagesMélange en SocieteBill644Pas encore d'évaluation
- Exo AlcaneDocument3 pagesExo AlcaneKRA KOUAME SERGE100% (1)
- Exo TDDocument8 pagesExo TDBassirou YacoubaPas encore d'évaluation
- Ex Chap3 CorrectionDocument13 pagesEx Chap3 CorrectionAmina BelarouciPas encore d'évaluation
- Acide Base Faible CoupleDocument5 pagesAcide Base Faible CoupleBicaba MarkissPas encore d'évaluation
- Corrigé TD1Document3 pagesCorrigé TD1Aytaç AktuğPas encore d'évaluation
- Chimie-TleC D TI-Eval4Document6 pagesChimie-TleC D TI-Eval4hamidaPas encore d'évaluation
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- C5 Sol Aqueuses WahabDiopDocument3 pagesC5 Sol Aqueuses WahabDiopGaye Bachir100% (1)
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pages4 Exercice Suivi D'une Transformation Chimiquenabil echerrarPas encore d'évaluation
- Devoir de Synthèse N°2 2011 2012 (Mtarrab Badr) (Elahd Eljadid Douz)Document3 pagesDevoir de Synthèse N°2 2011 2012 (Mtarrab Badr) (Elahd Eljadid Douz)Moufida ZouaghiPas encore d'évaluation
- Chimie Des Solutions Résumé 04Document23 pagesChimie Des Solutions Résumé 04Jordan PeterPas encore d'évaluation
- AFBF2021Document2 pagesAFBF2021Abdourahmane BaPas encore d'évaluation
- Bac Guinee PDFDocument19 pagesBac Guinee PDFMamadou Aliou DiakitéPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR Chebbi Rachid PDFDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR Chebbi Rachid PDFMohamed SaidiPas encore d'évaluation
- No15 2ndACD 25 Mars 2023 Sujetexa - ComDocument2 pagesNo15 2ndACD 25 Mars 2023 Sujetexa - ComGjhgPas encore d'évaluation
- Exercices Et Corriges Reaction Esterification Hydrolyse PDFDocument4 pagesExercices Et Corriges Reaction Esterification Hydrolyse PDFmahad100% (1)
- 2009 Pondichery Exo1 Sujet Ester Pheromone 6 5ptsDocument3 pages2009 Pondichery Exo1 Sujet Ester Pheromone 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Les AlcoolsDocument4 pagesLes AlcoolsADJEPas encore d'évaluation
- Bac Math Pysh Acide Base Serie 4Document1 pageBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- Exercices C9: Les Complexes: + 4 NH ZN (NH)Document4 pagesExercices C9: Les Complexes: + 4 NH ZN (NH)Silento SwordPas encore d'évaluation
- FICHE Dosage WebDocument4 pagesFICHE Dosage Webفيديو بالعربيPas encore d'évaluation
- Tle DDocument3 pagesTle DDaimsPas encore d'évaluation
- Exercice Corriges Nomenclature 2 (Biofaculte)Document4 pagesExercice Corriges Nomenclature 2 (Biofaculte)Wou SOUAREPas encore d'évaluation
- Exercice IDocument15 pagesExercice IInes De Paul Feudjeu100% (1)
- RCI 2017 BAC Serie D Physique ChimieDocument4 pagesRCI 2017 BAC Serie D Physique ChimieJunior RaymondPas encore d'évaluation
- TD - Cpgo - 2023-2024 - Cinetique ChimiqueDocument4 pagesTD - Cpgo - 2023-2024 - Cinetique Chimiquedieudonnepooda71Pas encore d'évaluation
- Devoir de Révision N°1 - Sciences Physiques Chimie Cinétiques Physique Dipôles RC Et RL Et RLC - Bac Sciences Exp (2012-2013) MR El Hafi MustaphaDocument7 pagesDevoir de Révision N°1 - Sciences Physiques Chimie Cinétiques Physique Dipôles RC Et RL Et RLC - Bac Sciences Exp (2012-2013) MR El Hafi MustaphaAyoub AbidPas encore d'évaluation
- Détermination de La Formule Brute DDocument4 pagesDétermination de La Formule Brute DBRICE THIERYPas encore d'évaluation
- Brochure de Chimie TSMDocument53 pagesBrochure de Chimie TSMOūs Mān BeretePas encore d'évaluation
- Evaluation PC Revision Tle D Du 13 05 23Document4 pagesEvaluation PC Revision Tle D Du 13 05 23Fadila OuattaraPas encore d'évaluation
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 pagesSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- Série 4 Esrérification 2021Document6 pagesSérie 4 Esrérification 2021safouen mejbriPas encore d'évaluation
- Chimie Tes 2019-1Document151 pagesChimie Tes 2019-1efoalphonse5Pas encore d'évaluation
- Série Acide - BaseDocument6 pagesSérie Acide - BaseMehdi Bnmssd100% (1)
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- Corrige Du Concours de Medecine Epreuve de SVT CorrectionDocument6 pagesCorrige Du Concours de Medecine Epreuve de SVT CorrectionHafidi AhmedPas encore d'évaluation
- CamScanner 07-15-2021 15.57Document9 pagesCamScanner 07-15-2021 15.57Hafidi AhmedPas encore d'évaluation
- Acides Bases PDFDocument8 pagesAcides Bases PDFHafidi AhmedPas encore d'évaluation
- DS6 PSI Corrige PDFDocument8 pagesDS6 PSI Corrige PDFHafidi AhmedPas encore d'évaluation
- Bac Blanc 1 2013 PDFDocument16 pagesBac Blanc 1 2013 PDFHafidi AhmedPas encore d'évaluation
- Corriges Physique 03Document4 pagesCorriges Physique 03Hafidi AhmedPas encore d'évaluation