Académique Documents
Professionnel Documents
Culture Documents
Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal Ali
Transféré par
Dhiya KlaiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal Ali
Transféré par
Dhiya KlaiDroits d'auteur :
Formats disponibles
Série chimie : PH des solutions aqueuses 4 éme M-SC exp
Exercice N° 1
On dispose de deux solutions aqueuses (S 1 ) et (S 2 ) de même concentration molaire C>10-6 mol.L-1.
• (S 1 ) : Solution aqueuse d’acide chlorhydrique HCl(acide fort).
• (S 2 ) : Solution aqueuse d’acideméthanoïqueHCOOH (acide faible).
I- La mesure du pH des deux solutions (S 1 ) et (S 2 ) a donné les valeurs suivantes :pH 1 =
2,448etpH 2 = 1,097.
1- Accorder à chaque solution la valeur de son pH. Justifier.
2- a- Dresser le tableau descriptif d’avancement volumique relatif à la réaction d’un acide AH
avec l’eau.
𝟏𝟏𝟏𝟏−𝒑𝒑𝒑𝒑
b- Montrer que le taux d’avancement final s’écrit : τ f = .
𝑪𝑪
3- On considère la solution aqueuse de l’acide chlorhydrique HCl.
a- Ecrire l’équation modélisant l’ionisation de l’acide chlorhydrique HCl dans l’eau.
b- Rappeler, sans démonstration, l’expression du pH de la solution (S 1 ).
c- Déduire la concentration molaire C des deux solutions (S 1 ) et (S 2 ).
d- Calculer le taux d’avancement final τ 1f de l’ionisation du HCl dans la solution (S 1 ).
4- On considère maintenant la solution aqueuse de l’acide méthanoïqueHCOOH.
a- Ecrire l’équation modélisant l’ionisation de l’acide méthanoïqueHCOOH dans l’eau.
b- Déterminer les concentrations molaires des différentes entités chimiques (autres que
l’eau)présentés dans la solution (S 2 ).
c- Appliquer la loi d’action de masse pour trouver le pKa du couple HCOOH/HCOO-.
d- Calculer le taux d’avancement final τ 2f de l’ionisation du HCOOH dans la solution (S 2 ).
Conclure.
e- Etablir l’expression du pH de la solution (S 2 ) en précisant les approximations nécessaires.
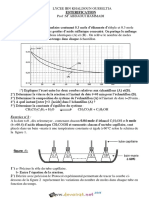
II- On prend les deux solutions précédentes(S 1 ) et (S 2 ) et on les dilue. Pour différentes
concentrations molaires C, on mesure les valeurs du pH des deux solutions (S’ 1 ) et (S’ 2 )
ainsi obtenues.
On donne les courbes de pH des deux solutions en fonction de (-log C) : pH = f(-log C) et on
suppose que le HCOOH sera supposé faiblement ionisé dans toutes les solutions.
1- Identifier la courbe qui correspond à chaque solution.
2- Déduire le pKa du couple HCOOH/HCOO-.
3- a- En utilisant les courbes données, déterminer les taux d’avancement finaux τ’ 1f et τ’ 2f pour
C’= 10-2 mol.L-1.
b- Déduire l’influence de la dilution sur :
• L’ionisation de l’acide chlorhydrique en comparant τ 1f et τ’ 1f .
• L’ionisation de l’acide méthanoïque en comparant τ 2f et τ’ 2f .
c-Calculer le volume V e d’eau ajoutée à V = 20 mL de (S 1 ) pour obtenir (S’ 1 ) dans le cas où
C’=10-2 mol.L-1.
1 | Elaboré par Afdal Ali GSM / 26548242
Série chimie : PH des solutions aqueuses 4 éme M-SC exp
Exercice N° 2
On dissout une masse m d’éthanoate de sodium CH 3 COONa dans l’eau distillée pour obtenir une
solution (S 0 ) de concentration molaire C 0 et de pH 0 >8.
1- a- Ecrire les équations des réactions qui accompagnent la dissolution de l’éthanoate de
sodium dans l’eau sachant que CH 3 COONa est un électrolyte fort.
b- Dresser le tableau descriptif d’avancement volumique relatif à l’ionisation de l’ion éthanoate
CH 3 COO- dans l’eau.
2- a- Montrer qu’à l’équilibre, on a : [CH 3 COO-]= C 0 (1-τ f0 ) : (τ f0 est le taux d’avancement
final de la réaction de dissociation de la base CH 3 COO-).
b- Etablir l’expression de la constante d’acidité Ka du couple (CH 3 COOH / CH 3 COO-) en
fonction de C 0 ;τ f0 ; pH 0 etpKe.
𝟏𝟏
c- En supposant que la base est faiblement ionisé, montrer que pH 0 =𝟐𝟐(pKe + pKa + log C 0 ).
3- On procède à la dilution d’un volume V 0 de la solution (S 0 ) en ajoutant un volume V e d’eau
distillé. La base CH 3 COO- reste toujours faiblement ionisée. On obtient une solution (S).
𝟏𝟏 𝑽𝑽𝑽𝑽
a- Montrer que le pH de la solution (S) a pour expressionpH = pH 0 -𝟐𝟐 log (1 +𝐕𝐕𝟎𝟎 ).
𝑽𝑽𝑽𝑽
b- on donne le graphe traduisant les variations de pH en fonction de log (1 +𝐕𝐕𝟎𝟎 )
• Déduire du graphe la valeur de pH 0 .
• Sachant que τ f0 = 7,41.10-5, calculer la valeur de C 0 .
• En déduire la valeur du pKa.
• Déterminer le volume V e que l’on doit ajouter à V 0 = 20 mL de la solution (S 0 ) pour
obtenir une solution (S) depH =8,37.
Exercice N° 3
Soient quatre solutions (S 1 ) ; (S 2 ) ; (S 3 ) et (S 4 ) de concentrations molaires respectives C 1 ; C 2 ;
C 3 et C 4 tels que C 2 = 2 C 1 etC 3 = C 4. On donne le tableau de valeurs suivant :
Solution (S 1 ) (S 2 ) (S 3 ) (S 4 )
pH avant dilution pH 1 pH 2 = pH 1 pH 3 = 2 pH 4 =12
pH’ après une
pH’+1= 3,875 pH’ 2 > pH 2 pH’ 3 = 3 pH’ 4 = 11
dilution 10 fois
1- a- Rappeler, sans démonstration, les expressions des pH d’une solution d’un acide fort et
d’une solution d’une base forte.
b- Déterminer la variation du pH ( ΔpH = pH’ – pH) suite à une dilution 10 fois d’un acide fort et
d’une base forte.
c- Déduire si chacune des solutions(S 3 ) et (S 4 ) est une solution d’acide ou de basefort(e) ou
faible d- Calculer C 3 .
2- a- Donner l’expression du taux d’avancement final τ f de la réaction de dissociation d’un acide
dans l’eau en fonction de son pH et de la concentration molaire C de la solution aqueuse.
b- Comparer, en le justifiant, les taux d’avancement finaux τ 1f et τ 2f de la dissociation des deux
acides respectivement dans (S 1 ) et (S 2 ).
c- en déduire une comparaison entre les constantes d’acidité Ka 1 et Ka 2 du couple acide/base
respectivement dans (S 1 ) et (S 2 ).
d- Sachant que l’acide dans (S 1 ) est faiblement ionisé avant et après dilution et que la valeur de
son pKa est pKa 1 = 4,75, établir l’expression du pH d’un acide faible et déduire la valeur de C 1 .
2 | Elaboré par Afdal Ali GSM / 26548242
Série chimie : PH des solutions aqueuses 4 éme M-SC exp
Exercice N°4
On prépare une solution aqueuse (S) moyennement diluée, d’acide éthanoïqueCH 3 COOH de
volume V et de pH<6
1- Ecrire l’équation de la réaction de cet acide avec l’eau.
2- Dresser un tableau descriptif d’avancement volumique du système chimique.
3- On considère que l’acide éthanoïques’ionise très faiblement dans l’eau.
a- Montrer que le tauxd’avancement final τ f de la réaction deCH 3 COOHdans (S) est τ f =
[𝑯𝑯𝟑𝟑 𝑶𝑶+ ]
𝑪𝑪
b- Exprimer, en fonction de C et τ f , les concentrations des différentes espèces chimiques,
autres que l’eau, présentes dans la solution (S).
c- Montrer que la constante d’aciditéKa du couple CH 3 COOH/ CH 3 COO- est Ka = Cτ f 2.
d- Déduire l’expression du pH de la solution (S).
e- Pour C = 4.10-2 mol.L-1, on a τ f = 2.10-2. Calculer la valeur du pKa du couple CH 3 COOH/
CH 3 COO-. Calculer la valeur du pH.
4- En diluant n fois la solution S. On obtient une solution S’ de volume V’= nV et de
concentration C’. On considère les cas pour lesquels CH 3 COOH reste faiblement ionisé.
a- En utilisant l’expression de Ka, calculer n pour que le taux d’avancement finalτ’ f de la
réaction de CH 3 COOH dans (S’) soit τ’ f = 2 τ f .
b- Exprimer la variation de pH (ΔpH = pH’ – pH) en fonction uniquement de C et C’.
𝟏𝟏
c- Montrer que ΔpH = 𝟐𝟐 log n.
d- Dans le cas où n = 10, choisir le matériel nécessaire pour réaliser cette dilution en
précisant la démarche expérimentale qu’il faut suivre pour préparer cette dilution.
Matériel à disposition : 3 pipettes de 1 mL ; de 2 mLet de 10 mL.
3fioles jaugéesde50 mL ; de 100 mL et de 250 mL.
Exercice N° 5
On considère une solution aqueuse (S) d’ammoniac NH 3 de concentration molaire C = 0,1 mol.L-
1
et de pH = 11,1.
1- a- Montrer que l’ammoniac NH 3 est une base faible.
b- Ecrire l’équation de sa réaction avec l’eau.
c- Dresser letableau descriptif volumiquede l’évolution du système chimique
d- Calculer les concentrations des entités chimiques, autres que l’eau,présentes dans la
solution (S).
e- Déduire la valeur du pKa du couple acide/base dont la base conjuguée est NH 3 .
2- a- Etablir l’expression du taux d’avancement final τ f de la réaction de l’ammoniac avec l’eau
en fonction du pH de la solution (S), du pKe et de sa concentration molaire C. Calculer τ f .
b- En déduire que l’ammoniac NH 3 est une base faiblement ionisé dans la solution (S).
3- Déduire l’expression du pH de la solution (S) en fonction du pKe ;pKaet C.
Retrouver la valeur du pKa du couple acide/baseprécédent.
4- Une solution (S’) de concentration molaire C’ et de volumeV’=100mL est obtenue en diluant
un volume V 0 de la solution (S). La mesure du pH de la solution (S’) donne pH’=10,6.
a- Déterminer les concentrations molaires des entités chimiques, autres que l’eau, présentes
dans la solution (S’).
b- Montrer que C’=10-2 mol.L-1.
c- En déduire le volume V 0 .
5- a- Déterminer le taux d’avancement final τ’ f de la réaction de l’ammoniacavec l’eau dans la
solution (S’).
b- En déduire l’effet de la dilution sur l’ionisation de l’ammoniac NH 3 .
3 | Elaboré par Afdal Ali GSM / 26548242
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- Serie Dexercices Dacides Et Bases Du Bac Sciences en TunisieDocument5 pagesSerie Dexercices Dacides Et Bases Du Bac Sciences en TunisieJaafar Abdelhafidh100% (1)
- Dosage Acide Base IndicDocument3 pagesDosage Acide Base IndicAs Ma50% (2)
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- PH Avec CorrectionDocument7 pagesPH Avec Correctionaminamaaloul09Pas encore d'évaluation
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 pagesSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- Exercice IDocument15 pagesExercice IInes De Paul Feudjeu100% (1)
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- Magazine 17 Esterification PDFDocument5 pagesMagazine 17 Esterification PDFamal mansour0% (1)
- Dev de Controle 1 Bac SC - ExpDocument5 pagesDev de Controle 1 Bac SC - ExpImed OmranePas encore d'évaluation
- Série D'exercices N°2 - Chimie - Esterification - Hydrolyse - Bac Sciences Exp (2015-2016) MR Daghsni SahbiDocument4 pagesSérie D'exercices N°2 - Chimie - Esterification - Hydrolyse - Bac Sciences Exp (2015-2016) MR Daghsni SahbiAmine AlaoUii AlaouiPas encore d'évaluation
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoPas encore d'évaluation
- Les Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtDocument4 pagesLes Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtNjipnangPas encore d'évaluation
- Bac Math Pysh Acide Base Serie 4Document1 pageBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- TPC4Document2 pagesTPC4hhedfiPas encore d'évaluation
- Série Révision Mars 23Document8 pagesSérie Révision Mars 23Ahmed Baba Mohameden HamdiPas encore d'évaluation
- Dev Synthese N°14scDocument6 pagesDev Synthese N°14scSahbi Mabrouki Yamen0% (1)
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 pagesChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- Serie 1 Avancement D'une Reaction 2021Document6 pagesSerie 1 Avancement D'une Reaction 2021ja3bek ma9rouna0% (1)
- Série de Révision 2023 PDFDocument58 pagesSérie de Révision 2023 PDFnur alouiPas encore d'évaluation
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- Série D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliDocument6 pagesSérie D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliOussémaM'solli0% (1)
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- Chimie PDFDocument6 pagesChimie PDFleilaPas encore d'évaluation
- Devoir de Synthèse N°1 - Physique - Bac Tech (2009-2010)Document8 pagesDevoir de Synthèse N°1 - Physique - Bac Tech (2009-2010)KhaoulaMaatoug100% (1)
- Vitesse 2Document5 pagesVitesse 2lemiaPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebPas encore d'évaluation
- Esterification HydrolyseDocument5 pagesEsterification HydrolyseAnis Dahnen100% (1)
- 6-Acides CarboxyliquesDocument1 page6-Acides CarboxyliquesBen Slema AzizPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2020-2021) MR Sfaxi SalahDocument5 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2020-2021) MR Sfaxi SalahWajih M'likiPas encore d'évaluation
- Control 2 Officiel 3Document5 pagesControl 2 Officiel 3salma benmiledPas encore d'évaluation
- Série Est-Hyd-Loi D'action de MasseDocument3 pagesSérie Est-Hyd-Loi D'action de Masseأسماء النخليPas encore d'évaluation
- Controle Dosage1sDocument2 pagesControle Dosage1sKhalid khalid100% (1)
- Bac Blanc PDFDocument2 pagesBac Blanc PDFMohameden Ahmed SalemPas encore d'évaluation
- Bac Blanc 2021bisDocument7 pagesBac Blanc 2021bisSahbi Mabrouki YamenPas encore d'évaluation
- S Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFDocument3 pagesS Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFmaanane maananePas encore d'évaluation
- Devoir de Synthese: FerchiouDocument4 pagesDevoir de Synthese: Ferchioufethi10% (1)
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueBoussetta ZouhaierPas encore d'évaluation
- Sujet de Révision N°04Document14 pagesSujet de Révision N°04BI biPas encore d'évaluation
- Dev Controle2 4eme SCDocument4 pagesDev Controle2 4eme SCSahbi Mabrouki YamenPas encore d'évaluation
- Exo de RemedDocument2 pagesExo de RemedAdama Dembe0% (1)
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 pagesChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounPas encore d'évaluation
- Examen Blanc N°2 Du Baccalauréat Année: 2020Document8 pagesExamen Blanc N°2 Du Baccalauréat Année: 2020Mehdi AgPas encore d'évaluation
- Exercices Ondes Mecaniques Progressives PeriodiquesDocument5 pagesExercices Ondes Mecaniques Progressives PeriodiquesMoulayMoulyPas encore d'évaluation
- Dc3 Sadiki 2014 MathsDocument3 pagesDc3 Sadiki 2014 Mathslemia100% (1)
- Détermination de La Formule Brute DDocument4 pagesDétermination de La Formule Brute DBRICE THIERYPas encore d'évaluation
- Série D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienDocument2 pagesSérie D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienInass LayachPas encore d'évaluation
- Bac Blanc PC&SM 02 2024 MR SABOURDocument6 pagesBac Blanc PC&SM 02 2024 MR SABOURاستاذك في الفيزياء100% (1)
- DC3 (18 04 09)Document7 pagesDC3 (18 04 09)Seif Souid100% (1)
- Devoir Controle 1 2024Document5 pagesDevoir Controle 1 2024rayentmar0Pas encore d'évaluation
- Suite Chute LibreDocument9 pagesSuite Chute Libretamersamira80Pas encore d'évaluation
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimPas encore d'évaluation
- RLC Forcees 2Document2 pagesRLC Forcees 2jhygjhgjh KaelPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 3ème Sciences Exp (2019-2020) MR KAMEL BAYRAK DARwalidPas encore d'évaluation
- PilesDocument17 pagesPilesOthmane HassounPas encore d'évaluation
- Série D'exercices - Chimie PH Des Solutions AqueusesDocument4 pagesSérie D'exercices - Chimie PH Des Solutions AqueusesBaccari100% (2)
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImenePas encore d'évaluation
- Examen Local - Janvier 2020 - Lycée Hassan II - Bni AyatAzilal FR (WWW - Pc1.ma)Document2 pagesExamen Local - Janvier 2020 - Lycée Hassan II - Bni AyatAzilal FR (WWW - Pc1.ma)Soukaina OutmalPas encore d'évaluation
- Acide Fort-Base ForteDocument11 pagesAcide Fort-Base Forteyann.carly BoulinguiPas encore d'évaluation
- Rapport PrincipalDocument60 pagesRapport PrincipalMarc DjahountoPas encore d'évaluation
- Acides AminesDocument20 pagesAcides Amines다리바야Pas encore d'évaluation
- Azur HT 4 (FT)Document6 pagesAzur HT 4 (FT)mostafa boujaataPas encore d'évaluation
- Travaux Pratiques de Thermodynamique Et de Cinétique ChimiquesDocument18 pagesTravaux Pratiques de Thermodynamique Et de Cinétique Chimiquesami rPas encore d'évaluation
- TP N°2 ChimieDocument5 pagesTP N°2 ChimieDenilson Josemir100% (1)
- EVALUATIONS #4 Tle C&D CH COSACEDocument2 pagesEVALUATIONS #4 Tle C&D CH COSACEArmel100% (2)
- Controle A La Reception Au Sei - LAHBOUB Loubna - 1924Document33 pagesControle A La Reception Au Sei - LAHBOUB Loubna - 1924Taj Khalil100% (2)
- Fascicule PC 4emeDocument20 pagesFascicule PC 4emesavadogowmauricePas encore d'évaluation
- TP Chmie S1 BENBEZZA PDFDocument15 pagesTP Chmie S1 BENBEZZA PDFManel AIT LARBIPas encore d'évaluation
- TP AnalytiqueDocument7 pagesTP AnalytiqueRoubio Hiba100% (1)
- Extraction Poison MinérauxDocument27 pagesExtraction Poison Minérauxhanibekakra2003Pas encore d'évaluation
- Devoir Maison 1ADocument3 pagesDevoir Maison 1Atapilybintou47Pas encore d'évaluation
- Devoir de Contrôle N°3 2ème Semestre - Sciences Physiques - 2ème Sciences (2017-2018) MR Ksouri TarekDocument2 pagesDevoir de Contrôle N°3 2ème Semestre - Sciences Physiques - 2ème Sciences (2017-2018) MR Ksouri TarekArij Mohamed MzoughuiPas encore d'évaluation
- Brochure de Chimie Tle Chimie MinéraleDocument60 pagesBrochure de Chimie Tle Chimie MinéraleokouejeanjuniorPas encore d'évaluation
- Bfem 2004Document1 pageBfem 2004Diabel DiopPas encore d'évaluation
- e835715f0a0427991f579441f2084f62Document1 pagee835715f0a0427991f579441f2084f62DelphinePas encore d'évaluation
- Rapport de Stage: Contrôle de La Qualité Des Eaux Par Analyses Physico-ChimiquesDocument28 pagesRapport de Stage: Contrôle de La Qualité Des Eaux Par Analyses Physico-ChimiquesReda RamiPas encore d'évaluation
- Devoir 2scDocument3 pagesDevoir 2scLotfi KhemiliPas encore d'évaluation
- Fiche 1 - Les Solutions Acides Et BasiquesDocument3 pagesFiche 1 - Les Solutions Acides Et BasiquesHamza El HadaouiPas encore d'évaluation
- 01 Les Solutions Acides Et BasiquesDocument2 pages01 Les Solutions Acides Et BasiquesAgnaou MohamedPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Réaction AB Indicateur DosageDocument5 pagesRéaction AB Indicateur DosageSk CissePas encore d'évaluation
- Devoir PC 3college International FR s1 25Document2 pagesDevoir PC 3college International FR s1 25Toni KrossPas encore d'évaluation
- Chapitre 6 - L'AnilineDocument7 pagesChapitre 6 - L'AnilineBeatrice Florin100% (1)
- Essais MecaniquesDocument45 pagesEssais MecaniquesMounir Frija100% (2)
- Corrigé de La Série N°2 - Équilibres Acido-BasiquesDocument7 pagesCorrigé de La Série N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Chimie OrganiqueDocument2 pagesChimie OrganiqueMichel La Marée HautePas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation