Académique Documents
Professionnel Documents
Culture Documents
Tube #1 2 3 4 5
Transféré par
Clara VolpatoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Tube #1 2 3 4 5
Transféré par
Clara VolpatoDroits d'auteur :
Formats disponibles
TP1 : COMPOSITION MASSIQUE D’UNE PIECE DE 10 EUROCENTIMES
Introduction
La banque centrale européenne nous indique qu’une pièce de 10 cents est fabriquée à partir d’un alliage de
plusieurs métaux dont la composition massique est la suivante :
89% de cuivre, 5% d’aluminium, 5% de zinc et 1% d’étain.
Le but de ce TP est de déterminer expérimentalement le % massique du cuivre dans la pièce et de le comparer
avec les données de la BCE.
1ère Etape
• Peser précisément une pièce de 10 cent. 𝑚𝑝𝑖è𝑐𝑒 = 𝑔
• Calculer la masse théorique de cuivre dans la pièce 𝑚𝑐𝑢𝑖𝑣𝑟𝑒 𝑑𝑎𝑛𝑠 𝑝𝑖è𝑐𝑒 = 𝑔
2ème étape (attaque de la pièce par l’acide nitrique)
• Mettre une pièce de 10 cents dans une fiole jaugée de 1L et recouvrir la pièce avec de l’acide nitrique
concentré. (expérience à réaliser sous la hotte). La pièce est attaquée par l’acide nitrique et les différents
métaux sont alors oxydés et se transforment en ions.
Le cuivre Cu est transformé en ion 𝐶𝑢2+. Les ions 𝐶𝑢2+ sont de couleur cyan en solution aqueuse.
• Compléter la fiole jaugée de 1L avec de l’eau distillée et homogénéiser.
3ème étape (préparation d’une solution mère de sulfate de cuivre)
• Peser exactement 3g de sulfate de cuivre pentahydraté 𝐶𝑢𝑆𝑂4 , 5 𝐻2 𝑂
• Dissoudre ces 3g de sulfate de cuivre pentahydraté dans une fiole jaugée de 100mL. La solution ainsi obtenue
sera la solution mère appelée S0.
4ème étape (préparation de 4 solutions filles diluées)
• Le tube N°1 est composé de 10 mL de S0
• Fabriquer les solutions filles diluées en tenant compte des volumes indiqués dans le tableau ci-dessous (tubes
N°2 , N°3 , N°4 , N°5)
• Calculez la concentration massique Cm du sulfate de cuivre pentahydraté pour chacun des 5 tubes.
• Calculer alors la concentration molaire C du sulfate de cuivre pentahydraté pour chacun des 5 tubes. On
donne la masse molaire du sulfate de cuivre pentahydraté : 249,6 g.mol-1
Tube N° 1 2 3 4 5
Volume de S0 (mL) 10 9 6 3 1
Volume eau distillée (mL) 0 1 4 7 9
-1
Concentration massique (g.L ) Cm1= Cm2= Cm3= Cm4= Cm5=
-1
Concentration molaire C (mol.L ) C1= C2= C3= C4= C5=
Absorbance A1= A2= A3= A4= A5=
ème
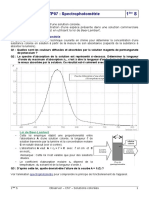
5 étape (tracé de la courbe d’étalonnage)
• Après avoir réglé le colorimètre sur la longueur d’onde 𝜆 = 660𝑛𝑚 et effectué le blanc, mesurer les valeurs
des absorbances pour chacun des 5 tubes et compléter la dernière ligne du tableau .
• Sur feuille de papier millimétré, placez les 5 points de coordonnées (C1 ;A1), (C2 ;A2), (C3 ;A3), (C4 ;A4) et (C5 ;A5).
Vous prendrez pour unité graphique 1cm pour 0,01 mol.L-1 sur l’axe des abscisses et vous prendrez 1cm pour
0,05 sur l’axe des ordonnées.
• Tracer alors la droite passant le plus près de ces 5 points et qui passe par l’origine du repère. Cette droite
s’appelle la courbe d’étalonnage.
• Mesurer l’absorbance de la solution dans laquelle on a dissous la pièce de 10 centimes. Reporter l’absorbance
sur la courbe et déterminer graphiquement la concentration molaire en ions 𝐶𝑢2+ de la solution.
6ème étape (calculs finaux et conclusion)
• A partir de la concentration molaire en ions 𝐶𝑢2+ mesurée graphiquement à la question précédente, calculer
la concentration massique de la solution en ions 𝐶𝑢2+. On donne la masse molaire du cuivre : 63,5 g.mol-1.
• Le résultat obtenu est-il cohérent avec la masse théorique de cuivre calculée au départ dans l’étape1?
Vous aimerez peut-être aussi
- Transformation Rapide Et LenteDocument1 pageTransformation Rapide Et LenteAlaoui AminePas encore d'évaluation
- 2synthese NickelDocument4 pages2synthese NickelNôùr Hòü Dã67% (3)
- TPlaitonDocument2 pagesTPlaitonAnis SouissiPas encore d'évaluation
- Pour Cent Age Massique D Une Piece-2Document3 pagesPour Cent Age Massique D Une Piece-2abd3l13Pas encore d'évaluation
- Dosage Sulfate de Cuivre Spect Cu Cond SO4Document4 pagesDosage Sulfate de Cuivre Spect Cu Cond SO4Mohamed El gharbiPas encore d'évaluation
- TD03Document2 pagesTD03chouroukbelkacemi236Pas encore d'évaluation
- TP EauxDocument5 pagesTP EauxibrahimiPas encore d'évaluation
- Présentation TP 3 Année Pharmacie VFDocument93 pagesPrésentation TP 3 Année Pharmacie VFUES THEORY100% (1)
- Correction TP3 Dosage Ions ChlorureDocument4 pagesCorrection TP3 Dosage Ions ChlorureYancouba BadjiPas encore d'évaluation
- Serie N°1 Solutions Aqueuses TD 2022-2023Document1 pageSerie N°1 Solutions Aqueuses TD 2022-2023akcmerteyah1Pas encore d'évaluation
- TP de Chimie, PièceDocument2 pagesTP de Chimie, Pièceali TOUQUIPas encore d'évaluation
- N 3-Dosage Du Cuivre Dans Le LaitonDocument1 pageN 3-Dosage Du Cuivre Dans Le LaitonMehdi LAHCENEPas encore d'évaluation
- TD BG2 2021-2022Document5 pagesTD BG2 2021-2022honorehien04Pas encore d'évaluation
- Exercice 1Document56 pagesExercice 1la physique selon le programme Français100% (1)
- TP Chlorure SerumDocument4 pagesTP Chlorure SerumyayaPas encore d'évaluation
- TP08-dosage CL Conduct-WolhardDocument1 pageTP08-dosage CL Conduct-WolhardAbdou aziz fallPas encore d'évaluation
- tp05 Maiver 2Document14 pagestp05 Maiver 2kmeriemPas encore d'évaluation
- Recueil de Chimie Tle CdeDocument27 pagesRecueil de Chimie Tle CdeKarma SambaPas encore d'évaluation
- Correction TP Olympiades Nitrates Dans EauDocument8 pagesCorrection TP Olympiades Nitrates Dans EausmiraniabderrahmenPas encore d'évaluation
- TP No07 Dosage Des Ions ChloruresDocument3 pagesTP No07 Dosage Des Ions Chlorureschérifa boulechfarPas encore d'évaluation
- CHAP - 02 ACT - EXP Dosage ChlorureDocument3 pagesCHAP - 02 ACT - EXP Dosage ChlorureChikh Mourad0% (1)
- CHAP - 02 ACT - EXP Dosage Chlorure CORRIGEDocument3 pagesCHAP - 02 ACT - EXP Dosage Chlorure CORRIGESiham SmallPas encore d'évaluation
- TP 3 PDFDocument3 pagesTP 3 PDFBouchra BkhtmPas encore d'évaluation
- TD - Généralités Sur Les Solutions Aqueuses - 2010Document2 pagesTD - Généralités Sur Les Solutions Aqueuses - 2010mohamedPas encore d'évaluation
- 2nde C N°3 CHIMIEDocument1 page2nde C N°3 CHIMIEMohamed YoumyamPas encore d'évaluation
- Methode de MohrDocument9 pagesMethode de MohrMoed MoedPas encore d'évaluation
- Inbound 5566480752698915028Document11 pagesInbound 5566480752698915028BouchraPas encore d'évaluation
- S3 TBP CME5.3 TP EleveDocument6 pagesS3 TBP CME5.3 TP EleveJamal LachgrePas encore d'évaluation
- TP Titrage Ions Chlorure Par MohrDocument3 pagesTP Titrage Ions Chlorure Par MohrNarimene Ch100% (2)
- TP2: Titrage Des Ions Chlorure Dans L'eau Et Le Lait Par La Méthode de MohrDocument6 pagesTP2: Titrage Des Ions Chlorure Dans L'eau Et Le Lait Par La Méthode de MohrImene ChebhiPas encore d'évaluation
- Bac Blanc 2023Document14 pagesBac Blanc 2023Naouma ChahdPas encore d'évaluation
- TP Tc3 Dosage-MohrDocument4 pagesTP Tc3 Dosage-MohrInfecté À la SchizophréniePas encore d'évaluation
- Érie D'exercices: C H I M I EDocument4 pagesÉrie D'exercices: C H I M I EbenaichahamzaPas encore d'évaluation
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- Hydrochimie Et Qualité Des Eaux TP Partie IDocument42 pagesHydrochimie Et Qualité Des Eaux TP Partie Ichenikherhadil3Pas encore d'évaluation
- Généralités Sur Les Solutions Aqueuses 2022Document2 pagesGénéralités Sur Les Solutions Aqueuses 2022Abdou FallPas encore d'évaluation
- Argentimétrie - Dosages Volumétriques Par PrécipitationDocument5 pagesArgentimétrie - Dosages Volumétriques Par Précipitationmaverickking230Pas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Gc389nc389ralitc389s Sur Les Solutions AqueusesDocument2 pagesGc389nc389ralitc389s Sur Les Solutions AqueusesabounouraleinPas encore d'évaluation
- TP SaintyorreDocument2 pagesTP Saintyorresarra bekriPas encore d'évaluation
- td1 SMPC s2Document7 pagestd1 SMPC s2Mohamed Ait KabirPas encore d'évaluation
- TP SI Potentiome TrieDocument5 pagesTP SI Potentiome TrieWesh ReufPas encore d'évaluation
- Web Exercices Precipitation PDFDocument2 pagesWeb Exercices Precipitation PDFans1390100% (1)
- Chimie TP10 Les Piles ElectrochimiquesDocument3 pagesChimie TP10 Les Piles ElectrochimiquesfayePas encore d'évaluation
- Conduct I Me Trie ChlorureDocument3 pagesConduct I Me Trie ChloruremariePas encore d'évaluation
- 21 - Dissolution Des ÉlectrolytesDocument3 pages21 - Dissolution Des Électrolyteswaxifix224Pas encore d'évaluation
- TD Chimie TERMINALE DDocument38 pagesTD Chimie TERMINALE DAbdoul-lahi Saâdou Moussa100% (8)
- S2 - La Concentration Et Les Solutions Électrolytiques - 1BAC - IntDocument4 pagesS2 - La Concentration Et Les Solutions Électrolytiques - 1BAC - IntMajed GharibPas encore d'évaluation
- Exercice 1: Exercice 5Document2 pagesExercice 1: Exercice 5ahmed talhaPas encore d'évaluation
- S2 - La Concentration Et Les Solutions Electrolytiques - 1BAC - IntDocument4 pagesS2 - La Concentration Et Les Solutions Electrolytiques - 1BAC - IntshaumakharmichealPas encore d'évaluation
- Concentration 3Document2 pagesConcentration 3Med Brini100% (1)
- TP Synthese Et Analyse de L'alunDocument11 pagesTP Synthese Et Analyse de L'alunamelia.marolleau86240Pas encore d'évaluation
- Chlorures Charp VolharDocument2 pagesChlorures Charp VolharAmath FayePas encore d'évaluation
- Exercice Corrigé Chimie Analytique 1Document6 pagesExercice Corrigé Chimie Analytique 1herveissom6Pas encore d'évaluation
- TP - Titrage Des Ions Chlorure Dans Une Eau MinéraleDocument1 pageTP - Titrage Des Ions Chlorure Dans Une Eau MinéraleElouan Berthome LavignottePas encore d'évaluation
- EXO Notion de Couple OxydantDocument2 pagesEXO Notion de Couple OxydantPFE100% (1)
- Séances Du Jour: Allemand Lv2Document1 pageSéances Du Jour: Allemand Lv2Clara VolpatoPas encore d'évaluation
- Un Crossing-Over Inégal Entraine Donc La Duplication D'un Gène Sur Une Chromatide À L'origine D'une Nouvelle Diversité de GamètesDocument1 pageUn Crossing-Over Inégal Entraine Donc La Duplication D'un Gène Sur Une Chromatide À L'origine D'une Nouvelle Diversité de GamètesClara VolpatoPas encore d'évaluation
- Boulangistes Au Régime en Place, Puis Les Arguments Des Républicains Contre Le BoulangismeDocument1 pageBoulangistes Au Régime en Place, Puis Les Arguments Des Républicains Contre Le BoulangismeClara VolpatoPas encore d'évaluation
- S Éance 7: Les Discours Rapportés (Étude de La Langue) : I - Exercice PréliminaireDocument1 pageS Éance 7: Les Discours Rapportés (Étude de La Langue) : I - Exercice PréliminaireClara VolpatoPas encore d'évaluation
- Mon Carnet D'EntrainementDocument12 pagesMon Carnet D'EntrainementClara VolpatoPas encore d'évaluation
- UntitledDocument1 pageUntitledClara VolpatoPas encore d'évaluation
- Autres Questions PoséesDocument1 pageAutres Questions PoséesClara VolpatoPas encore d'évaluation
- Evaluations Des Capacités Expérimentales (E.C.E.) : Etape A 1Document1 pageEvaluations Des Capacités Expérimentales (E.C.E.) : Etape A 1Clara VolpatoPas encore d'évaluation
- Grille D'évaluation en Barème Curseur Pour L'exercice Type 1Document1 pageGrille D'évaluation en Barème Curseur Pour L'exercice Type 1Clara VolpatoPas encore d'évaluation
- Expliquer Comment Le Végétal Chlorophyllien Synthétise Et Achemine Les Matières Organiques Qui Permettront La Germination D'un EmbryonDocument2 pagesExpliquer Comment Le Végétal Chlorophyllien Synthétise Et Achemine Les Matières Organiques Qui Permettront La Germination D'un EmbryonClara VolpatoPas encore d'évaluation
- UntitledDocument1 pageUntitledClara VolpatoPas encore d'évaluation
- Dosages Par Titrage Colorimetrique Titrage Colorimétrique Du Diiode Un Antiseptique Par Le Thiosulfate de SodiumDocument1 pageDosages Par Titrage Colorimetrique Titrage Colorimétrique Du Diiode Un Antiseptique Par Le Thiosulfate de SodiumClara VolpatoPas encore d'évaluation
- PHOTOS DE CLASSE 2020/2021: Mercredi 5 Mai 2021 Et Mercredi 12 Mai 2021Document1 pagePHOTOS DE CLASSE 2020/2021: Mercredi 5 Mai 2021 Et Mercredi 12 Mai 2021Clara VolpatoPas encore d'évaluation
- UntitledDocument1 pageUntitledClara VolpatoPas encore d'évaluation
- PH2SCH06Document3 pagesPH2SCH06chadaPas encore d'évaluation
- Chapitre II Acides Et Bases 2021-2022 Partie 1Document11 pagesChapitre II Acides Et Bases 2021-2022 Partie 1KHEDIM MouradPas encore d'évaluation
- Projet de Fin D'etudes - PDFDocument117 pagesProjet de Fin D'etudes - PDFRacem Loukil100% (2)
- Biomat FicheDocument7 pagesBiomat FicheFRTPas encore d'évaluation
- Terminologie RoutiereDocument14 pagesTerminologie RoutiereAnas MoutmirPas encore d'évaluation
- Joint 1Document2 pagesJoint 1Mohammed Hanoune Kandri RodyPas encore d'évaluation
- TD Alcool 2024 LSLL - WahabdiopDocument4 pagesTD Alcool 2024 LSLL - WahabdiopFrédéric JeffersonPas encore d'évaluation
- Atome IonsDocument3 pagesAtome Ionsmedox hmxPas encore d'évaluation
- Bocaly PDFDocument70 pagesBocaly PDFYousra SbaiaPas encore d'évaluation
- A - Developpement Des MedicamentsDocument63 pagesA - Developpement Des MedicamentsAmal Oulad AliPas encore d'évaluation
- EX1. Calculer L'humidité Relative D'un Certain Volume D'air Humide Dont LaDocument2 pagesEX1. Calculer L'humidité Relative D'un Certain Volume D'air Humide Dont LaOuijdane MaaPas encore d'évaluation
- Cinetique 2Document22 pagesCinetique 2BENARIMA AbdelhakimPas encore d'évaluation
- Trabsfert de Chaleur Par ConvectionDocument74 pagesTrabsfert de Chaleur Par ConvectionMANE SariatuPas encore d'évaluation
- Série 2 S2 2023 12 2 2023Document2 pagesSérie 2 S2 2023 12 2 2023mammarhanae939Pas encore d'évaluation
- TP 2 CalorimetreDocument10 pagesTP 2 Calorimetreabelmomo50% (4)
- Astm D4951-14 (2019)Document8 pagesAstm D4951-14 (2019)Anonh AdikoPas encore d'évaluation
- Citerne Mazout GWDocument12 pagesCiterne Mazout GWismailinesPas encore d'évaluation
- TP Hemolyse S3 BachelorDocument9 pagesTP Hemolyse S3 BachelorSohayb Ait OuallPas encore d'évaluation
- La Succession Stratigraphique Du C.M.N. (Ou R.2.3.) Au Centre de La Sous-Province Cuprifere Shabienne Par J. CailteuxDocument14 pagesLa Succession Stratigraphique Du C.M.N. (Ou R.2.3.) Au Centre de La Sous-Province Cuprifere Shabienne Par J. CailteuxGloria BanzaPas encore d'évaluation
- DS PureSante 10decouvertes 1 PDFDocument28 pagesDS PureSante 10decouvertes 1 PDFYaqoubTouréPas encore d'évaluation
- ?????? ?????mazanza 7 Kou Nouvo. ?????? ?????Document82 pages?????? ?????mazanza 7 Kou Nouvo. ?????? ?????Ronald Fleurelus100% (24)
- Chapitre IDocument31 pagesChapitre Izahramathlouthi127Pas encore d'évaluation
- Matériel GénétiqueDocument7 pagesMatériel GénétiquenasroddinePas encore d'évaluation
- Chimie - Correction TP 02 - Solutions LectrolytiquesDocument2 pagesChimie - Correction TP 02 - Solutions Lectrolytiquesla physique selon le programme Français100% (3)
- 2 - Transformations NucléairesDocument12 pages2 - Transformations Nucléairesreef yousf100% (1)
- SFHH Lista Positiva Desinfectantes 2009Document28 pagesSFHH Lista Positiva Desinfectantes 2009RWEREWPas encore d'évaluation
- Bac 2018 Washington Physique Chimie SpécialitéDocument11 pagesBac 2018 Washington Physique Chimie SpécialitéLETUDIANTPas encore d'évaluation
- Dalle en Beton ArmeDocument2 pagesDalle en Beton Armemathx34694Pas encore d'évaluation
- Cours RMN SolideDocument33 pagesCours RMN Solidemojakovich50% (2)
- 2 Eme Séance Les Glucides Structre Et Propriétés 2021-2022Document13 pages2 Eme Séance Les Glucides Structre Et Propriétés 2021-2022beyoulaya22Pas encore d'évaluation