Académique Documents
Professionnel Documents
Culture Documents
Devoir 4 - Équilibre Et Acidité
Transféré par
Creamy Candy0 évaluation0% ont trouvé ce document utile (0 vote)
27 vues1 pageTitre original
Devoir 4 - Équilibre et acidité
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
27 vues1 pageDevoir 4 - Équilibre Et Acidité
Transféré par
Creamy CandyDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
CPS1 - Devoir de chimie – vendredi 17 février (1h)
Exercice 1 (10 points)
Données : à 25°C pour le couple -HCOOH(aq)/HCOO! (aq)5 , pK "# = 3,75
à 25°C pour le couple -NH$ OH% (aq)/NH& OH(aq)5 , pK "& = 6,00
à 25°C pour le couple -HCℓO(aq)/CℓO! (aq)5 , pK "$ = 7,55
à 25°C, pK ' = 14,0
Masse molaire de l’acide méthanoïque, 𝑀(HCOOH) = 46,0 g. mol!#
On dispose au laboratoire d’une solution d’acide méthanoïque HCOOH dont le titre massique est de 85% et la
densité est de 1,22. On réalise une solution A en versant 5,00 mL de la solution d’acide méthanoïque disponible dans
800,0mL d’eau.
1. Calculer la concentration en acide méthanoïque apporté dans la solution A.
2. Calculer la concentration des espèces chimiques présentes dans la solution A.
3. Calculer le pH de la solution A.
On dispose de 40,0mL d’une solution B d’ions hydroxylammonium NH$ OH% de concentration C( = 0,350 mol. L!#
ainsi que de 20,0mL d’une solution C d’ions chlorate CℓO! de concentration C) = 0,700 mol. L!# .
On mélange les solutions B et C.
4. Déterminer la composition du mélange des solutions B et C.
5. Déterminer le pH de la solution.
Exercice 2 (10 points)
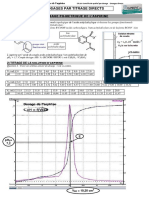
On dose, par suivi pH-métrique, 10,0 mL d’acide phosphorique H$ PO* par une solution de soude (Na% + OH! )+,
de concentration 1,50.10!# mol. L!# . La courbe obtenue expérimentalement pH = 𝑓(V- ), avec V- le volume de
soude versé, est représentée ci-dessous. Sur ce même graphique, est représenté le diagramme de distribution des
espèces acido-basiques de l’acide phosphorique.
1) Attribuer aux courbes 1, 2, 3 et 4 de distribution la formule de l’espèce chimique qui lui est associée en justifiant
rapidement.
2) Déterminer les valeurs des pK " des couples acide/base issues de l’acide phosphorique. Justifier votre démarche.
3) Établir les équations de titrage et les associer aux différentes parties de la courbe, en précisant les volumes V- .
4) Calculer les constantes d’équilibre des équations de titrage et justifier que ces titrages sont successifs ou non.
5) Déterminer la composition de la solution, en pourcentage pour chaque espèce, pour un volume V. = 10,0 mL.
6) Calculer la concentration en H$ PO* apporté.
7) Calculer, pour V. = 0 mL, la concentration des espèces chimiques présentes dans la solution et le pH.
8) Calculer le pH à la deuxième équivalence.
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QPas encore d'évaluation
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 pagesSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 pagesSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Pas encore d'évaluation
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 pagesAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Acides Et Bases PCDocument15 pagesAcides Et Bases PCrkibi.khadija2006Pas encore d'évaluation
- Exercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Document5 pagesExercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Walaa WalaaPas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument2 pagesTD Acide Faible-2024-Lsll - Wahabdiopxydj5wh2wb100% (1)
- Feuille TD N°3Document2 pagesFeuille TD N°3Warren Wany'sPas encore d'évaluation
- Série de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesDocument3 pagesSérie de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesأشرفالمبروكPas encore d'évaluation
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution, 2BAC BIOF, SM, PC Et SVT, Prof JENKAL RACHID Exercice 5Document3 pagesSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution, 2BAC BIOF, SM, PC Et SVT, Prof JENKAL RACHID Exercice 5Hiba MellatiPas encore d'évaluation
- Exercice de DosageDocument1 pageExercice de DosageghizlanaitlabadPas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- TD-Acide Base - PH - WahabdiopDocument3 pagesTD-Acide Base - PH - WahabdiopNDEYE FATOU CISSE NIASSEPas encore d'évaluation
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 pagesSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Pas encore d'évaluation
- 2006 Asie Exo1 Sujet pHPKA 4ptsDocument1 page2006 Asie Exo1 Sujet pHPKA 4ptsla physique selon le programme FrançaisPas encore d'évaluation
- TD Tampon 2019 LSLL WahabdiopDocument2 pagesTD Tampon 2019 LSLL WahabdiopOumou Khaïry DiopPas encore d'évaluation
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 pagesTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhPas encore d'évaluation
- TD CG - 01 Acides BasesDocument5 pagesTD CG - 01 Acides BasesMed BriniPas encore d'évaluation
- Série D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Document8 pagesSérie D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Tawfiq Weld EL Arbi75% (4)
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 pagesSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- Acide Propanoïque (50 Questions ???) : Exercice 5Document3 pagesAcide Propanoïque (50 Questions ???) : Exercice 5essataoufiqPas encore d'évaluation
- Série N°8Document2 pagesSérie N°8Jihad ELPas encore d'évaluation
- Série Acide - BaseDocument6 pagesSérie Acide - BaseMehdi Bnmssd100% (1)
- Sujetbb 12 Spe 29 JanvDocument6 pagesSujetbb 12 Spe 29 JanvAmza FarelPas encore d'évaluation
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- 2012 DS1 Acide Base PDFDocument2 pages2012 DS1 Acide Base PDFFoudil LaouiciPas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- TD Acide Faible-2024-Lsll - WahabdiopDocument4 pagesTD Acide Faible-2024-Lsll - WahabdiopAmadou Oury DialloPas encore d'évaluation
- TD Tampon 2013 lsll-WahabDiopDocument4 pagesTD Tampon 2013 lsll-WahabDiopFy EzahanaPas encore d'évaluation
- Réactions Acido-Basiques PDFDocument9 pagesRéactions Acido-Basiques PDFAzizElheniPas encore d'évaluation
- Chimie 2 PDFDocument8 pagesChimie 2 PDFTarik Mlilas50% (2)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- 2011 Liban Exo3 Sujet AciditeVin 4ptsDocument3 pages2011 Liban Exo3 Sujet AciditeVin 4ptsgrajzgrPas encore d'évaluation
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitPas encore d'évaluation
- Chimie Générale4 PDFDocument50 pagesChimie Générale4 PDFTOUREPas encore d'évaluation
- BAC SM 2008 2018 Acide Et BaseDocument14 pagesBAC SM 2008 2018 Acide Et BaseEL BAKRAOUI YOUSSEF100% (1)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- Transformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1Document6 pagesTransformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1boufdili100% (2)
- Etat D 'Quilibre 1Document1 pageEtat D 'Quilibre 1hamzacrypto080Pas encore d'évaluation
- Laboratoire 3 DÉTERMINATION DE LA CONCENTRATIONDocument11 pagesLaboratoire 3 DÉTERMINATION DE LA CONCENTRATIONKhalil OukebdanePas encore d'évaluation
- Exercices 8Document3 pagesExercices 8charafensamPas encore d'évaluation
- Serie 7 8 Acides Faibles Bases Faibles Solutions TamponsDocument10 pagesSerie 7 8 Acides Faibles Bases Faibles Solutions TamponsBrahim DahaiPas encore d'évaluation
- Solutions Aqueuses IpDocument13 pagesSolutions Aqueuses IpEmmanuel PolvenskyPas encore d'évaluation
- C8-Sol Tampon PDFDocument7 pagesC8-Sol Tampon PDFsKiroxPas encore d'évaluation
- Exercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - CopieDocument1 pageExercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - Copielabiadsihame73Pas encore d'évaluation
- Exercice Mineur-V2-2020-2021Document3 pagesExercice Mineur-V2-2020-2021Sandy GosselinPas encore d'évaluation
- Serie CoronaDocument15 pagesSerie CoronaJoséphine NancassePas encore d'évaluation
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument12 pagesSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDboudhar mohamed0% (1)
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 pagesS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirPas encore d'évaluation