Académique Documents
Professionnel Documents
Culture Documents
2011 Liban Exo3 Sujet AciditeVin 4pts
Transféré par
grajzgrTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2011 Liban Exo3 Sujet AciditeVin 4pts
Transféré par
grajzgrDroits d'auteur :
Formats disponibles
ancien programme
Bac S 2011 Liban http://labolycee.org
EXERCICE 3 : L’ACIDITÉ D’UN VIN (4 points)
L’acidité d’un vin peut être exprimée de deux façons, à partir de son acidité totale ou de
son pH [...]. L’acidité totale est surtout un indicateur des caractéristiques gustatives, alors
que le pH intervient dans la stabilité du vin. L’acidité du vin (pH compris entre 2,7 et 3,7) est
principalement due à la présence d’acides organiques en partie à l’état libre; l’acidité totale
d’un vin est constituée par les acides représentant l’acidité fixe (acides tartrique, malique,
lactique, citrique, etc) et par des molécules représentant l’acidité volatile (essentiellement
l’acide éthanoïque, et l’éthanoate d’éthyle susceptible de libérer l’acide éthanoïque par
saponification) [...].
Le goût aigre de l’acide éthanoïque est perçu lorsque sa concentration est supérieure à
0,6 g.L-1.
D’après « Chimie dans la maison » - Cultures et Techniques
Données :
Masse molaire de l’acide éthanoïque (CH3COOH) : M = 60 g.moL-1
À 25°C : pK A (acide éthanoïque/ion éthanoate) = 4,8
pKA (acide lactique/ion lactate) = 3,9
pKA (ion oxonium/eau) = 0
pKA (eau/ion hydroxyde) =14
produit ionique de l’eau : Ke = 1,0×10−14
1. À propos du texte
1.1. Déterminer la valeur de la concentration molaire en ions oxonium H3O+ d’un vin
dont le pH est égal à 3,0.
1.2. Calculer la concentration molaire de l’acide éthanoïque pour que le goût aigre soit
perçu.
O
1.3. L’acide lactique se forme lors de la fermentation du
vin. Sa formule semi-développée est représentée ci- CH3 CH C
contre.
Recopier cette formule en entourant et nommant les OH OH
groupes caractéristiques.
2. Réaction de l’acide éthanoïque avec l’eau
On dispose d’un volume V = 50 mL d’une solution S d’acide éthanoïque de concentration
molaire en soluté apporté C = 1,0×10-2 mol.L-1 et de pH = 3,4.
2.1. Écrire l’équation de la réaction de l’acide éthanoïque avec l’eau. Tracer le
diagramme de prédominance du couple acide éthanoïque / ion éthanoate et en déduire
l’espèce prédominante dans la solution S.
2.2. Calculer la concentration molaire en ions oxonium H3O+ de la solution S puis
l’avancement final de la réaction (on peut s’aider d’un tableau d’avancement).
2.3. Montrer que la transformation n’est pas totale en calculant son taux d’avancement
final.
ancien programme
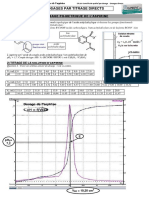
3. Titrage de l’acide éthanoïque par une solution d’hydroxyde de sodium
Au laboratoire, l’étiquette d’un flacon d’une solution d’acide éthanoïque est effacée.
On décide alors d’effectuer un titrage afin de déterminer la concentration molaire de cette
solution.
Pour cela, on dispose d’une solution d’hydroxyde de sodium (Na+ + HO-) de concentration
molaire égale à 1,0×10-2 mol.L-1 et du matériel suivant :
- fioles jaugées de 50 mL et de 100 mL ;
- pipettes jaugées de 5 mL et de 10 mL ;
- bécher de 100 mL ;
- éprouvette graduée de 50 mL ;
- eau déminéralisée.
3.1. Avec la solution d’hydroxyde de sodium ainsi préparée, on procède au titrage de
Va = 20,0 mL de solution d’acide éthanoïque. Les valeurs du pH, en fonction du volume
Vb de solution d’hydroxyde de sodium versé, sont données dans le tableau suivant :
Vb (mL) 0 2,0 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0 18,5
pH 3,4 3,9 4,2 4,4 4,6 4,8 5,0 5,2 5,4 5,75 5,9
Vb (mL) 19,0 19,5 20,0 20,5 21,0 21,5 22,0 24,0 26,0 28,0 30,0
pH 6,1 6,4 8,3 10,3 10,7 10,9 11,0 11,3 11,5 11,6 11,7
3.1.1. Écrire l’équation de la réaction qui s’effectue entre la solution d’acide
éthanoïque et la solution d’hydroxyde de sodium.
3.1.2. Exprimer la constante d’équilibre associée à cette équation, puis la calculer.
3.1.3. Déterminer, graphiquement, sur la courbe donnée en annexe 2 à rendre
avec la copie, les coordonnées du point d’équivalence, en indiquant la méthode
utilisée.
En déduire la concentration molaire ca de la solution d’acide éthanoïque étudiée.
3.2. Pour un volume versé de 10,0 mL de solution d’hydroxyde de sodium, le pH a une
valeur de 4,8.
3.2.1. Calculer la quantité nV(HO-) d’ions hydroxyde versés depuis le début du titrage.
3.2.2. À partir de la valeur du pH, calculer la quantité nR(HO-) d’ions hydroxyde
restants dans la solution.
3.2.3. Comparer nV(HO-) et nR(HO-). Comment peut-on alors qualifier la
transformation qui correspond à ce titrage acido-basique ?
ancien programme
ANNEXE À RENDRE AVEC LA COPIE
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- 2008 Polynesie Exo1 Sujet Acides 7ptsDocument3 pages2008 Polynesie Exo1 Sujet Acides 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Le Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique ChimieDocument6 pagesLe Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique Chimienoha Abdel bassetPas encore d'évaluation
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitPas encore d'évaluation
- Fiches Exercices Titrages-2010Document3 pagesFiches Exercices Titrages-2010Daniel Parnor100% (1)
- TD Exercices-Corrigés PDFDocument21 pagesTD Exercices-Corrigés PDFabdelouahed.rhaouiPas encore d'évaluation
- Exercices 3Transformations Liées à Des Réactions Acido – Basiques Dans Une Solution Aqueuse - CopieDocument1 pageExercices 3Transformations Liées à Des Réactions Acido – Basiques Dans Une Solution Aqueuse - Copielabiadsihame73Pas encore d'évaluation
- Laboratoire 3 DÉTERMINATION DE LA CONCENTRATIONDocument11 pagesLaboratoire 3 DÉTERMINATION DE LA CONCENTRATIONKhalil OukebdanePas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- Transformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Document21 pagesTransformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Abderrazzak ElhaimerPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- 2022 Asie J1 Exo1 Sujet BeerVin Ester Titrage 10pts - 0Document6 pages2022 Asie J1 Exo1 Sujet BeerVin Ester Titrage 10pts - 0GabrielPas encore d'évaluation
- Acides Bases PDFDocument8 pagesAcides Bases PDFHafidi AhmedPas encore d'évaluation
- Réactions Acido-Basiques PDFDocument9 pagesRéactions Acido-Basiques PDFAzizElheniPas encore d'évaluation
- Sujet Physique ChimieDocument2 pagesSujet Physique ChimiemyriamdibbPas encore d'évaluation
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QPas encore d'évaluation
- TD-Acide Base - PH - WahabdiopDocument3 pagesTD-Acide Base - PH - WahabdiopNDEYE FATOU CISSE NIASSEPas encore d'évaluation
- TD-ACIDE-FAIBLE-BASE-FAIBLE-CONSTANTE-DACIDITE-TS2-2023-2024Document12 pagesTD-ACIDE-FAIBLE-BASE-FAIBLE-CONSTANTE-DACIDITE-TS2-2023-2024fallccheikhPas encore d'évaluation
- 2008 Pondichery Exo1 Sujet Ammoniac 7ptsDocument3 pages2008 Pondichery Exo1 Sujet Ammoniac 7ptsla physique selon le programme Français100% (1)
- Exercice 1 (7 Points) Propriétés D'un AlcoolDocument7 pagesExercice 1 (7 Points) Propriétés D'un AlcoolKeys of H.A.Pas encore d'évaluation
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArPas encore d'évaluation
- PH Solutions Aqueuses 2024-Lsll - WahabdiopDocument2 pagesPH Solutions Aqueuses 2024-Lsll - WahabdiopAmadou Oury DialloPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau Oxygénéeأمال بلقاسم100% (1)
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéefatimazahraPas encore d'évaluation
- Serie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020Document4 pagesSerie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020kathyPas encore d'évaluation
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- 5 Reactions Acido BasiquesDocument3 pages5 Reactions Acido BasiquesYouness SinePas encore d'évaluation
- Dosage Acide Base IndicDocument3 pagesDosage Acide Base IndicAs Ma50% (2)
- Solutions Aqueuses Acides Et BasiquesDocument3 pagesSolutions Aqueuses Acides Et BasiquesLiza mezariPas encore d'évaluation
- Série N°8Document2 pagesSérie N°8Jihad ELPas encore d'évaluation
- Spe Physique Chimie 2022 1 PDFDocument18 pagesSpe Physique Chimie 2022 1 PDFabdallah kheirallahPas encore d'évaluation
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 pagesAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimPas encore d'évaluation
- Acides Et Bases PcDocument15 pagesAcides Et Bases Pcrkibi.khadija2006Pas encore d'évaluation
- Cours de VirologieDocument5 pagesCours de VirologieFrancisca AgboviPas encore d'évaluation
- Banque D'exercicesDocument37 pagesBanque D'exercicesyves100% (4)
- Série d'Éxercices Des Transformations Associées Aux Réactions Acido-basiques2024Document3 pagesSérie d'Éxercices Des Transformations Associées Aux Réactions Acido-basiques2024sassin2006Pas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- Acide Base +dosage1Document2 pagesAcide Base +dosage1hamzacrypto080Pas encore d'évaluation
- 201701271158125 (3)Document9 pages201701271158125 (3)Ali RammalPas encore d'évaluation
- TD Tampon 2013 lsll-WahabDiopDocument4 pagesTD Tampon 2013 lsll-WahabDiopFy EzahanaPas encore d'évaluation
- C7 Af BF WahabDiopDocument5 pagesC7 Af BF WahabDiopGaye BachirPas encore d'évaluation
- Série DosageDocument8 pagesSérie DosageAicha Daou100% (1)
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 pagesSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Pas encore d'évaluation
- TD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. MaghchicheDocument4 pagesTD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. Maghchicheromaissa benchadiPas encore d'évaluation
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 pagesSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinPas encore d'évaluation
- Série Acide - BaseDocument6 pagesSérie Acide - BaseMehdi Bnmssd100% (1)
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- Transformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1Document6 pagesTransformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1boufdili100% (1)
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- TitrageDocument3 pagesTitrageelhijaziyoussefPas encore d'évaluation
- Correction Lexperience de Millikan Revisitee Par Des Chercheurs SuedoisDocument5 pagesCorrection Lexperience de Millikan Revisitee Par Des Chercheurs SuedoisgrajzgrPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- 2023 AmNord J1 Exo1 Correction SkateRC 11ptsDocument4 pages2023 AmNord J1 Exo1 Correction SkateRC 11ptsgrajzgrPas encore d'évaluation
- 2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsDocument2 pages2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsgrajzgrPas encore d'évaluation
- Correction Un Polymere BiodegradableDocument5 pagesCorrection Un Polymere BiodegradablegrajzgrPas encore d'évaluation
- 2012 Asie Exo3 Sujet Electrolyse 4ptsDocument2 pages2012 Asie Exo3 Sujet Electrolyse 4ptsgrajzgrPas encore d'évaluation
- 2023 Asie J2 Exo1 Correction VitamineC 9ptsDocument4 pages2023 Asie J2 Exo1 Correction VitamineC 9ptsgrajzgrPas encore d'évaluation
- 2022 Polynesie J1 ExoA Correction TracteurGravitationnel 5pts 0Document2 pages2022 Polynesie J1 ExoA Correction TracteurGravitationnel 5pts 0grajzgrPas encore d'évaluation
- 2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsDocument3 pages2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsgrajzgrPas encore d'évaluation
- 2023 AmNord J1 Exo1 Sujet SkateRC 11pts - 0Document6 pages2023 AmNord J1 Exo1 Sujet SkateRC 11pts - 0grajzgrPas encore d'évaluation
- Programme Mars Avril 2024Document1 pageProgramme Mars Avril 2024grajzgrPas encore d'évaluation
- 2011 Reunion Exo1 Correction Volta 6 5ptsDocument2 pages2011 Reunion Exo1 Correction Volta 6 5ptsgrajzgrPas encore d'évaluation
- 2023 09 Polynesie Exo1 Sujet RC Millikan 11ptsDocument5 pages2023 09 Polynesie Exo1 Sujet RC Millikan 11ptsgrajzgrPas encore d'évaluation
- 2011 Antilles Exo2 Sujet PileSuperC 5 5pointsDocument2 pages2011 Antilles Exo2 Sujet PileSuperC 5 5pointsgrajzgrPas encore d'évaluation
- 2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsDocument3 pages2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsgrajzgrPas encore d'évaluation
- Chimie-Dosages Par TitragesDocument35 pagesChimie-Dosages Par TitragesgrajzgrPas encore d'évaluation
- 2022 Amsud J2 Exo1 Sujet Airbag 10ptsDocument6 pages2022 Amsud J2 Exo1 Sujet Airbag 10ptsgrajzgrPas encore d'évaluation
- Structure Optimisation Chimie Organique ExercicesDocument6 pagesStructure Optimisation Chimie Organique Exercicesmhannad305Pas encore d'évaluation
- 2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsDocument4 pages2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsgrajzgrPas encore d'évaluation
- 2019 11 NelleCaledo Exo3 Sujet NH4NO3 Conducti 5ptsDocument2 pages2019 11 NelleCaledo Exo3 Sujet NH4NO3 Conducti 5ptsgrajzgrPas encore d'évaluation
- 2011 CtresEtrangers Exo2 Sujet PileCitron Electrolyse 6 5ptsDocument4 pages2011 CtresEtrangers Exo2 Sujet PileCitron Electrolyse 6 5ptsgrajzgrPas encore d'évaluation
- 2022-CentresEtrangers2-J2-Exo1-Sujet-CondensateurAccelerateur-10pts 2Document7 pages2022-CentresEtrangers2-J2-Exo1-Sujet-CondensateurAccelerateur-10pts 2Tibo SansonPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- 2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsDocument4 pages2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsgrajzgrPas encore d'évaluation
- 2009 Afrique Exo2 Sujet Neptune Satellites 5 5ptsDocument3 pages2009 Afrique Exo2 Sujet Neptune Satellites 5 5ptsgrajzgrPas encore d'évaluation
- SuitesDocument12 pagesSuitesgrajzgrPas encore d'évaluation
- Caracterisation Mecanique 13.20.22Document31 pagesCaracterisation Mecanique 13.20.22Joseph AmondPas encore d'évaluation
- Faculte Polytechnique Horaires Des Cours-4Document19 pagesFaculte Polytechnique Horaires Des Cours-4Nathan KibilaPas encore d'évaluation
- Rapport Controle Non DestructifDocument25 pagesRapport Controle Non DestructifThe MaverickPas encore d'évaluation
- Série Les PilesDocument4 pagesSérie Les Pilesookayokay15Pas encore d'évaluation
- TE-cours-atomes-chap4 - 2018-2019Document21 pagesTE-cours-atomes-chap4 - 2018-2019TabbaraPas encore d'évaluation
- Polymères P1Document32 pagesPolymères P1Hadjer ZitounePas encore d'évaluation
- DS5 TC 5Document5 pagesDS5 TC 5Mouhibi AbdellahPas encore d'évaluation
- CYCLE DE L - AZOTE - PDF Version 1Document2 pagesCYCLE DE L - AZOTE - PDF Version 1Red lonewolfPas encore d'évaluation
- Chapitre 4 Determination de Formule Brute Isomerie PlaneDocument23 pagesChapitre 4 Determination de Formule Brute Isomerie PlaneNatacha N'GUESSANPas encore d'évaluation
- Absorption Atomique ExoDocument2 pagesAbsorption Atomique ExoZahra l زهرة67% (3)
- TSpe TPC3 TitragesConducti PHDocument4 pagesTSpe TPC3 TitragesConducti PHMouhamed NadirPas encore d'évaluation
- Examen 2017 Normal CorrigeDocument7 pagesExamen 2017 Normal Corrigefawzi badiPas encore d'évaluation
- Chimie C 2018-2Document7 pagesChimie C 2018-2Iharena MorasataPas encore d'évaluation
- DS 1 Octobre 2020Document3 pagesDS 1 Octobre 2020k2zn5n6zsjPas encore d'évaluation
- Dec09 414Document6 pagesDec09 414Bettahar MostafaPas encore d'évaluation
- 11 El Gitano PIANODocument26 pages11 El Gitano PIANOMarta de CastroPas encore d'évaluation
- ThermochimieDocument20 pagesThermochimiesidi100% (1)
- Acide Et Base - Dosage (Récupération Automatique)Document39 pagesAcide Et Base - Dosage (Récupération Automatique)Driss Droussi100% (3)
- TP Dosage Par Etalonnage-1Document9 pagesTP Dosage Par Etalonnage-1Saaid LhajPas encore d'évaluation
- Physique Fiche Révision Eau Et BasesDocument3 pagesPhysique Fiche Révision Eau Et BasesLou ann Le bidrePas encore d'évaluation
- Mémoire Kallel Et Djezare 2019Document14 pagesMémoire Kallel Et Djezare 2019BENSLIMANEOTHMANEPas encore d'évaluation
- FR-FR P012 PDFDocument6 pagesFR-FR P012 PDFmedkom2000Pas encore d'évaluation
- Devoir de PCT 4èDocument1 pageDevoir de PCT 4èLAWSON NICOLASPas encore d'évaluation
- Chimie Générale 1Document2 pagesChimie Générale 1zgazga amir100% (1)
- 1 CDocument9 pages1 Cأحمد الميميونيPas encore d'évaluation
- TD3+Solution Thermodynamique Et Cinétique ChimiqueDocument6 pagesTD3+Solution Thermodynamique Et Cinétique ChimiqueAmira MiraPas encore d'évaluation
- Fiche R4000 RS FR BDDocument1 pageFiche R4000 RS FR BDDouimni AyoubPas encore d'évaluation
- Granulats - Caractéristiques Mécaniques, Physiques Et Chimiques:tome 3Document3 pagesGranulats - Caractéristiques Mécaniques, Physiques Et Chimiques:tome 3Paul Junior NtengaPas encore d'évaluation
- Chapitre 2 La Cinétique EnzymatiqueDocument15 pagesChapitre 2 La Cinétique EnzymatiqueAbdouli RoukayaPas encore d'évaluation
- TP ConductimetrieDocument1 pageTP ConductimetrieIndai apekoPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- L'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaD'EverandL'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Cahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesD'EverandCahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesPas encore d'évaluation
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Cancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsD'EverandCancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsPas encore d'évaluation
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Chevaux de Fer - Locomotives Agricoles et Tracteurs LégendairesD'EverandChevaux de Fer - Locomotives Agricoles et Tracteurs LégendairesPas encore d'évaluation
- La pensée dirigée: Traité sur le raisonnement et les logiquesD'EverandLa pensée dirigée: Traité sur le raisonnement et les logiquesÉvaluation : 5 sur 5 étoiles5/5 (2)