Académique Documents
Professionnel Documents
Culture Documents
2023 Asie J2 Exo1 Correction VitamineC 9pts
Transféré par
grajzgrCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2023 Asie J2 Exo1 Correction VitamineC 9pts
Transféré par
grajzgrDroits d'auteur :
Formats disponibles
Bac Asie 2023 Jour 2 EXERCICE 1 – L’IMPORTANCE DE LA VITAMINE C (9 points)
Correction © https://labolycee.org
Partie A – Dégradation de la vitamine C dans un comprimé
L’acide ascorbique et ses couples acide-base
La proposition c) convient.
Préparation de la solution titrante
2. On procède à une dilution.
Solution mère : Solution fille :
V0 = ? VB = 200,0 mL
C0 = 0,200 mol.L -1 CB = 1,00×10–2 mol.L-1
Au cours d’une dilution, il y a conservation de la quantité de soluté ainsi n0 = nB
C0.V0 = CB.VB
C .V
V0 = B B
C0
1,00 10−2 mol.L−1 200 mL
V0 = = 10,0 mL
0, 200 mol.L−1
3. Pour mesurer le volume à prélever V0 on utilise une pipette jaugée de 10,0 mL.
Pour mesurer le volume de la solution fille VB, on utilise une fiole jaugée de 200,0 mL.
Titrage de la solution SA
4.Écrire l’équation de la réaction de support du titrage avec les notations simplifiées AH2,
AH– et justifier qu’il s’agit d’une transformation acide-base au sens de Brønsted.
L’acide du couple AH2/AH– cède un proton H+ à la base du couple H2O/HO–.
AH2 + HO– → AH– + H2O
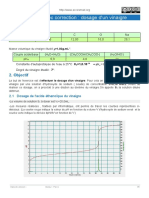
5. Justifier le changement de pente observé sur le graphique, en s’appuyant sur les
conductivités molaires ioniques.
Avant l’équivalence des ions Na+ sont apportés dans le milieu et des ions AH– sont formés grâce
à la consommation des ions HO–. La conductivité augmente.
Au-delà de l’équivalence, les ions Na+ continuent d’être ajoutés, et comme tout AH2 a été
consommé alors les ions HO– ne sont plus consommés et il ne se forme plus d’ions AH–. Les
ions HO– apparaissent dans le milieu. Comme λ(HO–) > λ(AH–) alors la conductivité augmente
plus fortement.
6. Déterminer le volume VBE à l’équivalence.
On trace les deux droites moyennes passant au plus près des points expérimentaux. Le volume
équivalent est égal à l’abscisse du point d’intersection. On lit VBE = 12,0 mL
7. En déduire la valeur de la masse m de vitamine C dans le comprimé resté à l’air libre et
vérifier que cette valeur est comprise entre 190 mg et 230 mg.
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques.
nHO- versée = nAH2 initiale (dans VA = 20,0 mL de la solution SA)
mAH2
CB.VBE =
M AH2
mAH2 = CB.VBE.MAH2
Cette masse ne représente qu’un dixième de la masse du comprimé puisque l’on a titré
seulement VA = 20,0 mL des V = 200,0 mL de la solution SA.
mcomprimé = 10 mAH2
mcomprimé = 10 × 1,00×10–2 × 12,0×10–3 × 176,1 = 0,211 g = 211 mg, valeur cohérente avec
l’encadrement proposé.
8. Justifier, à partir de l’information fournie par l’emballage au sujet de chaque comprimé,
qu’une réaction de la vitamine C a bien eu lieu.
L’emballage indique une masse de 250 mg, or le titrage a démontré que le cachet ne contenait
plus que 211 mg. Une partie de l’acide ascorbique a été consommée par une réaction qui a eu
lieu à l’air libre.
Partie B – étude cinétique de la dégradation de la vitamine C dans un jus d’orange.
9. Écrire les demi-équations correspondant aux couples mis en jeu lors de la dégradation
de la vitamine C par le dioxygène de l’air et montrer que l’équation de l’oxydation de la
vitamine C s’écrit : 2 C6H8O6(aq) + O2(g) → 2 C6H6O6(aq) + 2 H2O(l)
Réduction du dioxygène O2(g) + 4 e– + 4H+ = 2 H2O(l)
Oxydation de l’acide ascorbique C6H8O6(aq) = C6H6O6(aq) + 2 H+ + 2 e– )X2
______________________________________
2 C6H8O6(aq) + O2(g) → 2 C6H6O6(aq) + 2 H2O(l)
10. Définir la vitesse volumique de disparition de la vitamine C.
d [C6H8O6 ]
v disp = −
dt
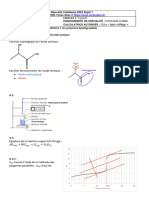
11. À partir du graphique de la figure 2, décrire qualitativement l’évolution de la vitesse de
disparition de la vitamine C en fonction du temps, à une température donnée, et faire le
lien avec un facteur cinétique à préciser.
d [C6H8O6 ]
(t) est égale au coefficient directeur de la tangente à la courbe représentative de
dt
d [C6H8O6 ]
[C6H8O6] à la date t. La fonction [C6H8O6](t) est décroissante donc (t) a une valeur
dt
négative.
d [C6H8O6 ]
Initialement la tangente est très inclinée donc (t) a une valeur fortement négative, la
dt
vitesse de consommation est grande.
d [C6H8O6 ]
Après une durée élevée alors la tangente est presque horizontale alors (t) est
dt
presque nulle, la vitesse est nulle, la réaction est terminée.
La vitesse de disparition diminue au cours du temps.
Cela est dû au facteur cinétique concentration en réactif C6H8O6.
La concentration diminue donc la vitesse diminue.
12. Déterminer graphiquement la vitesse volumique de disparition de la vitamine C à la
température T1 = 25°C à la date t1 = 60 h. L’exprimer en mmol.L-1.h-1.
d [C6H8O6 ] [C H O ]( t ) − [C6H8O 6 ]( t A )
v disp = − − 6 8 6 B
dt tB − t A
0 − 1, 28 mmol.L-1
v disp =− = 1, 4 10 −2 mmol.L−1.h−1
91 − 0 h
A (0 ; 1,28)
B (91 ; 0)
t1/2
13. Déterminer graphiquement le temps t1/2 de demi-réaction à la température T1 = 25°C et
vérifier que cette valeur est cohérente avec celle annoncée dans le texte introductif de la
partie B.
À la date t = t1/2, l’avancement est égal à la moitié de sa valeur finale.
La vitamine C est réactif limitant, le dioxygène est en excès.
Pour t1/2 [C6H8O6]t1/2 = [C6H8O6]initiale / 2, on lit graphiquement t1/2 = 24 h.
14. À partir de la figure2, en comparant les deux courbes, donner un deuxième facteur
cinétique, et indiquer pourquoi il est préférable de ne pas laisser le jus d’orange sur la
table du petit déjeuner.
Les courbes montrent que la baisse de température conduit à augmenter la durée nécessaire
pour que la vitamine C soit totalement consommée.
Le jus d’orange laissé sur une table se trouve à une température plus élevée que conservé au
réfrigérateur ; ainsi la vitamine C sera consommée plus vite sur la table.
Partie C – Vitamine C dans les crèmes
15. Justifier le fait que des taches colorées peuvent apparaître, comme indiqué dans la
recommandation n°1.
L’oxydation de la vitamine C par les ions cuivre Cu2+ conduit à la formation d’atomes de cuivre
Cu qui doivent être responsables des taches colorées.
16. Établir le diagramme de prédominance pour les couples AH2/AH– et AH–/A2–.
AH2 AH– A2– pH
4,1 11,8
17 Évaluer la valeur du rapport
AH2 pour la valeur de pH indiquée et justifier la
AH−
recommandation n°2 portant sur une valeur de pH à ne pas dépasser.
Le candidat est invité à présenter sa démarche et à faire preuve d’esprit critique.
AH−
pH = pKA2 + log
AH2
AH−
log = pH – pKA2
AH2
AH−
= 10pH – pKA2
2
AH
AH2 = 10–pH + pKA2
AH
−
AH2 = 10–3,5 + 4,1 = 100,6 = 4 donc [AH2] = 4 [AH–] pour un pH de 3,5.
AH−
Comme l’indique la recommandation n°2, à un tel pH on a bien la vitamine C essentiellement
sous sa forme acide. Cependant avec un pH plus acide on pourrait encore augmenter la
proportion d’acide AH2.
Par exemple avec un pH = 3,1, on aurait [AH2] = 10 [AH–], ce qui serait préférable.
Vous aimerez peut-être aussi
- TP Dosage Par Conductimetrie Du Destop Correction Du TPDocument5 pagesTP Dosage Par Conductimetrie Du Destop Correction Du TPhhedfi100% (2)
- 2023 Asie J2 Exo1 Correction VitamineC 9ptsDocument4 pages2023 Asie J2 Exo1 Correction VitamineC 9ptsMahdi GoddiPas encore d'évaluation
- DS2 Tspé 2020-2021-5Document5 pagesDS2 Tspé 2020-2021-5hanaemaaroufPas encore d'évaluation
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 pagesDM16 1112 - Dosage PH Metrique Es PDFEmma LovaPas encore d'évaluation
- Chimie D Chap14 Correction ExosDocument4 pagesChimie D Chap14 Correction ExosSOULA CHAHINAZPas encore d'évaluation
- 2016 AmSud Exo2 Correction Benzaldehyde 9ptsDocument5 pages2016 AmSud Exo2 Correction Benzaldehyde 9ptsShanthini JekumarPas encore d'évaluation
- 5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFDocument5 pages5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFkimmikPas encore d'évaluation
- DSFR 2 Bac 4Document3 pagesDSFR 2 Bac 4Mouhibi AbdellahPas encore d'évaluation
- Chapitre VI Réaction ABDocument6 pagesChapitre VI Réaction ABSarah DiomandePas encore d'évaluation
- DS n6 CorrectionDocument2 pagesDS n6 CorrectionŤăhã ÊìîPas encore d'évaluation
- Exercices de Révision C132Document18 pagesExercices de Révision C132abraham LincolnPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques - Bac Math (2013-2014) MR Barhoumi EzzedineDocument5 pagesDevoir de Synthèse N°2 - Sciences Physiques - Bac Math (2013-2014) MR Barhoumi EzzedineWajih M'likiPas encore d'évaluation
- Acido Basiques Cours TitrageDocument16 pagesAcido Basiques Cours Titrageالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Projet CRDocument9 pagesProjet CRMalouda MerzkaniPas encore d'évaluation
- Sujet SciencesDocument6 pagesSujet SciencesLina LamouchiPas encore d'évaluation
- 2023 Liban J1 Exo2 Correction Assouplissant 5ptsDocument3 pages2023 Liban J1 Exo2 Correction Assouplissant 5ptsfatimazahramadanialaoui983Pas encore d'évaluation
- Ach13 Corrige ExercicesDocument3 pagesAch13 Corrige ExercicesmohamedPas encore d'évaluation
- F Spect P 10 CorrigeDocument2 pagesF Spect P 10 CorrigeMohamed EL AminePas encore d'évaluation
- Sans TitreDocument3 pagesSans TitreouidadPas encore d'évaluation
- DS1 S2 SM Pour MoiDocument4 pagesDS1 S2 SM Pour MoiHassanEssoufiPas encore d'évaluation
- PC C2017 CorDocument10 pagesPC C2017 Corrktm.avotraPas encore d'évaluation
- Dev CON2 4M 2020 2021 (Corrigé)Document14 pagesDev CON2 4M 2020 2021 (Corrigé)Barhoumi MouradPas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- Inverser Le SensDocument19 pagesInverser Le Sensmohamed laghribPas encore d'évaluation
- Solutions Aqueuses IpDocument13 pagesSolutions Aqueuses IpEmmanuel PolvenskyPas encore d'évaluation
- Dosage Acidobasique - DM CorrigéDocument3 pagesDosage Acidobasique - DM CorrigéHanae MansouriPas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- 2023 Reunion J1 Exo1 Correction EauPoules 9ptsDocument4 pages2023 Reunion J1 Exo1 Correction EauPoules 9ptstom.detres3Pas encore d'évaluation
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Killian - 2022 - Tp1Document9 pagesKillian - 2022 - Tp1amandine gaianiPas encore d'évaluation
- 2023 Liban J1 Exo2 Sujet Assouplissant 5ptsDocument3 pages2023 Liban J1 Exo2 Sujet Assouplissant 5ptslounabonavPas encore d'évaluation
- 4-Corrige Bac Blanc SP s2Document6 pages4-Corrige Bac Blanc SP s2el hadji thierno dioumPas encore d'évaluation
- Bb2018 Corrige SiteDocument7 pagesBb2018 Corrige SitedimaPas encore d'évaluation
- Acide Et Base - Dosage (Récupération Automatique)Document39 pagesAcide Et Base - Dosage (Récupération Automatique)Driss Droussi100% (3)
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 pagesCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauPas encore d'évaluation
- PH Des Solutions Aqueuses 023 0Document10 pagesPH Des Solutions Aqueuses 023 0km.aouadiPas encore d'évaluation
- Bac D PCDocument118 pagesBac D PCtanjiaPas encore d'évaluation
- TP D'éléctrochimieDocument7 pagesTP D'éléctrochimieHanou BouPas encore d'évaluation
- Methode GranDocument29 pagesMethode GranASMAA KherrazPas encore d'évaluation
- Correction de DSN2 Bac 2020..Document3 pagesCorrection de DSN2 Bac 2020..dahnenanisPas encore d'évaluation
- DS 1 CorrigéDocument3 pagesDS 1 CorrigéFethi BorsaliPas encore d'évaluation
- Exo Titrage AmmoniacDocument6 pagesExo Titrage AmmoniacMed BriniPas encore d'évaluation
- TransReaAcideBaseExercices 16-17 PDFDocument7 pagesTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- U C A D D: Exercice 1Document5 pagesU C A D D: Exercice 1Lindeltaylor DioufPas encore d'évaluation
- Livre Vers Le Bacc T2Document27 pagesLivre Vers Le Bacc T2Hanine Hmida50% (2)
- Exercice Corrigé Sur DosageDocument5 pagesExercice Corrigé Sur DosageIkram MgPas encore d'évaluation
- R2013SM PDFDocument9 pagesR2013SM PDFmjidooooPas encore d'évaluation
- Devoir de Synthese N°2: Epreuve: Sciences PhysiquesDocument5 pagesDevoir de Synthese N°2: Epreuve: Sciences PhysiquesNour NessahPas encore d'évaluation
- Sujet Chimie FMSB 2004Document10 pagesSujet Chimie FMSB 2004Bile DjetouanPas encore d'évaluation
- TP Chimie PhysiqueDocument19 pagesTP Chimie Physiquemeriem.bouaouda7102Pas encore d'évaluation
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques Chimie PH Et Dosage Physique Oscillations Mécaniques - Bac Sciences Exp (2012-2013) MR EL Hafi MustaphaDocument4 pagesDevoir de Synthèse N°2 - Sciences Physiques Chimie PH Et Dosage Physique Oscillations Mécaniques - Bac Sciences Exp (2012-2013) MR EL Hafi MustaphaFelhi mokhtarPas encore d'évaluation
- Série TD N°2 Chimie Des Surfaces Plus CorrectionDocument10 pagesSérie TD N°2 Chimie Des Surfaces Plus CorrectionKawthar100% (5)
- Equilibre ChimiqueDocument5 pagesEquilibre ChimiqueJabri ImenePas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2Document5 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2MOSTAFA HABIRKOUPas encore d'évaluation
- TD Acide Base 24 Fevrier 2016Document10 pagesTD Acide Base 24 Fevrier 2016Tkra G Sil100% (1)
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR RIDHA BEN YAHMEDDocument6 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR RIDHA BEN YAHMEDjbeliee jbeliPas encore d'évaluation
- 2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsDocument2 pages2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsgrajzgrPas encore d'évaluation
- 2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsDocument3 pages2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsgrajzgrPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- 2023 AmNord J1 Exo1 Correction SkateRC 11ptsDocument4 pages2023 AmNord J1 Exo1 Correction SkateRC 11ptsgrajzgrPas encore d'évaluation
- Correction Lexperience de Millikan Revisitee Par Des Chercheurs SuedoisDocument5 pagesCorrection Lexperience de Millikan Revisitee Par Des Chercheurs SuedoisgrajzgrPas encore d'évaluation
- 2022 Polynesie J1 ExoA Correction TracteurGravitationnel 5pts 0Document2 pages2022 Polynesie J1 ExoA Correction TracteurGravitationnel 5pts 0grajzgrPas encore d'évaluation
- Correction Un Polymere BiodegradableDocument5 pagesCorrection Un Polymere BiodegradablegrajzgrPas encore d'évaluation
- 2012 Asie Exo3 Sujet Electrolyse 4ptsDocument2 pages2012 Asie Exo3 Sujet Electrolyse 4ptsgrajzgrPas encore d'évaluation
- 2023 09 Polynesie Exo1 Sujet RC Millikan 11ptsDocument5 pages2023 09 Polynesie Exo1 Sujet RC Millikan 11ptsgrajzgrPas encore d'évaluation
- Programme Mars Avril 2024Document1 pageProgramme Mars Avril 2024grajzgrPas encore d'évaluation
- 2011 Antilles Exo2 Sujet PileSuperC 5 5pointsDocument2 pages2011 Antilles Exo2 Sujet PileSuperC 5 5pointsgrajzgrPas encore d'évaluation
- 2011 Reunion Exo1 Correction Volta 6 5ptsDocument2 pages2011 Reunion Exo1 Correction Volta 6 5ptsgrajzgrPas encore d'évaluation
- 2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsDocument3 pages2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsgrajzgrPas encore d'évaluation
- Chimie-Dosages Par TitragesDocument35 pagesChimie-Dosages Par TitragesgrajzgrPas encore d'évaluation
- 2022-CentresEtrangers2-J2-Exo1-Sujet-CondensateurAccelerateur-10pts 2Document7 pages2022-CentresEtrangers2-J2-Exo1-Sujet-CondensateurAccelerateur-10pts 2Tibo SansonPas encore d'évaluation
- 2019 11 NelleCaledo Exo3 Sujet NH4NO3 Conducti 5ptsDocument2 pages2019 11 NelleCaledo Exo3 Sujet NH4NO3 Conducti 5ptsgrajzgrPas encore d'évaluation
- 2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsDocument4 pages2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsgrajzgrPas encore d'évaluation
- 2023 AmNord J1 Exo1 Sujet SkateRC 11pts - 0Document6 pages2023 AmNord J1 Exo1 Sujet SkateRC 11pts - 0grajzgrPas encore d'évaluation
- 2022 Amsud J2 Exo1 Sujet Airbag 10ptsDocument6 pages2022 Amsud J2 Exo1 Sujet Airbag 10ptsgrajzgrPas encore d'évaluation
- 2011 CtresEtrangers Exo2 Sujet PileCitron Electrolyse 6 5ptsDocument4 pages2011 CtresEtrangers Exo2 Sujet PileCitron Electrolyse 6 5ptsgrajzgrPas encore d'évaluation
- Structure Optimisation Chimie Organique ExercicesDocument6 pagesStructure Optimisation Chimie Organique Exercicesmhannad305Pas encore d'évaluation
- 2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsDocument4 pages2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsgrajzgrPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- SuitesDocument12 pagesSuitesgrajzgrPas encore d'évaluation
- 2009 Afrique Exo2 Sujet Neptune Satellites 5 5ptsDocument3 pages2009 Afrique Exo2 Sujet Neptune Satellites 5 5ptsgrajzgrPas encore d'évaluation
- 2011 Liban Exo3 Sujet AciditeVin 4ptsDocument3 pages2011 Liban Exo3 Sujet AciditeVin 4ptsgrajzgrPas encore d'évaluation
- Chapitre 3 Reaction ABDocument4 pagesChapitre 3 Reaction ABkimoPas encore d'évaluation
- Inverser Le SensDocument19 pagesInverser Le Sensmohamed laghribPas encore d'évaluation
- Indicateurs Colorés de PHDocument5 pagesIndicateurs Colorés de PHSalah Eddine DjilaniPas encore d'évaluation
- Correction QCMs EntrainementDocument12 pagesCorrection QCMs EntrainementMEed E-tanPas encore d'évaluation
- Exercices 1, Réactions Acido-Basique, Chtoukaphysique - 2Document1 pageExercices 1, Réactions Acido-Basique, Chtoukaphysique - 2boudhar mohamedPas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- Annale de Chimie (Comores)Document10 pagesAnnale de Chimie (Comores)Antoine G1Pas encore d'évaluation
- Série 1Document7 pagesSérie 1chadaPas encore d'évaluation
- Controle Du PH Solution Tampon SMDocument3 pagesControle Du PH Solution Tampon SMcherryane0203Pas encore d'évaluation
- 1D1S Tle D Ceg2 PobèDocument4 pages1D1S Tle D Ceg2 PobèKenneth HESSOUPas encore d'évaluation
- TP #1 TabDocument3 pagesTP #1 TabNarimane DendenPas encore d'évaluation
- Acide-Base.1.Document2 pagesAcide-Base.1.FILALI AOUAL OumaimaPas encore d'évaluation
- Reactiviter Chim CourDocument251 pagesReactiviter Chim CourYounesse Saad EddinePas encore d'évaluation
- Devoir de Revision2 2023bac Math DefDocument5 pagesDevoir de Revision2 2023bac Math DefNour NessahPas encore d'évaluation
- Ts Chi 1 CorrectionexocoursDocument3 pagesTs Chi 1 CorrectionexocoursfePas encore d'évaluation
- Module Complément de Formation en Chimie Réactions Acido BasiquesDocument29 pagesModule Complément de Formation en Chimie Réactions Acido BasiquesyounesPas encore d'évaluation
- Questions de Cours en ChimieDocument17 pagesQuestions de Cours en ChimieJaynito EtinnePas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiPas encore d'évaluation
- Cours Dosage Acide Base 3Document8 pagesCours Dosage Acide Base 3Boussetta ZouhaierPas encore d'évaluation
- Acide Base PDFDocument26 pagesAcide Base PDFFoudil Laouici100% (1)
- Equilibre Entre Phase AqueuseDocument42 pagesEquilibre Entre Phase AqueuseImane AbdounPas encore d'évaluation
- Mini Polycopié de BiochimieDocument85 pagesMini Polycopié de BiochimieSamuel Betobaye DjikoinguéPas encore d'évaluation
- Equilibre ChimiqueDocument42 pagesEquilibre ChimiqueTrekOff OfficielPas encore d'évaluation
- Baccalaur at Technologique 2022 - STL - Physique Chimie Et Math Matiques 114257 - 0Document22 pagesBaccalaur at Technologique 2022 - STL - Physique Chimie Et Math Matiques 114257 - 0admin efbPas encore d'évaluation
- 2022 Asie J2 ExoA Sujet AcFormique H2 5ptsDocument3 pages2022 Asie J2 ExoA Sujet AcFormique H2 5ptsShanthini JekumarPas encore d'évaluation
- Devoir de Physique BacDocument7 pagesDevoir de Physique BachamadioPas encore d'évaluation
- 6 Exercices Réactions Acido-Basique 2Document1 page6 Exercices Réactions Acido-Basique 2Alaoui Abdallah0% (1)
- Instructions - PC - BIOF-TC & 1bacDocument45 pagesInstructions - PC - BIOF-TC & 1bacAyoub Toumi100% (1)