Académique Documents
Professionnel Documents
Culture Documents
Ach13 Corrige Exercices
Transféré par
mohamedCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ach13 Corrige Exercices
Transféré par
mohamedDroits d'auteur :
Formats disponibles
ACH13 – CORRIGÉ DES EXERCİCES
Exercice 3 page 478
1. On doit utiliser la loi de Kohlrausch : σsolution = σ1 + σ2 + … = = λi × ci avec σsolution la conductivité de la solution en S.
m-1, λi les conductivités ioniques molaires en S. m2. mol-1 et Ci les concentrations molaires en mol. m-3.
2.
Exercice 4 page 478
La solution S a pour concentration 0,35.10-2 mo.L-1.
σS
CS
Exercice 5 page 478
1. La conductivité de la solution vaut :
σ = λK+ × [K+] + λCℓ- × [Cℓ-] = (λK+ + λCℓ-) × c0
2. a. La conductivité σ de la solution est proportionnelle à c0. Si c0 augmente, la conductivité de la solution augmente aussi.
b. Si le volume augmente, mais que la concentration ne change pas, la conductivité de la solution ne change pas.
Exercice 6 page 478
1. Pour mesurer l’absorbance des solutions, on se place à une longueur d’onde proche de la longueur d’onde d’absorbance maximale,
ce qui correspond, d’après le spectre d’absorbance de la caféine, à 271 nm.
2. D’après la loi de Beer-Lambert, l’absorbance est proportionnelle à la concentration, donc le graphe représentant l’absorbance en
fonction de la concentration d’une espèce donnée est une droite passant par l’origine.
3. Le café qui contient le plus de caféine est celui dont la concentration massique en caféine est la plus élevée, ce qui correspond,
d’après la courbe d’étalonnage, au café note 2.
4. La solution qui a été utilisée pour tracer le spectre d’absorbance a une absorbance de 0,53 à 271 nm.
D’après la courbe d’étalonnage, la solution qui a une absorbance de 0,5 à 271 nm a une concentration massique de 16 mg .L-1.
Exercice 9 page 479
1. Les demi-équations électroniques des couples en jeu sont :
(E1) MnO4 (aq) + 8 H+ (aq) + 5 e = Mn2+ (aq) + 4 H2O (l)
(E2) Fe2+ (aq) = Fe3+ (aq) + e
En faisant (E1) + 5× (E2), on obtient l’équation de la réaction de titrage :
MnO4- (aq) + 8 H+ (aq) + 5 Fe2+ (aq) Mn2+ (aq) + 4 H2O (l)+ 5 Fe3+ (aq)
2. Avant l’équivalence, le réactif titrant est le réactif limitant, il est donc
entièrement consommé, tandis que le réactif titré est en excès. A
l’équivalence, les réactifs titrant et titre ont été introduits en proportions
stœchiométriques, les deux sont donc entièrement consommés, et après l’équivalence, le réactif titrant est en excès. On a donc :
Exercice 10 page 479
On note ni les quantités de matière initialement présentes et nE les quantités de matière versées à l’équivalence.
1.a. n(I2)i = n(S2O32-)E /2
1.b. n(Fe2+)i/5 = n(MnO4-)E.
1.c. n(H2O2)i/5 = n(MnO4-)E/2.
2. a. c × V = c’ × V’E/2 donc c = c’ × V’E /(2 V).
2.b. c × V/5 = c’ × V’E donc c = 5 c’ × V’E /V.
2.c. c ×V /5 = c’ × V’E /2 donc c = 5 c’ × V’E /(2 V).
ACH13 Contrôle qualité par dosage 1
Exercice 16 page 481
1.a. Le titrage a été suivi par pH-métrie.
1.b. La pipette jaugée sert à prélever la prise d’essai, solution à doser : c’est elle qu’il faut mettre initialement dans le bécher.
1.c. Montage de titrage pH-métrique :
2. a. La réaction de titrage a pour équation : HCO3- (aq) + H3O+ (aq) H2O (l) + CO2 (aq),H2O (l)
2.b. D’après les coefficients stœchiométriques de l’équation de titrage, à l’équivalence, on a :
nhydro = n(H3O+)E versé à l’équivalence.
D’après la méthode des tangentes, on trouve VAE = 8,0 mL.
2.c. On a donc nhydro = n(H3O+)E versé à l’équivalence
nhydro = cAVAE = 0,40 × 8,0.10-3 = 3,2.10-3 mol.
2.d. La concentration en hydrogénocarbonate est donc :
[HCO3-]exp = nhydro/V = 3,2. 10-3/(20,0. 10-3) = 0,16 mol. L-1.
L’écart relatif vaut :
|[HCO3-]exp - [HCO3-]étiquette|/[HCO3-]étiquette soit
e = |0,16 - 0,166|/0,166 = 0,036 soit e% = 3,6 % < 5 %. Les deux valeurs trouvées sont concordantes.
Exercice 17 page 481
1. On peut suivre le titrage par pH-métrie et déterminer le volume équivalent par la méthode des tangentes ou de la dérivée sur le
graphe pH = f(V). On peut également le suivre par conductimétrie et déterminer le volume équivalent qui correspond au volume
pour lequel il y a rupture de pente sur le graphe G(V).
2. Lors du prélèvement de la prise d’essai à la pipette, le volume se mesure avec une certaine incertitude ; les valeurs de conductance
indiquées par le conductimètre contiennent une incertitude et le volume équivalent déterminé graphiquement également. Toutes
ces sources d’incertitude font que tous les binômes ne trouvent pas exactement le même volume équivalent.
3. Le volume équivalent de 16,3 mL trouvé par le binôme 3 du groupe 1 est aberrant. Toutes les autres valeurs sont proches de 12 mL.
4. On trouve VEmoy = 12,02 mL et σ = 0,46 mL.
5. On calcule VE = 2 σ = 0,92 mL.
6. Ainsi, on a VE = (12,02 0,92) mL
7. Le résultat peut donc être donne avec trois chiffres significatifs : VE = 12,0 mL, avec incertitude sur le chiffre des dixièmes.
Exercice 18 page 481
1.
2. AH (aq) + HO(aq) A(aq) +
H2O (l) Cette réaction doit être quantitative.
3. D’après la courbe de suivi de titrage, le pH à l’équivalence vaut 8,0mL. On choisit un indicateur colore dont la
zone de virage contient ce pH : le rouge de crésol convient.
4. a. L’équivalence est l’état final du système pour lequel les réactifs titrant et titrés ont été introduits en
proportions stœchiométriques.
4. b. La méthode des tangentes permet de trouver VBE ≈ 14,5 mL.
5. Soit n(AH)i la quantité de matière de AH à doser et n(HO-)E la quantité de matière d’ions HO- versée à
l’équivalence. n(AH)i = n(HO-)E = cB × VBE = 2,00. 10-2 × 14,4. 10-3 soit n(AH)i = 2,88.10-4 mol.
6. Dans la fiole jaugée de 100,0 mL, il y avait une quantité de matière de AH égale 10 n(AH)i.
7. D’où m = 10 n(AH)i × M(C6H8O6). A.N. : m = 2,88. 10-3 × 176 soit m = 507 mg ≈ 500 mg.
L’indication du fabricant ≪ vitamine C 500 ≫ indique qu’un comprime de vitamine C contient 500 mg d’acide ascorbique.
Exercice 20 page 482
1.a. On ajoute 150 mL d’eau distillée pour que la cellule conductimétrique plonge correctement dans
la solution et pour pouvoir négliger l’effet de dilution sur la conductance lors du dosage.
1.b.
1.c. On doit réaliser une dilution au vingtième : le rapport entre les volumes des solutions mères et
fille doit donc être de 20. On peut prélever 5,0 mL de solution commerciale avec une pipette jaugée
de 5 mL et les introduire dans une fiole jaugée de 100,0 mL, puis compléter jusqu’au trait de jauge
en prenant soin de mélanger pour homogénéiser lorsque la fiole est à moitié remplie.
2.a. La réaction de titrage a pour équation : CH3COOH (aq) + HO(aq) CH3COO (aq) + H2O (l)
2.b. Avant l’équivalence, on ajoute en solution des ions hydroxyde et des ions sodium. Les ions
hydroxyde réagissent avec l’acide acétique (qui ne conduit pas le courant) pour former des ions
éthanoate, donc s’ajoutent à la conductivité initiale de la solution, celle des ions sodium et celle des
ions éthanoate, qui sont toutes deux faibles. Donc la conductance de la solution augmente, mais
faiblement. Apres l’équivalence, on ajoute des ions hydroxyde qui restent en solution et qui ont une
conductivité très importante, et des ions sodium. Donc la conductance de la solution augmente de
manière plus importante.
ACH13 Contrôle qualité par dosage 2
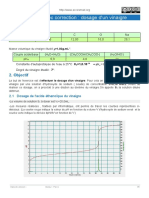
2.c. Le volume équivalent correspond sur le graphe à l’abscisse du point d’intersection des droites modélisant les points
expérimentaux avant et après l’équivalence. On trouve VE = 12 mL (on ne peut pas réellement être plus précis que cela).
2.d. A l’équivalence, on a ici, d’après les coefficients stœchiométriques de l’équation de titrage : cAd × VA = cB × VE.
Donc cAd = cB × VE/VA A.N. : cAd = 5,0. 10-2 × 12. 10-3/(10,0. 10-3) soit cAd = 6,0. 10-2 mol. L-1.
2.e. On a donc cA = 20 × cAd = 20 × 6,0.10-2 soit cA = 1,2 mol. L-1.
3.a. On a mA(100 g) = nA(100 g) × M = (cA × V(100 g)) × M A.N. : mA(100 g) = (1,2×100.10-3) × 60,0 soit mA(100 g) = 7,2 g.
Le vinaigre étudié a donc une acidité de 7,2°.
3.b. L’écart relatif vaut e% = |7 - 7,2| × 100/7 soit e% = 2,9 % < 5 %. Les deux valeurs sont concordantes.
Exercice 21 page 483
1. On a nD = [I2] × V = 2,0.10-2 × 20,0. 10-3 soit nD = 4,0. 10-4 mol de diode introduit.
2. La solution restant colorée, le diiode est en excès, donc le glucose est en défaut : c’est le réactif limitant.
3. Les nombres stœchiométriques devant le diiode et devant le glucose étant les mêmes dans l’équation de la réaction de titrage, on
peut dire que la quantité de matière de glucose ayant réagi est la même que celle de diiode ayant réagi. On a donc nG = nD - nR.
4.a. Il s’agit d’une courbe d’étalonnage.
4.b. Cette courbe représentant une droite passant par l’origine, elle indique que A est proportionnelle à [I2].
4.c. D’après la courbe d’étalonnage, on a : [I2] = 3,0 mmol. L-1. Ainsi, nR = [I2] × V = 3,0. 10-3 × 50. 10-3 soit nR = 1,5.10-4 mol.
4.d. On a nG = nD nR donc nG = 4,0. 10-4 1,5. 10-4 soit nG = 2,5. 10-4 mol.
5. Dans 2,0 cm3 de jus de fruit, il y a nG = 2,5. 10-4 mol de glucose. Dans 1 L soit1 000 cm3 de jus de fruit, il y a n’G mol de glucose.
n'G = 1000 × 2,5.10-4 /2 soit nG = 1,3. 10-1 mol de glucose dans 1 L de jus de fruit.
Ainsi, mG = n’G × MG A.N. : mG = 0,125 × 180 soit pour finir mG = 23 g de glucose dans 1 L de jus de fruit.
ACH13 Contrôle qualité par dosage 3
Vous aimerez peut-être aussi
- C13 - Correction D'exercicesDocument5 pagesC13 - Correction D'exercicesSans SnoqPas encore d'évaluation
- c10 - Correction DexercicesDocument3 pagesc10 - Correction DexercicesmohamedPas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- Fiche DosageDocument8 pagesFiche DosageaeroartonlinePas encore d'évaluation
- DS 1 CorrigéDocument3 pagesDS 1 CorrigéFethi BorsaliPas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- 2014 Antilles Exo2 Correction Ac Ascorbique 10ptsDocument5 pages2014 Antilles Exo2 Correction Ac Ascorbique 10ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2008 Polynesie Exo1 Correction Acides 7ptsDocument3 pages2008 Polynesie Exo1 Correction Acides 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- Exbl1 Ts 16-17Document4 pagesExbl1 Ts 16-17Najimou Alade TidjaniPas encore d'évaluation
- Chimie B Chap8 Titrage AcidobasiqueDocument6 pagesChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- Titrage Avec Suivi ColorimetriqueDocument3 pagesTitrage Avec Suivi Colorimetriquemohammed younes100% (1)
- Corr Exos Supp Chimie 6 Titrages PDFDocument5 pagesCorr Exos Supp Chimie 6 Titrages PDFDenis BurettePas encore d'évaluation
- TP Chimie 9 Acides Conductimetrie Version RevisionsDocument3 pagesTP Chimie 9 Acides Conductimetrie Version RevisionsRachaPas encore d'évaluation
- 2017 Asie Exo1 Correction AcideGlycolique 9ptsDocument5 pages2017 Asie Exo1 Correction AcideGlycolique 9ptsgrajzgrPas encore d'évaluation
- Correction Exercice Type Bac Dosage Acide BaseDocument3 pagesCorrection Exercice Type Bac Dosage Acide BaseColinePas encore d'évaluation
- Methode GranDocument29 pagesMethode GranASMAA KherrazPas encore d'évaluation
- Acides Et Bases PcDocument15 pagesAcides Et Bases Pcrkibi.khadija2006Pas encore d'évaluation
- Killian - 2022 - Tp1Document9 pagesKillian - 2022 - Tp1amandine gaianiPas encore d'évaluation
- AE6 Titrage Destop Conductimétrique-ProfDocument4 pagesAE6 Titrage Destop Conductimétrique-Profbabouche fesdaPas encore d'évaluation
- Correction Devoir No4 Equilibre Dosage NucleaireDocument6 pagesCorrection Devoir No4 Equilibre Dosage NucleaireridhajamelPas encore d'évaluation
- S7 Chapitre 03 Reaction Acide Base DosageDocument16 pagesS7 Chapitre 03 Reaction Acide Base DosageRADWAN100% (2)
- TP Dosage Par Conductimetrie Du Destop Correction Du TPDocument5 pagesTP Dosage Par Conductimetrie Du Destop Correction Du TPhhedfi100% (1)
- 2008 Pondichery Exo1 Sujet Ammoniac 7ptsDocument3 pages2008 Pondichery Exo1 Sujet Ammoniac 7ptsla physique selon le programme Français100% (1)
- Correction Un Polymere BiodegradableDocument5 pagesCorrection Un Polymere BiodegradablegrajzgrPas encore d'évaluation
- Rapport Chimie PDFFDocument8 pagesRapport Chimie PDFFFati TLPas encore d'évaluation
- Sujet ChimieDocument3 pagesSujet ChimieKerherve JulienPas encore d'évaluation
- Exercice Corrigé Sur DosageDocument5 pagesExercice Corrigé Sur DosageIkram MgPas encore d'évaluation
- TR ACIDOBASIQUES PCDocument11 pagesTR ACIDOBASIQUES PCalaeddinePas encore d'évaluation
- Sujet ChimieV3Document3 pagesSujet ChimieV3Kerherve JulienPas encore d'évaluation
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassiPas encore d'évaluation
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassi100% (1)
- 2 T Cos T: 4 + (Aq) 3 (Aq) 2 (L) - (Aq) e - 14 - 1 + (Aq) 3 - (Aq)Document2 pages2 T Cos T: 4 + (Aq) 3 (Aq) 2 (L) - (Aq) e - 14 - 1 + (Aq) 3 - (Aq)Souhail El AsferPas encore d'évaluation
- 5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFDocument5 pages5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFkimmikPas encore d'évaluation
- CompteRenduTP N 2Document11 pagesCompteRenduTP N 2youssef ibn seddikPas encore d'évaluation
- Travaux Pratiqe n1 de Chimi1Document14 pagesTravaux Pratiqe n1 de Chimi1douniasadok85Pas encore d'évaluation
- TP Correction La Masse VolumiqueDocument2 pagesTP Correction La Masse VolumiqueDouae AkahouchPas encore d'évaluation
- C3Chim - Transformations - Limitees - Exercices - Sabatier PDFDocument5 pagesC3Chim - Transformations - Limitees - Exercices - Sabatier PDFAzizElheni0% (1)
- Exo Titrage AmmoniacDocument6 pagesExo Titrage AmmoniacMed BriniPas encore d'évaluation
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 pagesEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Examen National Physique Chimie SPC 2014 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2014 Normale SujetaarabkholoudPas encore d'évaluation
- TP N2 PH MetrieDocument15 pagesTP N2 PH MetrieSellam Anis100% (2)
- Dosage Acido BasiqueDocument33 pagesDosage Acido Basiquemed100% (1)
- La Chimie Des SolutionsDocument65 pagesLa Chimie Des SolutionsSoufiane Bahi100% (1)
- Chimie D Chap14 Correction ExosDocument4 pagesChimie D Chap14 Correction ExosSOULA CHAHINAZPas encore d'évaluation
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences physiques Chimie pH et Dosage Physique Oscillations mécaniques - Bac Sciences exp (2012-2013) Mr EL Hafi MustaphaDocument4 pagesDevoir de Synthèse N°2 - Sciences physiques Chimie pH et Dosage Physique Oscillations mécaniques - Bac Sciences exp (2012-2013) Mr EL Hafi MustaphaFelhi mokhtarPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- DM7 Reaction Equilibree Correction PDFDocument2 pagesDM7 Reaction Equilibree Correction PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Serie Acides Forts Et Bases FortesDocument2 pagesSerie Acides Forts Et Bases Fortesawa96213Pas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Chimie 2 PDFDocument8 pagesChimie 2 PDFTarik Mlilas50% (2)
- Exercice IDocument15 pagesExercice IInes De Paul Feudjeu100% (1)
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 pagesExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalPas encore d'évaluation
- D1 1S1 2022 LSLLDocument2 pagesD1 1S1 2022 LSLLmohamedPas encore d'évaluation
- evaluation diagnostique_fr 1Bac__SM_PC 2022Document4 pagesevaluation diagnostique_fr 1Bac__SM_PC 2022mohamedPas encore d'évaluation
- Nomenclature-des-alcanesDocument3 pagesNomenclature-des-alcanesmohamedPas encore d'évaluation
- 14_aimants_champDocument2 pages14_aimants_champmohamedPas encore d'évaluation
- 2021 03 Metro Sujet1 ExoB BoissonHydratation 5pts CorrectionDocument6 pages2021 03 Metro Sujet1 ExoB BoissonHydratation 5pts CorrectionmohamedPas encore d'évaluation
- Construire Un Tableau D'avancementDocument1 pageConstruire Un Tableau D'avancementphysique100% (1)
- Lycée Qualifiant MASSAR - Devoir Surveillé 2 CLASSE 1Document1 pageLycée Qualifiant MASSAR - Devoir Surveillé 2 CLASSE 1mohamedPas encore d'évaluation
- 1s 2012 tpc8 Alcools AlcanesDocument6 pages1s 2012 tpc8 Alcools AlcanesmohamedPas encore d'évaluation
- Activite 1 Capacite Thermique Massique - CorrigeDocument3 pagesActivite 1 Capacite Thermique Massique - CorrigemohamedPas encore d'évaluation
- Rev Ac Bas PDFDocument5 pagesRev Ac Bas PDFYoussef BerquedichPas encore d'évaluation
- 4 - Mesure de La ConductanceDocument4 pages4 - Mesure de La ConductanceBrahim Ouaabou100% (1)
- CO1 2S1 2022 LSLLDocument2 pagesCO1 2S1 2022 LSLLmohamedPas encore d'évaluation
- Evaluation Diagnostique TCSFDocument2 pagesEvaluation Diagnostique TCSFmohamedPas encore d'évaluation
- Cours Physique Chimie 1er BAC-1Document102 pagesCours Physique Chimie 1er BAC-1mohamed100% (1)
- Les Ondes Lumineuses Test - 2Document5 pagesLes Ondes Lumineuses Test - 2mohamedPas encore d'évaluation
- Examens DSPDocument13 pagesExamens DSPmohamed100% (1)
- FLYH Mohamed GravitationDocument12 pagesFLYH Mohamed Gravitationmohamed100% (2)
- Leçon-N4-Combustion-de-quelques-materiaux-oraganiques Prof - Zrikem (WWW - Pc1.ma)Document2 pagesLeçon-N4-Combustion-de-quelques-materiaux-oraganiques Prof - Zrikem (WWW - Pc1.ma)mohamedPas encore d'évaluation
- Calorimetrie Exercices Corriges 04Document5 pagesCalorimetrie Exercices Corriges 04demba baPas encore d'évaluation
- Calorimetrie Exercices Corriges 04Document5 pagesCalorimetrie Exercices Corriges 04demba baPas encore d'évaluation
- Résonance Électrique Étude D'Un Circuit R L C: Jacques PHILIPPEDocument14 pagesRésonance Électrique Étude D'Un Circuit R L C: Jacques PHILIPPEsoltaniPas encore d'évaluation
- Rapport P6 2014 05 PDFDocument53 pagesRapport P6 2014 05 PDFsultanfrikha100% (1)
- Chapitre Un CDocument13 pagesChapitre Un CDaboPas encore d'évaluation
- AssociationdedipolesDocument9 pagesAssociationdedipolesErnest AdouPas encore d'évaluation
- Leçon N5pHDocument2 pagesLeçon N5pHmohamedPas encore d'évaluation
- Résonance Électrique Étude D'Un Circuit R L C: Jacques PHILIPPEDocument14 pagesRésonance Électrique Étude D'Un Circuit R L C: Jacques PHILIPPEsoltaniPas encore d'évaluation
- Soutien TCS PHYSIQUE ET CHIMIEDocument2 pagesSoutien TCS PHYSIQUE ET CHIMIEmohamedPas encore d'évaluation
- Lycée Qualifiant ELHAKIMDocument1 pageLycée Qualifiant ELHAKIMmohamedPas encore d'évaluation
- F148157Document19 pagesF148157Wizardtuan WizardchienPas encore d'évaluation
- DS+Examen Acoustique 2018-2019Document5 pagesDS+Examen Acoustique 2018-2019Hsen Machey100% (1)
- L'électricité StatiqueDocument8 pagesL'électricité Statiquegloire stevy banzouzi malongaPas encore d'évaluation
- Rapport OADocument13 pagesRapport OASabri Mokhtar ABAZAPas encore d'évaluation
- I Bases de L'optique GéométriqueDocument12 pagesI Bases de L'optique GéométriqueHóù'sSém CrąŻy BÖyPas encore d'évaluation
- Déformé D'un Portique Bi-Encastré: Câble de Branchement Câbles Vers Les Appuis Du PortiqueDocument11 pagesDéformé D'un Portique Bi-Encastré: Câble de Branchement Câbles Vers Les Appuis Du PortiqueFarahBoughanmiPas encore d'évaluation
- TD - Electrochimie - IUT Bobo Mai 2022Document5 pagesTD - Electrochimie - IUT Bobo Mai 2022Abdoul Kader OUATTARAPas encore d'évaluation
- Chauffage Et ClimDocument10 pagesChauffage Et ClimLovaFenohasinaLalaRafanomezantsoaPas encore d'évaluation
- Dosimetrie 2022Document26 pagesDosimetrie 2022M'bouillé SissokoPas encore d'évaluation
- La Formation Des Gouttes de Nuage, de Brouillard Et de PluieDocument11 pagesLa Formation Des Gouttes de Nuage, de Brouillard Et de PluieAntoninPas encore d'évaluation
- Ch4 Dynamique Point MatérielDocument17 pagesCh4 Dynamique Point MatérielAmine BajjiPas encore d'évaluation
- Cours de Genie Parasismique 01 PDFDocument41 pagesCours de Genie Parasismique 01 PDFkakem61Pas encore d'évaluation
- Tuto Ansys3 PyloneDocument11 pagesTuto Ansys3 PyloneqaadilPas encore d'évaluation
- CIA Adsorption 2011Document29 pagesCIA Adsorption 2011Fay Rouz Taleb EpTahri100% (1)
- ThermistancesDocument2 pagesThermistances18188yem3761Pas encore d'évaluation
- TD Serie1Document1 pageTD Serie1Nowe AhmadePas encore d'évaluation
- 04-Production de L'énergie ÉlectriqueDocument68 pages04-Production de L'énergie ÉlectriqueIbrahim SendiPas encore d'évaluation
- Proprietes Magnetiques Des Solides 2017-2018Document74 pagesProprietes Magnetiques Des Solides 2017-2018yacinesat100% (1)
- Spectro RMN Rabat AgdalDocument26 pagesSpectro RMN Rabat AgdalYoussefPas encore d'évaluation
- Distillation SimpleDocument8 pagesDistillation Simpleslh 01Pas encore d'évaluation
- Pfe - R+9+ssol + Robot - Achour & Nessark - Bejaia 2016 PDFDocument224 pagesPfe - R+9+ssol + Robot - Achour & Nessark - Bejaia 2016 PDFOUEDRAOGO IdrissaPas encore d'évaluation
- TD 3 ElectromoteurDocument3 pagesTD 3 ElectromoteurAmadou SARRPas encore d'évaluation
- S1 TP4 UltrasonsDocument7 pagesS1 TP4 UltrasonsMohamed YagoubPas encore d'évaluation
- Structure Des AtomesDocument3 pagesStructure Des AtomesZikas NmirichPas encore d'évaluation
- TP1 Facteurs Cinétiques-1Document3 pagesTP1 Facteurs Cinétiques-1Ach WakPas encore d'évaluation
- 1 PDFDocument41 pages1 PDFKhalidMoutarajiPas encore d'évaluation
- Chap4 Traction Simple - Compression Simple - ENSTAB CoursewareDocument10 pagesChap4 Traction Simple - Compression Simple - ENSTAB CoursewareTunENSTAB100% (2)
- 63c80179a7c47 Énoncé Serie 15 BisDocument3 pages63c80179a7c47 Énoncé Serie 15 BisDalel Chelbi Slama100% (1)
- MEC3 MobiliteDocument7 pagesMEC3 Mobiliter_prePas encore d'évaluation
- Cours de Mecanique Des Materiaux Composites Chapitre1 Et 2partie3Document69 pagesCours de Mecanique Des Materiaux Composites Chapitre1 Et 2partie3Francis Sonkeng100% (1)