Académique Documents
Professionnel Documents
Culture Documents
Cristall o Graph I e
Cristall o Graph I e
Transféré par
Khaled Jberi0 évaluation0% ont trouvé ce document utile (0 vote)
14 vues7 pageschimie
Titre original
Cristall o Graph i e
Copyright
© © All Rights Reserved
Formats disponibles
PDF ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentchimie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
14 vues7 pagesCristall o Graph I e
Cristall o Graph I e
Transféré par
Khaled Jberichimie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 7
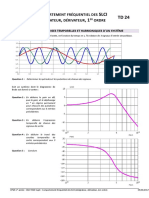
Résumé de cours ~ CM3 ~ Cristallographie — 1/4
Objectif; > décrite tat solide dela matiére see
Es de tid “ (
a
SOLIDE LIQUIDE GAZ.
> Erat ordonné/ Moléeules au contact Etat désordonné /Molécules proches > Désordonné / Paricules Tréséloignées
> Forte interaction /Plus de mouvement > Peuvent bouger les unes 9% aux autres > Trés agitées/Libre/ Peu d'imeraction
Récipient avec solide
Récpient avec liquide (Oo Been Pune O
0,0 8 ce oe
32.0985’
aude des nz
het BY Be (oir Cours Thermodynamique)
ion de
Maille: Pantie élémentare du cristal partir de laquelle on peut reconstitue tut le cristal
Réseau crisallin: ‘Assemblage infin des malls > Description géométrigue du cristal
Naruds: Points réguliérement dispose constcuant la structure du cristal
‘Mott du cris: Entitd place i chaque noeud et qui se répéte dans le cristal (= atome / ion / molécule/.)
Population ou muliplicté: Nombre de naudesppartenant la maille(notéN pout fa suite)
EeiGtals ReStan- maby
: Nombre de sphéresapparenant & la maileélémentaire (Certines sont partagées)
Cuibique Faces Gentréss sphsessont yaragées
(fn voe dchets) entre plusieurs malls:
14 aphires apparissent > Ine faut en compter
(Ge nest pas la mlipliceé qu'une partie
4.Cas Possibles:
Surles Faces Sites Andes
=> Compte pour! => Compte pour /2 => Compte pour 1/4
as
Modeéle des spheres dures indéformables
‘= Chaque motif du cristal par une sphere dure
Compacith: Rapport du volume réelement occupé par
Jes spire sure volume total de la mille
Masse Volumique.: Rapport mas Vere
Densité ‘Comparaison avec eau (lensachant que p,,, =1kg.£' =1000kg.m™ }
Jing La densité est une grandeur sons unité (> plus fcile 8 manipuler)
ng a densité d'un gaz est comparde avec celle de air
dune maille/ volume
cs
Fitment | Eau [Pera | Plomb | Thane [ Aluminium Or | Uranium [ tridium
Dense [1 [7.85 [1135 | 5: 28. 93 | 19 26
{anb}
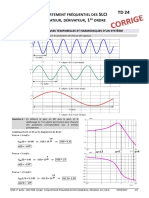
‘M3 —~ Cristallographie
Réseaux Cristallins Courants
L1 Gubique Simple (CS)
Lamuille: 1 nceud & chaque sommet dun cube
1
Population: N = 8X
Contact au niveau de Taree: (2 =2R
4 3
V, gtk @
Compacite: C = tet = BC = T= 52%
Vase (2K) 6
12 Cubique Centré (CC)
La maille: 1 nerud di chaque sommet dun cube + 1 noeud au centre
Population Nv =8xLeix1=2
Coutnct wa xivers dea grndedagemle: [2V3=4R) = 2=
Poet Rappel mathématique:
Pete diagonal Vana Grande dagonte: | /, 95
Vv 2xinr?
Compacité : ce yo 3,
maille ( 4 )
Ser
13 Cubique Faces Centrées (CEC)
Lamaille: I ne@ud chaque sommet dun cube
4+ neeud au centre de chaque face du cube
- 1
sion: N= Bx24+6x2=4
lista So
Contact au niveau dela petite diagonale :
TRS. P —]
c Vcceupe
sapere: C= ee = 8
— Vasite ( 4 2)
V2
14 Hezagonsle Compacre (Rosetragsamime)
Empilement de structures hexagonales
(«Solution la plus compacte pour répartir des
sphres de méme diaméere dans un plan)
(On montre que :
msi a
‘Remarque: 7496 este plus compact réalisable avec des sphtres DURES de MEME DIAMETRE
P aretures permettentdatteindre une tele compacité: CFC et HC (Hexagonal Compact)
MablgBebe 1 eb IT - cos
A ile MS See ta gna tt ek | 4B
: Url, vecarute Ear pporbiend Att mails WS A 2 4
Hoste
elmer
|
CEC,
© Habib Gb: La dimermtien dm wey pppele acre Pabilalile” of @ parjgn orroorred
F de (‘heme 6 quse om pet istcy dons ce sles Sern ee
pr oe @ ‘
: pe Dhok Po> Vea).
Carbone: Graphite, Diamant, Nanotubes. (tous ds cristaux cvalents) La glace (Eau sous forme solide) posse plus de 10 formes allotropiques selon les conditions de température T et de pression P TL2 Types de Cristaux Pep: Danses eas decrsaux, des issons lectriques se font entre les atomes et les molécules (On dstngue diferent ypes de cristaux selon la naare de es Haisons MOINS FORCE DE LA LIAISON Liaison forte Liaison faible CRISTAUX CRISTAUX CRISTAUX CRISTAUX COVALENTS IONIQUES METALLIQUES MOLECULAIRE > Empilement darome | > Empilementd'ions | > Empilement d'atome > Empilement de epheres) (charges + et-) (ephéres) rmolécules > Motif- Atome > Motif: Lesions > Motif = Atome > Motil molécule métallique Liaison de covalence | > Attraction charges > Interaction dlectrique Be:GySi Ex:NaCl Zn§,Cas | > Lisison métallique Be: h, Hod, Ex:Na, Fe Exemple: Chlorure de eee Pea Césixm CsCl (Pas de liaison direct, Paice seulement une mise en commun dese) =e cl DIFFICULTE A BRISER LE CRISTAL Tredefusion (C)-3675°C (ZnS) =1830"C (Fe)=1540°C (H:0)-0C MAIS ATTENTION ~ Beaucoup d'exception (8 titre indicatif) Solide le plus dur DIAMANT (Carbone tétraédrique) ww CPGE ~ Lycée My Idriss / FES LL STRUCTURES IONIQUES MPSI2 M. BENIKEN Les cristaux ioniques sont des assemblages réguliers de cations et d’anions. La structure d’un cristal ionique est régie par deux critéres fondamentaux : taille des ions et neuiralité électrique. Soient r* et 1° les rayons respectifi d’un cation et d’un anion. Alors r*/#7 <1 ox ‘ous les sites octaédriques. melcog TNA, 12 1/2), cn po ex positions des ions Structure de CsCl Structure de NaCl Structure de ZnS blende (Chlorure de ei (Chlorure de sodium) (Sulfure de zine) ' = ec 9 7 St: CFC Siteyoccupés par _ | Cubique Tétraédrique es cations/TLfevelclith, Coordinence 88 44 Anions /Cations | Cs" aucentre du cube est entouré de 8 ions es sites octa6driques [Na"]~6 | s* Occupent des sites traédriques :[S*]=4 CC placés aux sommets du cube :[Cs* ]= | Par permutation des positions des ions CI et See dec ettee Aaa whaze™: [a= &. Fae os st ts wae. © | Par permutation des positions des ions S* et Zn": [Zn™]= 4 et Nombre de motifs [7 CsClpar maille: N=1 4 NaCI par maille:N=4 T2aS par maille:N=4 C1 X(UD= 16ST maille Leap, {| Nav 1 x (1/1) + 12 x (1/4) = 4 Na" /maille Zot" 14x (1) =4 Zn J maille par maille N Tones on Derdke gebeie~ Toni npt Pellce decabion + be 7 - Doqueanion oF ooliire pr Gabo pe MPSI 2. i 5 M. BENIKEN | Relation de contact ] 27 +2 =aV3 2 +2 =a rer =av3/4 Contact entre anions et cations sur la Contact entre anions et cations sur "aréte du | Contact entre anions et cations sur la demi diagonale du cube | diagonale du cube cube vena } | Condition V3-1=0, 732Vous aimerez peut-être aussi