Académique Documents
Professionnel Documents
Culture Documents
Potentiel Et Equilibre 2019 2020 - 06052021121847
Potentiel Et Equilibre 2019 2020 - 06052021121847
Transféré par
Khaled Jberi0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues8 pageschimie
Titre original
potentiel et equilibre 2019 2020_06052021121847
Copyright
© © All Rights Reserved
Formats disponibles
PDF ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentchimie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
Télécharger au format pdf
0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues8 pagesPotentiel Et Equilibre 2019 2020 - 06052021121847
Potentiel Et Equilibre 2019 2020 - 06052021121847
Transféré par
Khaled Jberichimie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
Télécharger au format pdf
Vous êtes sur la page 1sur 8
INSTITUT PREPARATOIRE AUX ETUDES
D‘INGENIEURS DE TUNIS
SS Préparation : SP /SM
PEIT= Année : 2019-2020
Série de révision : Potentiel et équilibre chimique
EXERCICE.I
‘On considére |’équilibre chimique décrit par l’équation bilan
Fag) t hy
2H)
1) Calculer la variance du systéme. Si l’on modifie un facteur d’équilibre est ce que le
systéme subira un déplacement ou rupture d’équilibre ? Justifier votre réponse.
2) Que devient cette valeur lorsque le systéme ne contient initialement avant
Pétablissement de ’équilibre, que Hig) ? Conclure.
3) Peut-on choisir arbitrairement :
8) T. Pity & Yrzegy
b) T,P,ny, et¥
4) Les coefficients de dissociation de la réaction (1) a et a, AT (600 K) et &T; (1000
K) sont respectivement 0,1 et 0.14 ; quel est le signe de l’enthalpie standard de la
réaction (sans effectuer le calcul).
5) Exprimer la copstante d’équilibre K° en fonction de a,
6) Calculer Yenthalpie standard de la réaction.
7) En utilisant les enthalpies de dissociation, calouler I'enthalpie standard de cette
réaction. On donne : Dy = 435 ; Dj; = 150 et Dy_) = 300 kJ. mol”?
8) Faut-il travailler & basse ou haute température et pression si l'on cherche & optimiser la
synthése de Hilo) :
9) Expliquer pourquoi l’enthalpie standard de formation de diiode gazeux est non nulle &
298 K ? Préciser son signe.
10) Sechant que la solubilité du diiode solide dans l'eau pure 25°C vaut $= 1,36.10°
‘mol. L* , calculer son potentie! chimique standard. On pose que son potentiel
chimique standard a état solide est nul
EXERCICE.2
Ceulhimaion )
La pression de vapeur du titane (Ti) solide dans la phase, en fonction de la température (en
K), est donnée par Ja relation
© Hannachi-Yasser 2019/2020
1
24275
Logs» (P/mmitg) = 10,2 —
Valable de 1150 K a 2005 K
Celle du titane liquide, parla relation: (vapssisib )
B
logis (P/mmlg) = A— =
Valable du point triple au point d’ébullition standard,
1) Déterminer les valeurs de A et B.
2) Calculer ta température et 1a pression du point triple de Ti.
3) Calculer, a 1a température du point triple, les enthalpies de sublimation, et de fusion de
Ti
4) Calculer ia différence entre les chaleurs spécifiques a pression constante du liquide et
du gaz.
5) En supposant que la variation de la température de fusion avec la pression est trés
faible. Montrer que I’équation de la courbe de fusion peut étre assimilée a un
segment de droite affine
6) Tracer et indexer le di
pres
7 Le titane solide B es
rarame de phases de Ti. On prendra une échelle logyo pourla
ir voure réponse,
Données :
Enthaipie molaite @?ébullition standard a la température d’ébullition : AygpH® =
429 kj.mol-+,
Enthalpie molaize d’bullition standard au point triple Aya)H®
‘Température d’ ébullition standard de Ti: 3544 K, ( ebulite
Température de fusion standard de Ti : 1670°C.
R= 8,314 J.K"mol"! = 0,082L.atm.K"!.mol!
p= Ibar = 10° Pa= 760 mmHg.
423,27 kj.mol*
vapensaliie }
EXERCICE,3
En vous servant des données thermodynamiques ci-dessous
1) Déterminez la tension de vapeur du silicium solide a Ia température de 50°C.
La pression de vapeur du silicium liquide, du point de fusion (1410 °C) au point ¢’ébullition
(2355°C) est donnée par la relation
20900
logPtpay =~ — — OS65logT + 12,9
2) Btablir une relation donnant Venthalpie molaire de’ vaporisation en fonction de T et la
calouler 4 2600°C,
(© Hannachi-Yasser 2019/2020
3) Calculer la valeur de Sa 2500°C.
4) Donner allure et indexer le diagramme de phases de Si.
5) Tracer et commenter allure de la courbe d’analyse thermique lors du reffoidissement isobare
P= Ibar) du Si de 2600°C jusqu’a 1200°C.
Espéce ASH? (kj-mol) | C2 GK mol) | S58 Uk mol™
Sits; 0 20 18,8 |
7 i
Siggy 450 2,3 | 168 }
HS?” (2500°C) = —35,62 kj. mol?
R= 8,314 J.K-). mol = 0,082L.atm.K"!.mol?
p= lbar = 10° Pa = 760 mmHg.
A une température inférieure a 1337 K I’équation de la réaction @’oxydation de l’or solide en
Aut Oa¢s) est :
4 2
3 Ate) + Oey) = ZAM 02¢5
1) Calculer la variance du systéme. Que devient cette valeur si
juimotaire de Aut.) et d’air.
2) Déterminer lenthalpie standard de formation de Au, Ogg) & 298K.
La vapour de I’or est assimilée A un gaz parfait et les enthalpies de changements d’état sont
supposées indépendantes de la température.
Dans le tableau ci-dessous on donne les valeurs des logarithmes népériens des pressions de
vapeur (en bar) de l’or liquide et solide :
phase T®) 1200 1500
liquide -20,02 =13,53
P
Ings
solide -9,08 -2,33
P
Ings
(© Hanmacht-Yasser 2019/2020
3) Montrer que les expressions des pressions de vapeur de l’or liquide et solide peuvent
s’exprimer en fonction de Ia température sous la forme :
meet
4) Donner les expressions puis calculer les températures d°ébullition et de sublimation
standard de Au.
5) Détermniner alors A et B dans chaque cas.
6) Déterminer la température de fusion de l’or sous la pression de 200 bars.
Données :
Potentiel chimique | entropie molaire enthalpie molaire
standard standard standard de formation
oe 2 (kj-mol™) 5% O.R7mol-4)_| ApH? (kJ.mol-1)
Aue | ¢ [474 0
Aurds | ___ 1633 [_ 125 7
Ong) 2053 0
Masse molaire de Por ‘My, = 197 g.mo!~*
‘Température de fusion standard de 'or : 1337 K
‘Température d’ébullition standard de For : 3129 K.
inthaipie molaire de vaporisation siandard de Tor : Ayay
Enthalpie molaire de fusion standard de l’or : AyysH® = 12,55 kj. mol”?
Masses volumiques de Por (supposées indépendantes de Ia température et de la pression)
Phu = 17,31 g.cm™ ; py =19,30g.em~
= 324 ij.mot™*
— Bevre potedse\ ey Byres Came _
“Leelee 4% ata, = Sek wy |
fou = NR AR 42-€
yA Og we?
Comme a Vig sa-ysd & Pvor go mgace- Seqbhe
dene UF ed
Wa ap deplacemenly Lega bre
alor ete sme rupture drequibre
Mong ees, parce pre Ae wyhece. ob amap ci
Hy, 2 Hz, done We
UP = B-A-Actr-AeyY
ay Tree Bg, > Re tepmse gh nen coe Py siege neat
UT. Pansy = ha reponse afb Gu con Cay = ao
syste Lone gin ok we Venable”
(Sen 4 Ze, pa 2 dwell, |
wg = OA d= OY Newiven
, 2
Hoe ee “ips Aone
Bo wy de Ayh? (T). Saws ColeL :
ALO | DSeND (gehen ae Veet Heft)
ar “Rte
Bayne de DeW er) Ub sipne de dak tr)
Avene > gg MT) [spe A nee T*
LeU) 99 done Be) po ob BRE ch exdotfonn
g/ Xe nese role dase oe
ee
nb de mole gniliol,
2
Ty
er n
EP nag 4 j 4
On 2 24 =
ts Eos gt
CFs m4 a) sey i
Zs
2
koi = Poe Pe Pa / Bing > filte wus)
Pe Pay i as 7
ah
H ma ™
ZH (s Hee + Tey
RS -[Pvae { -Ore
hy ea
i ea) deat \
AM IT) 2 gy t ag v
BMT) 2 BD. Daw Qa = KT ol
TI DW MES ao BR ke sydlece done “VS
Aa pressrg n‘snfluc poy por la gyathere Je HT can Z~); so
Dene on 3) Asauciller & boe “Te i:
ae Be quel Naat, Ape o?
Phy > 6
es
“Dawe non éhak chandand de wifes They 20 os henden ly S
Le = ey Dp ie = Nout moa A Hu" Se fs
Sub 22
do. °
ne Ne Hy ow >?
a9 f
Gey = Tey
pric & Wile =O
pt Ca ag
wT Ps, + PT ARS ap RTM CEL fea
20k ee
Csat =
on
ory
L =O
Pre rear
ast
o
> ph = Abed Kz md
_ Ekerdee 2°
L Vv
4] Dine ve posiadion « KS
= 1
ar Si’ or
aS Set of Ne Vn
sT Weve)
Vin = RY
ae 2 BY ar |?
a “ee | bg Ps ALS
wn P Sar Z
alae’ = BAR) Lhe Ans ang
& 1 ie
|e Ae g
© =O & Kup eee
Yde
ieee = Nvep H Cine
a ee cs pote ee
\ Bs a2 MoA ae
log PeA- &
leg. (960) = 4 -
(A BT aeudkta ) p= eee)
cw [As ae |
200
= 3SuU
Ay
jy Pa ae
Vous aimerez peut-être aussi
- CI05 TD13 Corrigé - Déterminer Le Modèle de Connaissance D - Un Système AsserviDocument4 pagesCI05 TD13 Corrigé - Déterminer Le Modèle de Connaissance D - Un Système AsserviKhaled JberiPas encore d'évaluation
- E - PH FinaleDocument16 pagesE - PH FinaleKhaled JberiPas encore d'évaluation
- 03.2 - Cinématique Du Point - TD2Document4 pages03.2 - Cinématique Du Point - TD2Khaled JberiPas encore d'évaluation
- Ex Chimie-Ing PC2Document5 pagesEx Chimie-Ing PC2Khaled JberiPas encore d'évaluation
- Informatique (Vassal)Document53 pagesInformatique (Vassal)Khaled JberiPas encore d'évaluation
- Cristall o Graph I eDocument7 pagesCristall o Graph I eKhaled JberiPas encore d'évaluation
- CCP SupDocument22 pagesCCP SupKhaled JberiPas encore d'évaluation
- CI05 TD13 Sujet - Déterminer Le Modèle de Connaissance D - Un Système AsserviDocument8 pagesCI05 TD13 Sujet - Déterminer Le Modèle de Connaissance D - Un Système AsserviKhaled JberiPas encore d'évaluation
- Ex SM SPDocument5 pagesEx SM SPKhaled JberiPas encore d'évaluation
- CI05 TD14 Corrigé - Déterminer Le Modèle de Connaissance D - Un Système Asservi PerturbéDocument8 pagesCI05 TD14 Corrigé - Déterminer Le Modèle de Connaissance D - Un Système Asservi PerturbéKhaled JberiPas encore d'évaluation
- CI04 TD12 Sujet - Prévoir Le Comportement D - Un Modèle Quelconque - Identifier Un Modèle de ComportementDocument4 pagesCI04 TD12 Sujet - Prévoir Le Comportement D - Un Modèle Quelconque - Identifier Un Modèle de ComportementKhaled JberiPas encore d'évaluation
- CI05 Cours - Déterminer Le Modèle de Connaissance D - Un Système AsserviDocument10 pagesCI05 Cours - Déterminer Le Modèle de Connaissance D - Un Système AsserviKhaled JberiPas encore d'évaluation
- CI06 Cours - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - Équilibre - Cas Des Chaînes OuvertesDocument11 pagesCI06 Cours - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - Équilibre - Cas Des Chaînes OuvertesKhaled JberiPas encore d'évaluation
- CI06 TD15 Corrigé - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - ÉquilibreDocument12 pagesCI06 TD15 Corrigé - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - ÉquilibreKhaled Jberi100% (1)
- CI01 TD02 Sujet - Analyser Et Décrire La Structure D - Un SystèmeDocument8 pagesCI01 TD02 Sujet - Analyser Et Décrire La Structure D - Un SystèmeKhaled JberiPas encore d'évaluation
- CI05 TD14 Sujet - Déterminer Le Modèle de Connaissance D - Un Système Asservi PerturbéDocument10 pagesCI05 TD14 Sujet - Déterminer Le Modèle de Connaissance D - Un Système Asservi PerturbéKhaled Jberi100% (1)
- coursMP2I AlgebreDocument118 pagescoursMP2I AlgebreKhaled JberiPas encore d'évaluation
- CI04 TD12 Corrigé - Prévoir Le Comportement D - Un Modèle Quelconque - Identifier Un Modèle de ComportementDocument7 pagesCI04 TD12 Corrigé - Prévoir Le Comportement D - Un Modèle Quelconque - Identifier Un Modèle de ComportementKhaled JberiPas encore d'évaluation
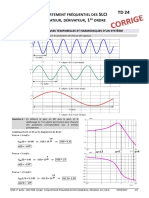
- CI10 TD24 Corrigé - Comportement Fréquentiel Des SLCI (Intégrateur, Dérivateur, 1er Ordre)Document7 pagesCI10 TD24 Corrigé - Comportement Fréquentiel Des SLCI (Intégrateur, Dérivateur, 1er Ordre)Khaled JberiPas encore d'évaluation
- CI11 TD28 Sujet - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - Équilibre - Cas Des Chaînes FerméesDocument4 pagesCI11 TD28 Sujet - Déterminer La Loi de Commande en Effort D - Un Mécanisme À L - Équilibre - Cas Des Chaînes FerméesKhaled JberiPas encore d'évaluation
- CI10 Cours - Evaluer Et Prévoir Le Comportement Fréquentiel Des SLCIDocument19 pagesCI10 Cours - Evaluer Et Prévoir Le Comportement Fréquentiel Des SLCIKhaled JberiPas encore d'évaluation
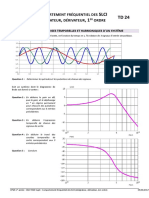
- CI10 TD24 Sujet - Comportement Fréquentiel Des SLCI (Intégrateur, Dérivateur, 1er Ordre)Document4 pagesCI10 TD24 Sujet - Comportement Fréquentiel Des SLCI (Intégrateur, Dérivateur, 1er Ordre)Khaled JberiPas encore d'évaluation
- CI02 TD05 Corrigé - Imposer Une VitesseDocument6 pagesCI02 TD05 Corrigé - Imposer Une VitesseKhaled JberiPas encore d'évaluation
- CI01 TD02 Corrigé - Analyser Et Décrire La Structure D - Un SystèmeDocument2 pagesCI01 TD02 Corrigé - Analyser Et Décrire La Structure D - Un SystèmeKhaled JberiPas encore d'évaluation
- CI02 TD03 Corrigé - Interpréter Un Schéma CinématiqueDocument6 pagesCI02 TD03 Corrigé - Interpréter Un Schéma CinématiqueKhaled JberiPas encore d'évaluation
- CI02 TD03 Sujet - Interpréter Un Schéma CinématiqueDocument3 pagesCI02 TD03 Sujet - Interpréter Un Schéma CinématiqueKhaled JberiPas encore d'évaluation
- CI02 TD04 Corrigé - Imposer Une Trajectoire - Imposer Une PositionDocument5 pagesCI02 TD04 Corrigé - Imposer Une Trajectoire - Imposer Une PositionKhaled JberiPas encore d'évaluation
- CI09 TD23 Sujet - Déterminer Une Loi Entrée-Sortie Par Fermeture CinématiqueDocument6 pagesCI09 TD23 Sujet - Déterminer Une Loi Entrée-Sortie Par Fermeture CinématiqueKhaled JberiPas encore d'évaluation
- CI02 Cours - Déterminer Les Lois de Commande en Mouvement D - Un Mécanisme - Cas Des Chaînes OuvertesDocument15 pagesCI02 Cours - Déterminer Les Lois de Commande en Mouvement D - Un Mécanisme - Cas Des Chaînes OuvertesKhaled JberiPas encore d'évaluation
- CI01 TD01 Sujet - Analyser Et Décrire Les Fonctions D - Un SystèmeDocument3 pagesCI01 TD01 Sujet - Analyser Et Décrire Les Fonctions D - Un SystèmeKhaled JberiPas encore d'évaluation