Académique Documents
Professionnel Documents
Culture Documents
Concentration Et Solutions Electrolytiques
Transféré par
OtmaneTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Concentration Et Solutions Electrolytiques
Transféré par
OtmaneDroits d'auteur :
Formats disponibles
Physique Chimie 1 bac sc Otmane AITHIISSI
Exercice 1 :
Le chlorure de baryum (BaCl) est un composé ionique constituée des ions de chlore et des ions de baryum. On
fait dissoudre une masse m=4.1 g de chlorure de baryum dans un volume V1=900mL, On obtient une solution S1
de concentration C1.
1- Quelles sont les étapes de dissolution
2- Ecrire l’équation de dissolution de BaCl dans l’eau
3- Donner l’expression de C1 en fonction de m, M et V1, puis calculer sa valeur
4- Déterminer la concentration effective des ions présents dans la solution S1 puis calculer leurs valeurs
5- Déterminer l’expression de la quantité de la matière des ions présents dans la solution S1 en fonction de
C1 et V1 puis calculer leurs valeurs
On prépare une solution S2 de CaCl2 de volume V2=50mL et de concentration C2 = 0.5 mol/l on dissolvant une
masse mi de CaCl2 dans l’eau.
1- Ecrire l’équation de la dissolution puis déterminer l’expression de la concentration effective des ions
présents dans cette solution en fonction de C2 puis calculer leurs valeurs
2- Déterminer l’expression de la quantité de la matière du solution S2 et celles des ions présents dans cette
solution en fonction de C2 et V2, puis calculer leurs valeurs
On mélange les deux solutions S1 et S2 (sans réaction entre les ions des deux solutions)
1- Quelles sont les ions présents dans le mélange ?
2- Déterminer l’expression de la concentration molaire effective des ions présents dans le mélange en
fonction de C1, C2, V1 et V2.
3- Déterminer la valeur de la masse mi utilise pour prépare la solution S2
Données M(Cl)=35.5 g/mol, M(Ba)=13.7g/mol et M(Ca)=40 g/mol
Exercice 2 :
PARTIE I : La dilution
On prépare 100 mL d’une solution (fille) de concentration en cuivre (II) Cf = 4,0.10–4 mol.L–1 partir d’une
solution (mère) de concentration en ions cuivre (II) Cm = 1,6 .10–3 mol.L–1
1- Déterminer la valeur de facteur de dilution
2- Déterminer la quantité de matière de soluté présente dans la solution mère
3- Déterminer la quantité de matière de soluté présente dans la solution fille
4- Déterminer le volume de la solution qu’on doit utiliser pour préparer la solution fille.
PARTIE II : Glycémie à jeun :
La concentration en glucose (C6H12O6) dans le sang, appelée glycémie, permet de diagnostiquer le diabète.
Une glycémie est considérée comme normale si elle est comprise entre 3,5 et 6,1 mmol. L–1 à jeun.
Une personne est diabétique si la valeur de sa glycémie est supérieure à 7,0 mmol. L–1 à jeun.
1- L’analyse de sang d’un patient indique une glycémie à jeun de 0,96 g. L–1. Ce patient est-il diabétique ?
Exercice 3 :
I- On considère une solution aqueuse S1 de sulfate de potassium K2SO4 et une solution aqueuse S2 de
phosphate de potassium K3PO4. Les deux solutions ont même concentration molaire effective en ion
potassium K+ (aq) : [K+] = 0,60 mol / L.
1- Écrire les équations de dissolution dans l’eau des deux composés ioniques K2SO4 (s) et K3PO4 (s).
2- Calculer les concentrations molaires des deux solutions en soluté apporté.
3- En déduire les concentrations molaires des anions dans les deux solutions
II- On dispose de deux solutions S1 et S2 telles que : V1 =150 mL de solution S1 de chlorure de
cuivre(II), Cu2+(aq) +2 Cl-(aq) de concentration C1=0,30mol/L. V2 =200 mL de solution S2 de
chlorure de fer(II), Fe2+(aq) +2 Cl-(aq) de concentration C2=0,10mol/L.
1- Donner les formules et les noms des solides ioniques utilisés pour préparer les solutions S1 et S2.
2021 / 2022 Béni Mellal Alam Al Ajial Soutien
Physique Chimie 1 bac sc Otmane AITHIISSI
2- Calculer les concentrations molaires des espèces ioniques présentes dans les solutions S1 et S2.
Justifier.
3- On mélange les deux solutions aqueuses suivantes (Aucune réaction chimique n’est observée
lors de ce mélange.)
4- Quel est le volume final V du mélange ?
Donner l’expression de la concentration effective de chaque ion présent dans le mélange,
en fonction de C1, V1, C2, V2. Calculer chaque concentration.
Exercice 4 :
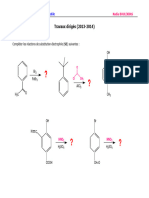
I- Le modèle de la molécule d’ammoniac 𝑁𝐻3 et de Tétrachlorure de carbone
𝐶𝐶𝑙4 sont donnés ci-contre.
Expliquer pourquoi l’ammoniac liquide est polaire par contre 𝐶𝐶𝑙4 est Apolaire
II- Électronégativité des atomes. Azote : 3,04, Fluor : 3,98, Bore : 2,04,
souffre : 2.5, Carbone 2.5, Hydrogène : 2.1, Chlore : 3.05.
1- NF3 est Pyramidale et BF3 est Plane, triangulaire, H2S est codée, CH4 Plane et
Cl2 est linéaire. Représenter le modèle de ces molécules.
2- Donner la définition d’électronégativité
3- Quelles sont les liaisons polarisées présentes dans ces deux molécules ? Justifier.
4- Situer les charges partielles positive (+δ) et négative (-δ) sur les atomes participant à une
liaison polarisée, recopier les modèles ci-dessus.
5- Quelles sont les molécules polaire /apolaire ? Justifier.
***Exercice 5 :
Le sulfate de fer hydraté est un solide verdâtre de formule (FeSO4, yH2O).
On veut déterminer le nombre de molécules d’eau y.
On prélève une certaine masse de sulfate de fer hydraté que l’on déshydrate.
À partir d’une masse de 13, 9g de sulfate de fer hydraté, on obtient 7, 6g de sulfate anhydre FeSO4
Calculer la valeur de y.
Données : masses molaires des éléments : M(Fe) = 55, 8g/mol, M(O) = 16g/mol, M(S) = 32g/mol,
M(H) = 1g/mol
2021 / 2022 Béni Mellal Alam Al Ajial Soutien
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Séries 2 Solutions ÉlectrolytiquesDocument1 pageSéries 2 Solutions Électrolytiquessoso.saaan777Pas encore d'évaluation
- Série 3 - Les Solutions Électrolytiques Et Les ConcentrationsDocument2 pagesSérie 3 - Les Solutions Électrolytiques Et Les Concentrationsabdehamdaoui2Pas encore d'évaluation
- Exercice SolutionDocument2 pagesExercice SolutionMohamed LatifPas encore d'évaluation
- Exercice SolutionDocument2 pagesExercice SolutionMeryem Chakri0% (1)
- TD - Généralités Sur Les Solutions Aqueuses - 2010Document2 pagesTD - Généralités Sur Les Solutions Aqueuses - 2010mohamedPas encore d'évaluation
- 3e PCTDocument11 pages3e PCTeucludePas encore d'évaluation
- Série - Les Solutions Électrolytiques Et Les Concentrations Prof - Fatima (WWW - Pc1.ma)Document2 pagesSérie - Les Solutions Électrolytiques Et Les Concentrations Prof - Fatima (WWW - Pc1.ma)Tuto ProPas encore d'évaluation
- La Concentration Et Les Solutions Electrolytiques Exercices Non Corriges 4Document2 pagesLa Concentration Et Les Solutions Electrolytiques Exercices Non Corriges 4waclapayPas encore d'évaluation
- Série 3 - Les Solutions Électrolytiques Et Les ConcentrationsDocument1 pageSérie 3 - Les Solutions Électrolytiques Et Les ConcentrationsThe Tiktoker Business100% (1)
- Exercice 1: Exercice 5Document2 pagesExercice 1: Exercice 5ahmed talhaPas encore d'évaluation
- Exercice Les Solutions Électrolytiques Et Les ConcentrationsDocument1 pageExercice Les Solutions Électrolytiques Et Les ConcentrationsLhoussaineOuaouicha76% (17)
- SD12-2S - 01 01 2019-MH (Chimie)Document3 pagesSD12-2S - 01 01 2019-MH (Chimie)nassimosPas encore d'évaluation
- Complex at IonDocument5 pagesComplex at IonAbdel Mouhcin OuchenPas encore d'évaluation
- Chimie 3 Et 4 Serie D'exercices #3 Les Solutions ElecteolytiqueDocument1 pageChimie 3 Et 4 Serie D'exercices #3 Les Solutions ElecteolytiqueayoubbouuderqaPas encore d'évaluation
- Terminale D PDFDocument75 pagesTerminale D PDFMohieddine Khaili100% (6)
- Généralités Sur Les Solutions Aqueuses 2022Document2 pagesGénéralités Sur Les Solutions Aqueuses 2022Abdou FallPas encore d'évaluation
- Fiche de Travaux Diriges Leçon1 1 CD: Fiche Proposée Par Mbita Simon 696 29 12 28Document4 pagesFiche de Travaux Diriges Leçon1 1 CD: Fiche Proposée Par Mbita Simon 696 29 12 28Youri NoghoPas encore d'évaluation
- Concentration Comps É I On I Que Exercice SDocument3 pagesConcentration Comps É I On I Que Exercice SAbdeljalil LoudainiPas encore d'évaluation
- S2 - La Concentration Et Les Solutions Électrolytiques - 1BAC - IntDocument4 pagesS2 - La Concentration Et Les Solutions Électrolytiques - 1BAC - IntMajed GharibPas encore d'évaluation
- EXERCICES Concentration Solutions ÉlectrolytiquesDocument3 pagesEXERCICES Concentration Solutions ÉlectrolytiquesAngel of perditionPas encore d'évaluation
- TDchimiesol 1Document5 pagesTDchimiesol 1MyFeed ClubPas encore d'évaluation
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 pagesSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- Reactions ComplexationDocument2 pagesReactions ComplexationRitaj-Rayane KarimPas encore d'évaluation
- 2as Electrolyte 03 21Document4 pages2as Electrolyte 03 21Abid ElyesPas encore d'évaluation
- Érie D'exercices: C H I M I EDocument4 pagesÉrie D'exercices: C H I M I EbenaichahamzaPas encore d'évaluation
- S2 - La Concentration Et Les Solutions Electrolytiques - 1BAC - IntDocument4 pagesS2 - La Concentration Et Les Solutions Electrolytiques - 1BAC - IntshaumakharmichealPas encore d'évaluation
- TD Chimie TERMINALE DDocument38 pagesTD Chimie TERMINALE DAbdoul-lahi Saâdou Moussa100% (8)
- 1 Revision-Chimie-1Document2 pages1 Revision-Chimie-1Abderahmen Haj DahmenPas encore d'évaluation
- 4 Exercice Suivi D'une Transformation ChimiqueDocument1 page4 Exercice Suivi D'une Transformation Chimiqueyounes ebahsayinPas encore d'évaluation
- Reactions PrecipitationDocument3 pagesReactions PrecipitationRitaj-Rayane KarimPas encore d'évaluation
- Exercices, Suivi D'une Transformation Chimique, ChtoukaphysiqueDocument1 pageExercices, Suivi D'une Transformation Chimique, ChtoukaphysiqueToki MimiPas encore d'évaluation
- 21 - Dissolution Des ÉlectrolytesDocument3 pages21 - Dissolution Des Électrolyteswaxifix224Pas encore d'évaluation
- TD Eq - CHMQ L1-S2 (CPGE)Document5 pagesTD Eq - CHMQ L1-S2 (CPGE)Btn Princii IsraëlPas encore d'évaluation
- Gc389nc389ralitc389s Sur Les Solutions AqueusesDocument2 pagesGc389nc389ralitc389s Sur Les Solutions AqueusesabounouraleinPas encore d'évaluation
- Travaux Diriges de P.C.T N°3 Theme: Les Solutions AqueusesDocument2 pagesTravaux Diriges de P.C.T N°3 Theme: Les Solutions AqueusesPatrick OlingaPas encore d'évaluation
- Série 1 - Les Solutions Électrolytiques Et Les ConcentratioDocument3 pagesSérie 1 - Les Solutions Électrolytiques Et Les ConcentratioAlaoui AbdallahPas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- Suivi D Une Transformation Chimique Exercices Non Corriges 3 3Document1 pageSuivi D Une Transformation Chimique Exercices Non Corriges 3 3Mohamed El Mehdi MEKHZOUMPas encore d'évaluation
- STL Clpi ChimieDocument8 pagesSTL Clpi ChimieLetudiant.frPas encore d'évaluation
- Serie Suivi D'une Transformation ChimiqueDocument1 pageSerie Suivi D'une Transformation Chimique198944Pas encore d'évaluation
- TD 2Sc Class A-B, PHDocument2 pagesTD 2Sc Class A-B, PHIyed GawaPas encore d'évaluation
- Serie N°1 Solutions Aqueuses TD 2022-2023Document1 pageSerie N°1 Solutions Aqueuses TD 2022-2023akcmerteyah1Pas encore d'évaluation
- Revision ChimieDocument4 pagesRevision Chimiemanthelotaksanti4Pas encore d'évaluation
- TD BG2 2021-2022Document5 pagesTD BG2 2021-2022honorehien04Pas encore d'évaluation
- I. Atomes / Molecules / Ions: Travaux DirigesDocument7 pagesI. Atomes / Molecules / Ions: Travaux DirigesJoël AfitouaPas encore d'évaluation
- Recueil de Chimie Tle CdeDocument27 pagesRecueil de Chimie Tle CdeKarma SambaPas encore d'évaluation
- Chimie en SolutionDocument27 pagesChimie en SolutionNabil holmes100% (3)
- TD N°3 Chimie Des SolutionsDocument6 pagesTD N°3 Chimie Des SolutionsKir3SkalPas encore d'évaluation
- Série D'exercices - Chimie Les Électrolytes - 2ème Sciences (2012-2013) MR AFFI FETHIDocument3 pagesSérie D'exercices - Chimie Les Électrolytes - 2ème Sciences (2012-2013) MR AFFI FETHIselmizahra508100% (2)
- Serie 14 Précipitation, DissolutionDocument4 pagesSerie 14 Précipitation, Dissolutionhkiri aymen100% (1)
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pages4 Exercice Suivi D'une Transformation Chimiquenabil echerrarPas encore d'évaluation
- 2 Série Acide BaseDocument3 pages2 Série Acide BaseHayet Scphy100% (1)
- Exercice 1: (6 Points) La Soude Caustique NaohDocument7 pagesExercice 1: (6 Points) La Soude Caustique NaohAli RammalPas encore d'évaluation
- Bac CD ChimieDocument2 pagesBac CD ChimieRonel TsamenePas encore d'évaluation
- S - Rie-R - Action-De-Pr - Cipitation-2.pdf Filename UTF-8''Série-Réaction-de-précipitation-2Document2 pagesS - Rie-R - Action-De-Pr - Cipitation-2.pdf Filename UTF-8''Série-Réaction-de-précipitation-2ثريا سعداويPas encore d'évaluation
- Exercices Chimie Des SolutionsDocument2 pagesExercices Chimie Des SolutionsMariatou NAZEPas encore d'évaluation
- Serie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Document4 pagesSerie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Babacar NdiayePas encore d'évaluation
- TD C567Document7 pagesTD C567Mouhamed SarryPas encore d'évaluation
- 2.1.4ecrit Cours Hemoglobines+++Document9 pages2.1.4ecrit Cours Hemoglobines+++malick SemourPas encore d'évaluation
- Mini Projet - PédologieDocument10 pagesMini Projet - PédologieBroomPas encore d'évaluation
- BiorecepteursDocument51 pagesBiorecepteursWassim WassimPas encore d'évaluation
- Groupe 3Document18 pagesGroupe 3reagPas encore d'évaluation
- 1GOTP 1213 S CHIM4 AC Durete EauDocument7 pages1GOTP 1213 S CHIM4 AC Durete EauB-R ValériePas encore d'évaluation
- 2110 ANTENNA Agroecologie-Cours WEB-2Document76 pages2110 ANTENNA Agroecologie-Cours WEB-2Z CoulPas encore d'évaluation
- Devoir de Géologie Sur Les MétauxDocument8 pagesDevoir de Géologie Sur Les MétauxFrantz-alix BrunachePas encore d'évaluation
- Série N 8 Acide BaseDocument3 pagesSérie N 8 Acide Basesalaheddine100% (1)
- Biochimie Structurale - Balouch - S3 - Pharmacie - Oct - 2020Document211 pagesBiochimie Structurale - Balouch - S3 - Pharmacie - Oct - 2020Youssef BoukhalPas encore d'évaluation
- Mémoire DATCHOSSA Tiambo Abbas - CompressedDocument112 pagesMémoire DATCHOSSA Tiambo Abbas - CompressedTOVIHO SessinouPas encore d'évaluation
- TDN°2 - 2API - Diagramme Des PhasesDocument2 pagesTDN°2 - 2API - Diagramme Des PhasesKhamlichi SoukainaPas encore d'évaluation
- PI F BIL - JG 10Document2 pagesPI F BIL - JG 10amor kermayaPas encore d'évaluation
- TD 2013 2014Document2 pagesTD 2013 2014Ap ApoPas encore d'évaluation
- Expose RahmaniDocument10 pagesExpose RahmaniMouad DahPas encore d'évaluation
- La BiosphèreDocument19 pagesLa Biosphèredam ayusoPas encore d'évaluation
- Extraction Poison MinérauxDocument27 pagesExtraction Poison Minérauxhanibekakra2003Pas encore d'évaluation
- Ouzid, SelmaDocument54 pagesOuzid, SelmaLaiadhi DjemouiPas encore d'évaluation
- Chimie Des Solutuin 2Document12 pagesChimie Des Solutuin 2Moussa TabbaiPas encore d'évaluation
- AD1 Groupes Caractéristiques Correction EleveDocument9 pagesAD1 Groupes Caractéristiques Correction ElevekandedianissyPas encore d'évaluation
- Serie N3 PDFDocument2 pagesSerie N3 PDFAzzeddine KhartaPas encore d'évaluation
- 1ère CHIMIE TOMASINODocument27 pages1ère CHIMIE TOMASINOdidier adjaoute92% (12)
- Epdm Et FKM Guide de Résistance ChimiqueDocument34 pagesEpdm Et FKM Guide de Résistance ChimiqueIVANPas encore d'évaluation
- 4.thér Restau AdhésivesDocument13 pages4.thér Restau AdhésivesFerhani OuaPas encore d'évaluation
- Chapitre3 Roches CarbonatéesDocument8 pagesChapitre3 Roches CarbonatéesYassmina LardaPas encore d'évaluation
- 1-2 Nutrition Et Croissance Bacterienne PDFDocument19 pages1-2 Nutrition Et Croissance Bacterienne PDFHary John Tsivery Rakotonjak'sParowPas encore d'évaluation
- Dentaire Baudry Clement DUMASDocument81 pagesDentaire Baudry Clement DUMAShoussem rachedPas encore d'évaluation
- PODZOSOLDocument13 pagesPODZOSOLAhmed BoussabehPas encore d'évaluation
- Cor13 4Document2 pagesCor13 4El Mounchit AyoubPas encore d'évaluation
- Polycopié de Cours Partie 1Document36 pagesPolycopié de Cours Partie 1Linda KoundziPas encore d'évaluation
- Preparation Solutions TamponsDocument4 pagesPreparation Solutions TamponsAbde Tam100% (2)