Académique Documents
Professionnel Documents
Culture Documents
D3 TS1 2023 LVN - Wahabdiop
Transféré par
couroba1971Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
D3 TS1 2023 LVN - Wahabdiop
Transféré par
couroba1971Droits d'auteur :
Formats disponibles
Pour vos cours à domicile 775136349
République Du Sénégal
Un Peuple – Un But – Une Foi
Ministère de l’Education nationale
INSPECTION D’ACADEMIE DE KAOLACK 30/03/2023 LYCEE VALDIODIO NDIAYE
DEVOIR N0 1 DE SCIENCES PHYSIQUES DU 2nd SEMESTRE
NIVEAU : TERMINALE S1 DUREE : 04 HEURES
EXERCICE 1: (06points)
Si on a l’habitude de voir l’acide chlorhydrique dans le domaine de l’industrie en tant que produit de décapage
pour métaux, ou encore un catalyseur, cet ingrédient peut tout autant réaliser des prouesses dans l’univers
domestique. L’acide chlorhydrique figure parmi les produits de débouchage naturel très efficace, mais à utiliser
avec attention.
1-Préparation de la solution d’acide chlorhydrique
Pour préparer une solution Sa d’acide chlorhydrique, on dissout un volume V = 336 mL de chlorure d'hydrogène
(HCl ), pris à la pression de 1 bar et à la température de 25°C, dans Ve = 130 mL d'eau pure. On assimile le chlorure
d'hydrogène à un gaz parfait. La dissolution n'entraîne pas de changement de volume.
1.1. Ecrire l'équation de la réaction entre le chlorure d'hydrogène et l’eau. (0,5pt)
1.2. Montrer que la quantité de matière de HCl dissoute vaut na=1,35.10-2mol en déduire la concentration
molaire volumique Ca et le pH de la solution Sa. (1pt)
2- Dosage de la solution d’acide chlorhydrique
Dans un laboratoire d’un lycée, un groupe d’élèves sous la supervision de leur professeur se propose de vérifier
cette concentration Ca de la solution Sa. Pour cela ils disposent des produits suivants :
une solution Sb d'hydroxyde de calcium de masse volumique = 2,24 kg. L-1 et de pourcentage massique
d'hydroxyde de calcium pur 13,2 %.
la solution Sa d'acide chlorhydrique de concentration molaire volumique Ca
de l'eau distillée.
2.1. Montrer que la concentration molaire volumique, Cb de la solution Sb d'hydroxyde de calcium peut s’écrire :
𝟏𝟑𝟐𝛒
Cb= 𝟕𝟒 ( ρ étant exprimée en Kg.L-1). (0,5pt)
2.2. Les élèves prélèvent 10 mL de la solution Sb qu'ils diluent pour obtenir une solution Sb’ de concentration
molaire volumique C’b = 0, 1 mol.L-1 . Déterminer le volume d’eau distillée nécessaire à la préparation de Sb’.
(0,5pt)
2.3. Afin de déterminer la concentration Ca de la solution d'acide chlorhydrique, ils dosent 20mL de celle-ci par la
solution diluée Sb’ d'hydroxyde de calcium en présence d’un indicateur coloré approprié.
2.3.1. Ecrire l'équation-bilan de la réaction. (0,5pt)
2.3.2. A l'équivalence, le volume de la solution Sb’ d'hydroxyde de calcium utilisé est de 10mL. Définir
l’équivalence acido-basique. Calculer la concentration Ca de la solution Sa d’acide chlorhydrique. Conclure.
(0,75pt)
2.3.3. Evaluer, justification à l’appui, le pH du mélange à l’équivalence. (0,25pt)
2.3.4. Les élèves auraient pu effectuer un dosage pH-métrique au lieu du dosage colorimétrique. Donner l’allure
de la courbe qu’ils obtiendraient en précisant les points remarquables. (0,5pt)
3- Mélange acide -base
A 25°C, on mélange 20 mL de la solution Sa avec 15mL de solution S’b.
3.1. Déterminer le pH de la solution finale. (0,5pt)
3.2 Calculer les concentrations molaires des différentes espèces en solution . (1pt)
Données : 1 bar = 105 Pa ; constante des gaz parfaits R = 8,31 SI ; produit ionique de l’eau à 25 °C : Ke =10 -14 .
Masses molaires atomiques en g.mol-1 : M(Ca) = 40 ; M(O) = 16 ; M(H) = 1
EXERCICE 2 : (04,5points)
LVDN 2022/2023
Page 1 sur 4
(Wahab Diop) http://physiquechimie.godaddysites.com
Pour vos cours à domicile 775136349
On dispose parallèlement au plan méridien magnétique le plan d'une bobine plate, l’axe de la bobine est
perpendiculaire la direction de la composante horizontale du champ magnétique terrestre. Au centre C de
cette bobine, une petite aiguille aimantée mobile autour d'un axe vertical se déplace devant un cadran
horizontal gradué en degrés. En l'absence de courant dans la bobine, l'aiguille s'oriente suivant la direction de
⃗⃗⃗⃗⃗
𝑩𝒉 en face de la graduation zéro. (Voir figure 5)
1. Lorsque la bobine est parcourue par un courant, elle crée en son centre un champ magnétique
perpendiculaire au plan de la bobine: On observe alors une déviation de l'aiguille aimantée qui s'immobilise
devant la graduation α.
1.1 Représenter, vue de dessus, cette expérience par un schéma où figureront la bobine, le sens du courant, les
vecteurs champs magnétiques ⃗⃗⃗⃗⃗ 𝑩𝒉 et 𝑩⃗⃗ , l'aiguille aimantée l'angle α.(0,5pt)
1.2 Exprimer la tangente de l'angle α en fonction de B et Bh . (0,25pt)
2. On fait varier l'intensité du courant travers la bobine et on mesure à chaque fois l'angle α.
Les résultats sont consignés dans le tableau suivant :
I(A) 2,0 1,6 1,2 0,8 0,4 0,0
α (° ) 70 65 58 47 28 0
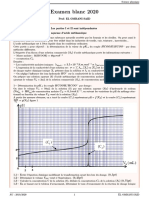
2.1 . Tracer la courbe tanα = f(l). Echelles : 1cm pour 0,2 A ; 1cm pour tanα = 0,2. (1pt)
2.2 .En déduire que B=2,74.10-5 .I Cette relation numérique est-elle généralisable à tout point autre que C ?
Justifier(1pt)
2.3 .La bobine plate de très faible épaisseur, est constituée de N = 5spires de même rayon
R= 12 cm; l'intensité du champ magnétique créé en son centre C est donnée par la relation
𝑲𝑵𝑰
B = 𝑹 · Déterminer la valeur de la constante k (0,5pt)
3. L'intensité du courant traversant la bobine étant fixée la valeur I= 2,0A, on place un fil (f) rectiligne
vertical très long la distance d = R du centre C de la bobine (figure 6). Lorsqu'on fait passer dans le fil un
courant dirigé vers le bas d'intensité I’ ; l'aiguille tourne alors s'immobilise devant la graduation
α= 65°.
𝑩−𝑩𝒉 .𝒕𝒂𝒏𝜶
3. 1. Montrer que le champ magnétique B’ crée par le fil vérifie la relation : B’= . (0,5pt)
𝒕𝒂𝒏𝜶
3.2.Préciser les caractéristiques du vecteur champ magnétique B' créé par le fil(f) parcouru par le courant
I' au point C. En déduire la valeur de l'intensité l'. (0,5pt+ 0,25pt)
On donne: Bh = 2.10-5 T; µo = 4𝝅.10-7SI
EXERCICE3 : (05points)
Abondances relatives du carbone 12 et du carbone 13. La teneur en carbone 14 étant très faible dans le carbone
naturel, on se propose de déterminer l’abondance isotopique en carbone 12 et en carbone 13 du dioxyde de
carbone provenant de la combustion complète d’un échantillon organique par la méthode de la spectrométrie de
masse. Dans le spectromètre de masse schématisé ci-dessous, le dioxyde de carbone est introduit dans la chambre
d’ionisation (I) qui produit des ions 12𝑪𝑶𝟐+ de masse m1 et des ions 13𝑪𝑶𝟐+ de masse m2.
LVDN 2022/2023
Page 2 sur 4
(Wahab Diop) http://physiquechimie.godaddysites.com
Pour vos cours à domicile 775136349
1- Accélération des ions
Les ions 12𝑪𝑶𝟐 + et 13𝑪𝑶𝟐 + produits par la chambre d’ionisation
pénètrent en O dans la chambre d’accélération (II) où ils sont
accélérés par une tension U = Vp – Vp’ établie entre deux plaques P
et P’. On se placera dans le référentiel terrestre supposé galiléen et
on négligera dans toute la suite l’action de la pesanteur.
1.1. La vitesse des ions en O est supposée négligeable, exprimer la
vitesse V0 d’un ion de masse m et de charge q à la sortie O’ de la
chambre d’accélération en fonction de U, m et q. (0,25pt)
1.2. Montrer qu’en O’ les vitesses respectives V01 et V02 des ions
12
𝑪𝑶𝟐 + et 13𝑪𝑶𝟐+ vérifient la relation : m1V012 = m2V022 (0,25pt)
1.3. Montrer que les ions 12𝑪𝑶𝟐 + et 13𝑪𝑶𝟐 + ont pour masses
respectives m1 = 7,31.10-26 kg et m2 = 7,47.10-26 kg . (0,5pt)
1.4 .En déduire les vitesses V01 et V02 . (0,5pt)
Données : U = 4.103 V ; e = 1,6.10-19 C ; le nombre d’Avogadro ℵA=6,02.1023mol-1
2 -Déviation des ions
Les ions 12𝑪𝑶𝟐 + et 13𝑪𝑶𝟐+ pénètrent en O’ dans la chambre de déviation (III) où règne un champ magnétique
⃗⃗⃗ orthogonal au plan de la figure
𝐵
2.1. Montrer qu’ils sont animés d’un mouvement circulaire uniforme. (0,5pt)
2.2. Exprimer la distance Di entre O’ et l’entrée Oi du collecteur Ci recevant l’ion en fonction de e, U, B et m.
Calculer Di pour chaque ion. On donne : B =2,5.10 -2 T. (1pt)
2.3. La vitesse de l’ion à la sortie O de la chambre d’ionisation (I) peut être faible et non nulle. A l’entrée O’ de la
chambre de déviation (III), la vitesse de l’ion varie entre v 0 et v = v0(1+ε) avec ε très faible devant l’unité.
2.3.1. Exprimer en fonction de Di et ε la largeur minimale li de la fente du collecteur recevant l’ion. (0,5pt)
2.3.2. Pour ε = 5.10-3 calculer la largeur minimale de la fente de chaque collecteur. (0,5pt)
2.2.3. En déduire les distances minimale et maximale entre les points d’entrée dans les collecteurs des ions
12
𝑪𝑶𝟐 + et 13𝑪𝑶𝟐+ . (0,5pt)
3 -Composition isotopique du carbone
Les collecteurs C1 et C2 sont munis de détecteurs de charge. Pendant une durée donnée, les quantités
d’électricité reçues par les collecteurs C1 et C2 sont respectivement 1,08 µC et 96,21 µC. Déterminer la
composition isotopique de l’échantillon analysé. (0,5pt)
EXERCICE 4: Principe de fonctionnement du cyclotron. (04,5pionts)
Schématiquement les cyclotrons combinent :
Un intense champ magnétique axial produit par des
aimants,
Un champ électrique alternatif radial de haute
fréquence entre deux éléments de forme semi-circulaire
nommés « dés ».
1. Les particules chargées sont introduites au centre du dispositif.
Le champ magnétique leur confère une trajectoire circulaire autour de
l’axe du cyclotron
La particule injectée au cœur du cyclotron va être accélérée par le champ électrique alternatif de haute fréquence entre les
« dés ». Puis, elle entre dans le « dé » suivant lorsque le champ électrique change de sens et elle est donc à nouveau
accélérée, et ainsi de suite.
Sa trajectoire devient plus périphérique du fait de son augmentation d’énergie. Elle sera éjectée de l’accélérateur avec
l’énergie adéquate à partir de cette dernière trajectoire, puis guidée et focalisée jusqu’à sa cible.
1.1. Représenter, en justifiant, au point A de la trajectoire de l’ion injecté dans le cyclotron, le vecteur
vitesse 𝑣 de l’ion et la force magnétique 𝐹 m qui s’exerce sur l’ion et le champ magnétique 𝐵 ⃗ , dans l’hypothèse où la
LVDN 2022/2023
Page 3 sur 4
(Wahab Diop) http://physiquechimie.godaddysites.com
Pour vos cours à domicile 775136349
charge q de l’ion est positive. (0,5pt)
1.2. Montrer que l’action du champ B ne permet pas d’accroître l’énergie cinétique de l’ion. (0,25pt)
1.3. Exprimer le rayon de la trajectoire en fonction de m (masse de l’ion), v (module de la vitesse de l’ion), q et B. (0,25pt)
1.4. Montrer que la durée de passage dans un demi-cylindre, notée tp , ne dépend pas de v. (0,25pt)
2. Pour accroître l’énergie cinétique de l’ion, on utilise l’action du champ électrique E résultant de la tension U
appliquée entre les deux « D ». On considère que pendant la durée très courte de passage de l’ion d’un « D » à l’autre, la
tension U reste constante.
2.1. Déterminer, en fonction de q et U les expressions des variations de l’énergie cinétique de l’ion lors de la traversée de
l’espace entre les deux « D ». (0,5pt)
2.2.Un ion est injecté dans la zone d’accélération avec une vitesse nulle. Quelle est sa vitesse
v1 au moment de la pénétration dans le premier « D » et quel est le rayon semi-circulaire ? (0,5pt)
2.3. Quelle doit être la fréquence d’oscillation de cette tension u (t ) permettant d’obtenir une
accélération de l’ion à chaque passage dans l’intervalle entre les deux « D ». (0,25pt)
2.4. Après chaque passage dans l’intervalle entre les deux « D », la vitesse de la particule ainsi que le rayon R de
sa trajectoire dans un « D » augmentent. Déterminer les suites Vk et Rk , l’indice k étant incrémenté d’une unité
à chaque demi-tour. (0,75pt)
2.5. Lorsque ce rayon finit par atteindre le rayon R D d’un « D », l’ion est alors éjecté du cyclotron. Exprimer en
fonction de m, q, B et RD l’énergie cinétique Ek de l’ion lors de son éjection. (0,5pt)
2.6. Application numérique.
Calculer, en joule, puis en MeV, l’énergie cinétique Ek d’un ion zinc Zn11+. (0,5pt)
Quelle serait la d .d.p constante qui aurait donné cette vitesse aux ions Zn11+ initialement émis sans vitesse
initiale ? Commenter (0,25pt)
On donne : B =1,67 T ; ,m= 1,06 10-25 kg ; RD = 0,465m ; e= 1,6.10-19C
FIN DU SUJET
LVDN 2022/2023
Page 4 sur 4
(Wahab Diop) http://physiquechimie.godaddysites.com
Pour vos cours à domicile 775136349
(Wahab Diop) http://physiquechimie.godaddysites.com
Vous aimerez peut-être aussi
- D3-TS2-2022-lsll 2Document4 pagesD3-TS2-2022-lsll 2Can WadePas encore d'évaluation
- DETENTEDocument4 pagesDETENTEaboronbossouPas encore d'évaluation
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR THIELLODocument3 pagesDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR THIELLOMohamed SaidiPas encore d'évaluation
- Compo 1Document4 pagesCompo 1DaboPas encore d'évaluation
- ChimieDocument3 pagesChimiewww.t.k.qPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 3ème Technique (2018-2019) MR Mejri ChokriDocument4 pagesDevoir de Contrôle N°1 - Physique - 3ème Technique (2018-2019) MR Mejri ChokriBON BANPas encore d'évaluation
- DS 7 329 2021-2022 25Document5 pagesDS 7 329 2021-2022 25Joliette KplokaPas encore d'évaluation
- Compo 2sem TS2Document15 pagesCompo 2sem TS2bara SENEPas encore d'évaluation
- Devoir de Contrôle n01 (PC) Ely Cheikh Med MouloudDocument3 pagesDevoir de Contrôle n01 (PC) Ely Cheikh Med MouloudM'KHEITIRATT AhmdPas encore d'évaluation
- EB 2023 TS2 - Esiex - WahabdiopDocument3 pagesEB 2023 TS2 - Esiex - Wahabdiopdiarra SallPas encore d'évaluation
- CO1 TS2 2019 Ia TH Wahabdiop 1Document3 pagesCO1 TS2 2019 Ia TH Wahabdiop 1Saliou SadioPas encore d'évaluation
- Bac Blanc o P 2018 Serie DDocument5 pagesBac Blanc o P 2018 Serie Delom ATAYIPas encore d'évaluation
- PC Bac CDocument4 pagesPC Bac CJean Aristide SoulamaPas encore d'évaluation
- Burkina 2015 Phys Chimie Serie D 1er Tour RempDocument4 pagesBurkina 2015 Phys Chimie Serie D 1er Tour RempEvrard KaborePas encore d'évaluation
- Fiches Bac PhysiqueDocument70 pagesFiches Bac PhysiqueFlorent Akaffou0% (1)
- Sujet PC Serie C Session 2015Document4 pagesSujet PC Serie C Session 2015riantsoaPas encore d'évaluation
- CO1 TS1 2024 Ialg - WahabdiopDocument4 pagesCO1 TS1 2024 Ialg - Wahabdioppapa samba sarrPas encore d'évaluation
- Bac Blanc N4 BiofDocument9 pagesBac Blanc N4 BiofAnas TalhiPas encore d'évaluation
- Examen Blanc SM FR 2020 2021Document8 pagesExamen Blanc SM FR 2020 2021Abderrazzak Elhaimer100% (1)
- Compo TS2 2023Document3 pagesCompo TS2 2023Bachire MbenguePas encore d'évaluation
- SP SUJET TS2-01-2022-iakaf-WahabDiopDocument4 pagesSP SUJET TS2-01-2022-iakaf-WahabDiopSerigne saliou GayePas encore d'évaluation
- Dev 1 TS2Document3 pagesDev 1 TS2DaboPas encore d'évaluation
- Bac Blanc 2019 1Document4 pagesBac Blanc 2019 1Amadou Makhtar SeckPas encore d'évaluation
- CO2 TS2 2022 LSLLDocument4 pagesCO2 TS2 2022 LSLLSerigne saliou GayePas encore d'évaluation
- Bac Blan de Ndongo 2021Document5 pagesBac Blan de Ndongo 2021Amadou Makhtar SeckPas encore d'évaluation
- Evaluation Encadreme, T Du 06 05 22 PC Tle DDocument4 pagesEvaluation Encadreme, T Du 06 05 22 PC Tle DFadila OuattaraPas encore d'évaluation
- 2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du LacDocument4 pages2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du LacJoliette KplokaPas encore d'évaluation
- Champ Magnetique 2013mai27 PDFDocument5 pagesChamp Magnetique 2013mai27 PDFAnis DahnenPas encore d'évaluation
- Examen Blan Almadina SM 2024Document5 pagesExamen Blan Almadina SM 2024Ahmed ZagourPas encore d'évaluation
- Sujet 622 CHIMIEDocument7 pagesSujet 622 CHIMIEakramadd2006Pas encore d'évaluation
- Devoir de Synthese N°2: Epreuve: Sciences PhysiquesDocument5 pagesDevoir de Synthese N°2: Epreuve: Sciences PhysiquesNour NessahPas encore d'évaluation
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - 3ème Sciences Exp (2011-2012) MR Berriche RidhaDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - 3ème Sciences Exp (2011-2012) MR Berriche RidhaSarah LOY0% (1)
- Session AVRIL 2008 Bac Blanc Epreuve de Sciences Physiques Serie C Durée: 3 Heures - Coefficient: 5Document2 pagesSession AVRIL 2008 Bac Blanc Epreuve de Sciences Physiques Serie C Durée: 3 Heures - Coefficient: 5Kerfala SoumahPas encore d'évaluation
- Lycée Malick SY de Thiès Année Scolaire 2010-2011 TS1 Durée: 4 Heures Devoir N°1 Du 2 Semestre Chimie Exercice 1 S: 2003Document3 pagesLycée Malick SY de Thiès Année Scolaire 2010-2011 TS1 Durée: 4 Heures Devoir N°1 Du 2 Semestre Chimie Exercice 1 S: 2003kathyPas encore d'évaluation
- CO1 TS1 2024 Iazg - WahabdiopDocument4 pagesCO1 TS1 2024 Iazg - Wahabdioppapa samba sarrPas encore d'évaluation
- Physiqu Serie D 2023Document3 pagesPhysiqu Serie D 2023belise faraPas encore d'évaluation
- tcch14 TD d2 2Document3 pagestcch14 TD d2 2Antoinette AdjakpleyPas encore d'évaluation
- Devoir Adomicl 1BacSM 1Document2 pagesDevoir Adomicl 1BacSM 1Salah MjtPas encore d'évaluation
- ExtraitDocument5 pagesExtraitAhmed TabanisstePas encore d'évaluation
- Dev 4 Ts 22019Document4 pagesDev 4 Ts 22019Amadou Makhtar SeckPas encore d'évaluation
- Dev 1 Sem2Document4 pagesDev 1 Sem2Mohamed MOUSSEPas encore d'évaluation
- DS 7 1133 2019-2020 86-28-34-37-25Document20 pagesDS 7 1133 2019-2020 86-28-34-37-25codjo abelPas encore d'évaluation
- Examen Blanc 2022Document4 pagesExamen Blanc 2022Serigne saliou GayePas encore d'évaluation
- DST 2è Semestre Tle D LYSOUDocument2 pagesDST 2è Semestre Tle D LYSOUdarnellebabatonPas encore d'évaluation
- BacPC PDFDocument177 pagesBacPC PDFDéyana BAKELE100% (1)
- Simili 2020-Converti PDFDocument7 pagesSimili 2020-Converti PDFyasmine mahmoud100% (1)
- CO1 TS2 2023 Iakaolack WahabdiopDocument4 pagesCO1 TS2 2023 Iakaolack Wahabdiopfalloudiop2904Pas encore d'évaluation
- Devoir de Synthèse N°3 Avec Correction - Sciences Physiques - Bac Technique (2015-2016) MR Ridha SlimiDocument7 pagesDevoir de Synthèse N°3 Avec Correction - Sciences Physiques - Bac Technique (2015-2016) MR Ridha SlimiMeriam KooliPas encore d'évaluation
- Examen National Physique Chimie SPC 2020 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2020 Normale Sujethicham lahdissouPas encore d'évaluation
- 612781dfded35sujet de Physique Chimie Bac D 1996Document5 pages612781dfded35sujet de Physique Chimie Bac D 1996isaacnewtonsm72Pas encore d'évaluation
- Togo 2016 Phyiques Series CEDocument4 pagesTogo 2016 Phyiques Series CEHAMADA1972100% (1)
- Examen Blanc N°1Document5 pagesExamen Blanc N°1sine abdellah75% (4)
- Compo 1ère S Sem 2Document3 pagesCompo 1ère S Sem 2Boubacar BaldePas encore d'évaluation
- مواضيع البكالوريا ل موريطانيا من 2002إلى 2012 PDFDocument177 pagesمواضيع البكالوريا ل موريطانيا من 2002إلى 2012 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices d'optique et d'électromagnétismeD'EverandExercices d'optique et d'électromagnétismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Abdo Guo L'eau de MerDocument11 pagesAbdo Guo L'eau de MerLaidguenouna GuenounaPas encore d'évaluation
- Master abvtHistaminSO2Document46 pagesMaster abvtHistaminSO2Fatima IrjdalnPas encore d'évaluation
- QCM de 25 Mai 2018.docx Version 1Document4 pagesQCM de 25 Mai 2018.docx Version 1sine abdellahPas encore d'évaluation
- Nationaux PC 2008-2022Document209 pagesNationaux PC 2008-2022Adam AlfargaliPas encore d'évaluation
- Labo 5 - Methylbutanol - A22Document4 pagesLabo 5 - Methylbutanol - A22Nader YassinePas encore d'évaluation
- SV SiliciumDocument25 pagesSV Siliciumremi largeauPas encore d'évaluation
- Iso 5314 1981Document8 pagesIso 5314 1981oubaha happyPas encore d'évaluation
- Preparation Solutions TamponsDocument4 pagesPreparation Solutions TamponsAbde Tam100% (2)
- E B Chimie 2018 Var 06 LRO PDFDocument3 pagesE B Chimie 2018 Var 06 LRO PDFRaul-Mihai CosteaPas encore d'évaluation
- Ap 15 11 22Document6 pagesAp 15 11 22enzo 07Pas encore d'évaluation
- Dictionnaire de Mots Medicaux PDFDocument906 pagesDictionnaire de Mots Medicaux PDFsaadomar80Pas encore d'évaluation
- Le Suivi Des Paramètres Physico-Chimiques D'anchoisDocument26 pagesLe Suivi Des Paramètres Physico-Chimiques D'anchoisSoumia AOBADPas encore d'évaluation
- Chap 7 Reactions Chimiques Acido-Basiques-2Document8 pagesChap 7 Reactions Chimiques Acido-Basiques-2bastian.cochardPas encore d'évaluation
- SUJET BAC Blanc Série D 2024Document5 pagesSUJET BAC Blanc Série D 2024saraakoa637Pas encore d'évaluation
- Série Solutions Acides Et Basiques Prof - Elhabib (WWW - Pc1.ma)Document2 pagesSérie Solutions Acides Et Basiques Prof - Elhabib (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- Screening Phytochimiques Des Plantes MedecinalesDocument13 pagesScreening Phytochimiques Des Plantes MedecinalesHarounBio-technologiePas encore d'évaluation
- Tle D-1Document6 pagesTle D-1Léo Moraless IIPas encore d'évaluation
- DS3-4M - 2021 (Pilote Nabel)Document6 pagesDS3-4M - 2021 (Pilote Nabel)Jihed HorchaniPas encore d'évaluation
- Série D'exercices N°4 - Sciences Physiques Dosage Acido-Basique PH Pousée D'archimède - 2ème Sciences Exp (2012-2013) MR Lazreg ImedDocument2 pagesSérie D'exercices N°4 - Sciences Physiques Dosage Acido-Basique PH Pousée D'archimède - 2ème Sciences Exp (2012-2013) MR Lazreg Imedahmed tounsi100% (4)
- 1S Chim ch5 React Acbas TP 09-10Document2 pages1S Chim ch5 React Acbas TP 09-10Mohamed ElouakilPas encore d'évaluation
- Tab 3Document11 pagesTab 3deziri mohamedPas encore d'évaluation
- Td13 Acides Precipitation CorrDocument2 pagesTd13 Acides Precipitation CorrAdri LebPas encore d'évaluation
- Proprietes Utilisations Des Fibres PDFDocument10 pagesProprietes Utilisations Des Fibres PDFsouadyasmina bouananiPas encore d'évaluation
- Devoir de Synthèse N°3 (Corrigé) - Sciences Physiques - Bac Technique (2010-2011) MR ALIBI ANOUARDocument8 pagesDevoir de Synthèse N°3 (Corrigé) - Sciences Physiques - Bac Technique (2010-2011) MR ALIBI ANOUARMohamed El OuahdaniPas encore d'évaluation
- Chimie 2015 SNDocument1 pageChimie 2015 SNlina elouadihPas encore d'évaluation
- Chapitre 1 - BioisostèresDocument13 pagesChapitre 1 - BioisostèresAnouar AlamiPas encore d'évaluation
- TP2 Acide BaseDocument4 pagesTP2 Acide BaseKhalil OukebdanePas encore d'évaluation
- Alcaloïdes (Généralités)Document9 pagesAlcaloïdes (Généralités)Ivan NlendPas encore d'évaluation
- Especes Chimiques en Solution AqueuseDocument7 pagesEspeces Chimiques en Solution AqueuseValéry Epee EbonguePas encore d'évaluation
- Devoir de Contrôle N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Ahmed KadriDocument4 pagesDevoir de Contrôle N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Ahmed KadriDeadly TokyoPas encore d'évaluation