Académique Documents
Professionnel Documents
Culture Documents
Exercices 2 Suivi Temporel
Transféré par
ayoubbouuderqa0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues1 pageserie
Titre original
Exercices 2 suivi temporel(2)
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentserie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues1 pageExercices 2 Suivi Temporel
Transféré par
ayoubbouuderqaserie
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
CHIMIE / Unité :1
LA TRANSF. D'UN
SYSTEME CHIMIQUE
EST-ELLE TOUJOURS
RAPIDE
EXERCICE 1
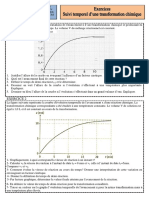
La courbe ci-dessous représente les variations de l'avancement x d’une transformation chimique se produisant en
solution aqueuse, en fonction du temps. Le volume V du mélange réactionnel est constant.
1. Justifier l’allure de la courbe en évoquant l’influence d’un facteur cinétique.
2. Quel est l’avancement final de cette réaction ?
3. Définir le temps de demi-réaction t1/2 et le déterminer.
4. Dessiner en vert l’allure de la courbe si l’évolution s’effectuait à une température plus importante.
Expliquer.
5. Dessiner en bleu l’allure de la courbe si l’évolution s’effectuait dans un grand volume d’eau. Expliquer.
EXERCICE 2
La figure suivante représente la courbe d'évolution temporelle de l'avancement x d'une réaction chimique. La
transformation chimique correspondante a été étudiée à une température constante. Le volume V de solution est
égal à 1,0 L et il est constant au cours de la transformation.
1- Graphiquement, à quoi correspond la vitesse de réaction à un instant t?
2- Calculer v0 la vitesse de réaction à l’instant de date t0 = 0 min et v1 celle à l’instant de date t1=5min.
Comparer v1 et v0.
3- Comment évolue la vitesse de réaction au cours du temps? Donner une interprétation de cette variation en
envisageant un facteur cinétique.
4- Donner la définition du temps de demi-réaction.
5- Par lecture graphique, déterminer la valeur finale atteinte par l'avancement de la réaction.
6- En déduire la valeur du temps de demi-réaction pour la transformation considérée.
7- Tracer en couleur sur le graphe l’évolution temporelle de l'avancement x pour la même transformation mais à
une température plus élevée.
Vous aimerez peut-être aussi
- Exercices 2 Suivi TemporelDocument1 pageExercices 2 Suivi Temporelكورة لايفPas encore d'évaluation
- Série D'exercices Vitesse de RéactionDocument4 pagesSérie D'exercices Vitesse de Réactionothmane GbPas encore d'évaluation
- 2007 Afrique Exo3 Sujet Cinetique 4ptsDocument3 pages2007 Afrique Exo3 Sujet Cinetique 4ptsYassine Nait SalahPas encore d'évaluation
- Cours de Cinétique ChimiqueDocument6 pagesCours de Cinétique Chimiqueilyes fellagPas encore d'évaluation
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- Cinn Chim1Document4 pagesCinn Chim1Sarra HmPas encore d'évaluation
- Chapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de RéactionDocument5 pagesChapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de Réactiona houssPas encore d'évaluation
- Cours Vitesse de ReactionDocument3 pagesCours Vitesse de ReactioncristyenPas encore d'évaluation
- Chapitre - CH2 - Vitesse de ReactionDocument5 pagesChapitre - CH2 - Vitesse de Reactionmohamed laghribPas encore d'évaluation
- Exercice (Type Bac) Suivi Temporel D - Une Transformation ChimiqueDocument2 pagesExercice (Type Bac) Suivi Temporel D - Une Transformation ChimiquephytanjaPas encore d'évaluation
- Serie 2 Suivi Temporelle D Une Transformation ChimiqueDocument7 pagesSerie 2 Suivi Temporelle D Une Transformation Chimiquee.maskarPas encore d'évaluation
- Cinétique Chimique PDFDocument6 pagesCinétique Chimique PDFAzizElheniPas encore d'évaluation
- Chapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDDocument11 pagesChapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDKarim EL HAJJIPas encore d'évaluation
- Activité Suivi Temporel Par TitrageDocument1 pageActivité Suivi Temporel Par TitrageAicha Daou100% (1)
- 2012 Metropole Exo3 Sujet CinetiqueConducti 4ptsDocument4 pages2012 Metropole Exo3 Sujet CinetiqueConducti 4ptsColombe PratePas encore d'évaluation
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 pagesExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixPas encore d'évaluation
- Cours 2 - Suivi TemporelDocument9 pagesCours 2 - Suivi TemporelHamza BerahmaPas encore d'évaluation
- ds1 CinDocument3 pagesds1 Cinmohamed laghribPas encore d'évaluation
- Chapitre I Rappels Partie IDocument8 pagesChapitre I Rappels Partie IJojo BoubPas encore d'évaluation
- Serie 2 Suivi 1234Document4 pagesSerie 2 Suivi 1234Ibtissam AttaouanziPas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- 2012 Metropole Exo3 Sujet CinetiqueConducti 4ptsDocument4 pages2012 Metropole Exo3 Sujet CinetiqueConducti 4ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Cours - Suivi TemporelDocument7 pagesCours - Suivi TemporelRedouane Reda100% (2)
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- Resume PC Biof Partie ChimieDocument8 pagesResume PC Biof Partie Chimielabiadsihame1Pas encore d'évaluation
- PhyDocument1 pagePhyŤăhã ÊìîPas encore d'évaluation
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- 02-Vitesse SerieDocument5 pages02-Vitesse SerieboustakatbPas encore d'évaluation
- Lecon 2 Chimie Vitesse D Une Reaction ChimiqueDocument1 pageLecon 2 Chimie Vitesse D Une Reaction ChimiqueKais GuesmiPas encore d'évaluation
- Révision Equilibre ChimiqueDocument6 pagesRévision Equilibre ChimiquechadaPas encore d'évaluation
- Applications Suivi20.21Document3 pagesApplications Suivi20.21Phobos ElfaPas encore d'évaluation
- Suivi Temporel 22Document11 pagesSuivi Temporel 22The King. YTPas encore d'évaluation
- Suivi Temporel D - Une TransformationDocument6 pagesSuivi Temporel D - Une TransformationerrairachidPas encore d'évaluation
- Cours Suivi TemporelDocument3 pagesCours Suivi Temporelathn.maryamPas encore d'évaluation
- Chapitre 1 Cinetique TFDocument4 pagesChapitre 1 Cinetique TFkathyPas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Activites 4Document1 pageSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Activites 4HABOUCHI SOUFIAPas encore d'évaluation
- 2.déterminer La Vitesse de Réaction Et Le Temps de Demi-Réaction PDFDocument3 pages2.déterminer La Vitesse de Réaction Et Le Temps de Demi-Réaction PDFkimmikPas encore d'évaluation
- Chapitre 1Document5 pagesChapitre 1Manel AbrichePas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsdansoujosemorelePas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptspopi22377Pas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsĀbdï FïgõPas encore d'évaluation
- Cours Avancement D'une Reaction 2015Document2 pagesCours Avancement D'une Reaction 2015Daghsni SaidPas encore d'évaluation
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- Cinétique S5 2016Document122 pagesCinétique S5 2016Mohamed EL FAGHLOUMIPas encore d'évaluation
- Controle 1 Bac SC 2019 MR Nabil AbdmoulehDocument6 pagesControle 1 Bac SC 2019 MR Nabil AbdmoulehMouhamed Ali SahbaniPas encore d'évaluation
- TD Calcul Des Réacteurs Chimiques Master Matériaux FPNDocument37 pagesTD Calcul Des Réacteurs Chimiques Master Matériaux FPNHã Nã100% (2)
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2019-2020) MR Taoufik BACCARIDocument5 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2019-2020) MR Taoufik BACCARIaziz003Pas encore d'évaluation
- 2 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument31 pages2 - Suivi Temporel D'une Transformation - Vitesse de Réactionlahcen essPas encore d'évaluation
- Cours 2 Chimie-eleve-TRAFI 2BACDocument9 pagesCours 2 Chimie-eleve-TRAFI 2BACEnidroun OutPas encore d'évaluation
- Devoir Synthèse-1 - 4 ScExp-2022Document6 pagesDevoir Synthèse-1 - 4 ScExp-2022Riadh BesbesPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Suivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteDocument7 pagesSuivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteYassine RabikPas encore d'évaluation
- Https0330088s.index Education - netpronoteFichiersExternes8aDocument7 pagesHttps0330088s.index Education - netpronoteFichiersExternes8athomasPas encore d'évaluation
- Chapitre 3Document29 pagesChapitre 3chiraz biotechPas encore d'évaluation
- Exercices 1 Suivi TemporelDocument2 pagesExercices 1 Suivi TemporelayoubbouuderqaPas encore d'évaluation
- Transformation affine: Libérer des perspectives visuelles : explorer la transformation affine en vision par ordinateurD'EverandTransformation affine: Libérer des perspectives visuelles : explorer la transformation affine en vision par ordinateurPas encore d'évaluation