Académique Documents
Professionnel Documents
Culture Documents
Tp.3 Titrage PH Metrique Et Colorimétrique
Transféré par
Malak El jadiri0 évaluation0% ont trouvé ce document utile (0 vote)
35 vues5 pagesTitre original
Tp.3 titrage pH metrique et colorimétrique
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
35 vues5 pagesTp.3 Titrage PH Metrique Et Colorimétrique
Transféré par
Malak El jadiriDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 5
Tp
: Titrage ph-métrique et colorimétrique
Objectif :
Matériel :
Bécher
Burette
Pipette jaugée de ml
Agitateur et ph mètre
Ordinateur avec logiciel régressi
Solutions : - Vinaigre dilué 10 fois
- Solution de soude à 0.1 mol/l
- indicateurs colorés (bleu de bromothymol)
Protocole :
Etalonner le pH-mètre
Rincer les différents éléments : burette (soude) pipette (solution
acide) béchers (eau distillée)
Remplir la burette de soude et la purger de l’air qu’elle contient, puis
régler 0.
Prélever un volume Va=10ml de solution diluée de vinaigre et le
placer dans un bécher de 100 ml.
Ajouter 5 goutes de bleu de bromothymol
Placer la sonde du pH-mètre dans le bécher. Vérifier qu’elle est
immergée (ajouter de l’eau distillée si nécessaire).
Mettre l’agitation en marche
Relever le ph de la solution pour vb=0
Introduire la soude 0.5 ml par 0.5, relever le ph et l’équivalence
ensuite s’arrêter à vb=25 ml
Dressons un tableau de mesure
Tracer la courbe donnant l’évolution du pH en fonction du volume de
la solution titrante versée pH= f(Vb)
1ère partie : Exploitation des résultats du titrage
1- H3o+ + Oh- = 2 H2O
2- Cette réaction chimique doit être impérativement :
• Rapide
• Totale
• Unique
3- Déterminons la concentration C0 en acide éthanoïque de ce
vinaigre
Cb x Vb = Ca x Va
Ca= cb x vb / va
Ca = 0.10*25*10 ^-3 /10*10^-3 =0.25
Cm/cf=vf/vm=f
C0 = ca*10=2.5 mol/l
4- Le vinaigre est dilué 10 fois pour préparer 100,0 ml d'une solution S
de vinaigre dilué.
Prélever 10,0 ml de vinaigre à l'aide d'une pipette jaugée + pipeteur.
Placer dans une fiole jaugée de 100,0 mL et compléter avec de l'eau
distillée jusqu'au trait de jauge. Boucher et agiter pour rendre
homogène.
5-
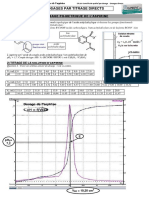
6- La courbe présente 3 parties distinctes :
Pour VB variant de 0 à 14 ml, le pH varie peu (voir la courbe). Le
réactif limitant est OH - , le réactif en excès HCOOH impose un pH
acide.
Pour Vb variant de 14 à 16 mL, on observe une importante variation
de pH. Pour Vbéquivalence = 14 mL, la courbe change de concavité
(voir la courbe).
Pour Vb supérieur à 16 mL, le pH augmente lentement vers la valeur
pH = 12,3 (correspondant au pH de la solution de soude ajoutée) (voir
la courbe). Le réactif limitant est H3O +, le réactif en excès est OH - .
Le milieu est de plus en plus basique.
La connaissance de Vbéquivalence = 14 mL permet de placer, sur la
courbe, le point d'équivalence E.
Méthode de la dérivée :
7- On remarque qu’en ce point singulier E, le coefficient directeur de
la tangente à la courbe passe par la grandeur dpH/dVb sa valeur
maximale. On peut donc dire que le volume VB équivalence
coïncide avec l'abscisse de l'extremum de cette courbe.
8- L’abscisse de l’extremum de la courbe est 14,5 . Le pH de la
solution est de 7.2
Méthode des tangentes :
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Rapport Degre D'aciditeDocument5 pagesRapport Degre D'aciditezeinabhatemtarchichiPas encore d'évaluation
- Variation Du PH Au Cours Des Dosages Acide PDFDocument13 pagesVariation Du PH Au Cours Des Dosages Acide PDFAzizElheniPas encore d'évaluation
- Titrage Du Vinaigre CorrectionDocument4 pagesTitrage Du Vinaigre CorrectionOstensible50% (2)
- TP N2 PH MetrieDocument15 pagesTP N2 PH MetrieSellam Anis100% (2)
- Null 231221 095942Document2 pagesNull 231221 095942zeinabhatemtarchichiPas encore d'évaluation
- TP Chimie AnalytiqueDocument13 pagesTP Chimie AnalytiqueFedoua Benamer100% (1)
- Chimie-TP5 Suivi Phmetrique de L'acide Ethanoique Par La SoudeDocument2 pagesChimie-TP5 Suivi Phmetrique de L'acide Ethanoique Par La SoudeChartier Julien100% (1)
- 07 Titrage PH Vinaigre CorrectionDocument4 pages07 Titrage PH Vinaigre CorrectionChartier Julien86% (7)
- Rapport Precision Des InstrmentsDocument7 pagesRapport Precision Des InstrmentszeinabhatemtarchichiPas encore d'évaluation
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArPas encore d'évaluation
- TPDosage Vinaigre CorDocument3 pagesTPDosage Vinaigre CorCamille LegavePas encore d'évaluation
- Chimie-TP6 Dosage D'un Produit CommercialDocument3 pagesChimie-TP6 Dosage D'un Produit CommercialChartier JulienPas encore d'évaluation
- 07 - Titrage PH VinaigreDocument3 pages07 - Titrage PH VinaigreChartier Julien50% (2)
- Série DosageDocument8 pagesSérie DosageAicha Daou100% (1)
- TP 1 Titrage PhmetriqueDocument3 pagesTP 1 Titrage Phmetriqueelhidhab2014Pas encore d'évaluation
- DOSAGE COLORIMETRIQUE Et Phmétrique Aspirine CorrigéDocument3 pagesDOSAGE COLORIMETRIQUE Et Phmétrique Aspirine Corrigétdi44617Pas encore d'évaluation
- TleD - CH - L11 - Dosage Acido-BasiqueDocument10 pagesTleD - CH - L11 - Dosage Acido-BasiqueHamadi DialloPas encore d'évaluation
- Ds Destop CorrecDocument11 pagesDs Destop CorrecDenis BurettePas encore d'évaluation
- TP03 Et TP04 DosageDocument4 pagesTP03 Et TP04 DosageHawa COULIBALYPas encore d'évaluation
- Titrages Acido-Basiques PDFDocument4 pagesTitrages Acido-Basiques PDFtarikPas encore d'évaluation
- AE04-Titrage Destop-REGRESSI-2022-eleves - 2Document4 pagesAE04-Titrage Destop-REGRESSI-2022-eleves - 2Yazine ZeidPas encore d'évaluation
- tp1 VinaigreDocument2 pagestp1 Vinaigrelamichi boudjemaaPas encore d'évaluation
- Chap 5 ChiDocument7 pagesChap 5 ChiMahmoud FerhatPas encore d'évaluation
- 04 PH TauDocument5 pages04 PH TauChartier JulienPas encore d'évaluation
- TP Élyott Et ChloéDocument2 pagesTP Élyott Et ChloévilardPas encore d'évaluation
- TP Dosage PhmetriqueDocument1 pageTP Dosage PhmetriqueNesrine BouzidPas encore d'évaluation
- Indicateurs ColorésDocument3 pagesIndicateurs ColorésAicha DiabyPas encore d'évaluation
- TP Dosage de L Acidite D Un VinaigreDocument3 pagesTP Dosage de L Acidite D Un VinaigreDjahid Jo75% (4)
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Serie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020Document4 pagesSerie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020kathyPas encore d'évaluation
- TP2 PDFDocument3 pagesTP2 PDFAz-eddine KaibaPas encore d'évaluation
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 pagesSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Pas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Acidite D Un VinaigreDocument6 pagesAcidite D Un Vinaigreboudriat ahmedPas encore d'évaluation
- S7 Chapitre 03 Reaction Acide Base DosageDocument16 pagesS7 Chapitre 03 Reaction Acide Base DosageRADWAN100% (2)
- 2005 National Correction Exo3 IndicColor 6 5ptsDocument2 pages2005 National Correction Exo3 IndicColor 6 5ptsYassir RochdPas encore d'évaluation
- TP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEDocument7 pagesTP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEbouaiedanissa61Pas encore d'évaluation
- Dosage Acido-Basique FRDocument3 pagesDosage Acido-Basique FRAicha DaouPas encore d'évaluation
- TP de Chimie Destop Corrige AKDocument2 pagesTP de Chimie Destop Corrige AKpiminkPas encore d'évaluation
- ChimEq - Syllabus TP - 2023-2024Document26 pagesChimEq - Syllabus TP - 2023-2024juanlognoulPas encore d'évaluation
- Dosage Acido BasiqueDocument33 pagesDosage Acido Basiquemed100% (1)
- 3eme Seq4 tp3Document2 pages3eme Seq4 tp3nael.zakariaPas encore d'évaluation
- Série Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943Document2 pagesSérie Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943dememamebousso09Pas encore d'évaluation
- tp8 Dosage Phmetrique PDFDocument2 pagestp8 Dosage Phmetrique PDFMokhtarBensaidPas encore d'évaluation
- Cours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneDocument5 pagesCours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneTawfiq Weld EL ArbiPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- 2006-2007 TP DétartrantpourcafetièreélectriqueDocument3 pages2006-2007 TP DétartrantpourcafetièreélectriqueDaniela DinicaPas encore d'évaluation
- TP de Chimie Destop Corrigé AKDocument2 pagesTP de Chimie Destop Corrigé AKpiminkPas encore d'évaluation
- Titrage VinaigreDocument2 pagesTitrage VinaigreDjahid Jo100% (2)
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- TP DosageDocument8 pagesTP DosageYosr Rhouma67% (3)
- tp4 ConductimétrieDocument5 pagestp4 ConductimétrieMalak El jadiriPas encore d'évaluation
- Cours Gratuit - Com Id 11419 2Document3 pagesCours Gratuit - Com Id 11419 2Malak El jadiriPas encore d'évaluation
- Id 11419 1Document1 pageId 11419 1Malak El jadiriPas encore d'évaluation
- Reg 1 Ann 1Document3 pagesReg 1 Ann 1Malak El jadiriPas encore d'évaluation
- Définition Du Présupposé + Exercices D'applicationDocument2 pagesDéfinition Du Présupposé + Exercices D'applicationMalak El jadiriPas encore d'évaluation
- DissertationDocument10 pagesDissertationMalak El jadiriPas encore d'évaluation
- Point de Vue Amanda BinetDocument4 pagesPoint de Vue Amanda BinetMalak El jadiriPas encore d'évaluation
- TP Ens SVT 3Document2 pagesTP Ens SVT 3Malak El jadiriPas encore d'évaluation
- Chap 2, TD1 - ReplicationDocument2 pagesChap 2, TD1 - ReplicationMalak El jadiriPas encore d'évaluation
- Définition Du Présupposé + Exercices D'applicationDocument2 pagesDéfinition Du Présupposé + Exercices D'applicationMalak El jadiriPas encore d'évaluation
- DS1 Philo VéritéDocument1 pageDS1 Philo VéritéMalak El jadiriPas encore d'évaluation
- La Planète Terre Enseignement ScientifiqueDocument15 pagesLa Planète Terre Enseignement ScientifiqueMalak El jadiriPas encore d'évaluation
- TP Pour Activite AnageneDocument2 pagesTP Pour Activite AnageneMalak El jadiriPas encore d'évaluation
- Chapitre 1 - Les - Conditions - de - La - Vie - Une - Particularite - de - La - TerreDocument14 pagesChapitre 1 - Les - Conditions - de - La - Vie - Une - Particularite - de - La - TerreMalak El jadiriPas encore d'évaluation
- EXERCICES Oxydo ReductionDocument2 pagesEXERCICES Oxydo ReductionMalak El jadiriPas encore d'évaluation
- 2009 Antilles Exo3 Sujet EauDistillee PH 4ptsDocument2 pages2009 Antilles Exo3 Sujet EauDistillee PH 4ptsMalak El jadiriPas encore d'évaluation
- Loi de Beert LambertDocument3 pagesLoi de Beert LambertMalak El jadiriPas encore d'évaluation
- Norme Marocaine: Qualité de L'eauDocument17 pagesNorme Marocaine: Qualité de L'eauYousri OfficePas encore d'évaluation
- Sulfate D'ammonium Et de Fer (III)Document4 pagesSulfate D'ammonium Et de Fer (III)sumaleePas encore d'évaluation
- Muro Cortina Panel PIU' 500/40Document24 pagesMuro Cortina Panel PIU' 500/40kjusolPas encore d'évaluation
- Examen BtsDocument31 pagesExamen BtsOxford Egy OngoliPas encore d'évaluation
- Chapitre 1Document6 pagesChapitre 1KhaLed BenKaPas encore d'évaluation
- C1 Diagrammes Potentiel PH TD PDFDocument12 pagesC1 Diagrammes Potentiel PH TD PDFNourchaine MadiouniPas encore d'évaluation
- UntitledDocument30 pagesUntitledgamingo YTBPas encore d'évaluation
- Orga 15Document3 pagesOrga 15Ishak NkttPas encore d'évaluation
- DS 16 17 RTPDocument3 pagesDS 16 17 RTPPFEPas encore d'évaluation
- 90245400T90Z002K000Document24 pages90245400T90Z002K000Abdesselam DaghdaghePas encore d'évaluation
- Synthese Des Especes Chimiques Resume de Cours 1Document1 pageSynthese Des Especes Chimiques Resume de Cours 1TA GaraPas encore d'évaluation
- Chapitre 1 Corrosion H Et G 2Document18 pagesChapitre 1 Corrosion H Et G 2GHARBAOUI AbirPas encore d'évaluation
- 2NDE Chap 4 Exercices d' Application-ÉlèveDocument3 pages2NDE Chap 4 Exercices d' Application-Élèvesarah dpsPas encore d'évaluation
- 000586658 (1)Document88 pages000586658 (1)Imene ImenePas encore d'évaluation
- Controle Qualite MP-PF - 2019-2020 5e Année PharmacieDocument7 pagesControle Qualite MP-PF - 2019-2020 5e Année Pharmaciezineb fellaPas encore d'évaluation
- Phot Cata Chapitre IDocument11 pagesPhot Cata Chapitre IHk EhPas encore d'évaluation
- Catalogue Parcours de Formations Longues Durées IAP 2021Document59 pagesCatalogue Parcours de Formations Longues Durées IAP 2021YounesNacerPas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- cلDocument8 pagescلkhaledPas encore d'évaluation
- Determination Du Degré Alcoolique D'Un Vin: Sujet 7Document2 pagesDetermination Du Degré Alcoolique D'Un Vin: Sujet 7clintonnembot136Pas encore d'évaluation
- Devoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Document8 pagesDevoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Boubaker ChaabaniPas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Thèse CompresséDocument166 pagesThèse Compressétahaniu gouaouPas encore d'évaluation
- Généralités Sur Le PhosphoreDocument6 pagesGénéralités Sur Le Phosphorejawad azPas encore d'évaluation
- Etude de La Contamination en Métaux Lourds, PB & CD, Dans Les Produits de La Pêche Au Maroc - OUARHACH AichaDocument66 pagesEtude de La Contamination en Métaux Lourds, PB & CD, Dans Les Produits de La Pêche Au Maroc - OUARHACH AichasktanePas encore d'évaluation
- Donnéés de Conception SORAZDocument93 pagesDonnéés de Conception SORAZharouna souley hega100% (1)
- TPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHDocument7 pagesTPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHArradPas encore d'évaluation
- Cours Et Travaux Dirigés Atomistique Et Chimie OrganiqueDocument89 pagesCours Et Travaux Dirigés Atomistique Et Chimie OrganiqueJihane BraichePas encore d'évaluation
- Livret Révision 3éme Modfié-1Document20 pagesLivret Révision 3éme Modfié-1legogothe.1Pas encore d'évaluation
- Moule D Injection Plastique 1705769404Document11 pagesMoule D Injection Plastique 1705769404Labzai YasSinePas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation