Académique Documents
Professionnel Documents
Culture Documents
Acidite D Un Vinaigre
Transféré par
boudriat ahmedTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Acidite D Un Vinaigre
Transféré par
boudriat ahmedDroits d'auteur :
Formats disponibles
Dosage de l’acidité d’un vinaigre
TP N° 2 : Dosage de l’acidité d’un vinaigre
I- But du TP
Le but de ce TP est de vérifier, à partir d’un dosage volumétrique et colorimétrique acido-
basique, le degré d’acidité d’un vinaigre blanc de commerce, c'est-à-dire la masse d’acide
éthanoïque pur contenu dans 100 g de vinaigre.
II- Rappels théoriques
II-1 définitions
Il existe plusieurs définitions pour les acides et les bases:
* Selon Arrhénius
Un acide est une substance qui donne des ions H+ dans l'eau :
HCl H
2O
H+ + Cl-, acide fort (réaction totale)
CH3COOH ⇄ H+ + CH3COO-, acide faible (réaction équilibrée)
Une base est une substance qui donne des ions OH- dans l'eau :
NaOH H
2O
OH- + Na+, base forte
NH4OH ⇄ OH- + NH4+, base faible
* Selon Brönsted
Un acide est une substance susceptible de donner des protons H+.
Une base est une substance susceptible d’accepter ou de fixer des protons H+.
On constate qu’à un acide correspond toujours une base conjuguée et réciproquement ; on
parle de couple acide/base. Par ailleurs, un proton n’existe jamais à l’état libre. Pour qu’un
acide libère un proton, il faut la présence d’une base susceptible de capter le proton libéré.
Cette base sera souvent (mais pas toujours) le solvant eau, ce qui donnera l’ion hydronium
H3O+.
* Selon Lewis
Un acide est un accepteur de doublets d'électrons et une base est un donneur de doublets
d'électrons.
Travaux Pratiques Licence SM et ST Page 19
Dosage de l’acidité d’un vinaigre
II-2 Autodissociation de l’eau
L’eau se comporte à la fois comme acide et base, on dit qu’elle est amphotère. D’où
l’équilibre d’autodissociation de l’eau :
𝐇𝟐 𝐎 + 𝐇𝟐 𝐎 ⇄ 𝐎𝐇 − + 𝐇𝟑 𝐎+
A1 B2 B1 A2
Le produit ionique de l'eau est la constante d'équilibre associée à l'équation d'autodissociation
de l'eau. Cette constante est notée Ke. On a donc: Ke= [H3O+] [OH-] avec Ke= 10-14 à 25°C.
II-3 Notion de pH
Le pH mesure l’acidité d’une solution.
pH = - log10 [H3O+].
Pour une solution acide, [H3O+] > [OH-] donc pH < 7.
Pour une solution basique, [H3O+] < [OH-] donc pH > 7.
Une solution neutre est telle que [H3O+] = [OH-] donc son pH =7.
II-4 Réactions acido-basiques
La réaction acido-basique résulte du transfert de protons H+ entre l’acide d’un couple
acide1/base1 et la base d’un autre couple acide2/base2.
Pour écrire l'équation de la réaction qui a lieu entre les deux couples, on écrit d'abord les
demi-équations associées, puis on les additionne de façon à ne plus avoir les ions
hydronium H3O+ :
Acide1 + H20 ⇄ Base1 + n H3O + et Base2 + n H3O + ⇄ Acide2
Acide1 + Base2 ⇄ Base1 + Acide2 (équation-bilan)
II-5 Dosage (ou titrage) acido-basique
Doser une espèce chimique en solution consiste à déterminer la concentration molaire de
cette espèce. Cela revient aussi à déterminer la quantité de matière de cette espèce présente
dans un volume donné de cette solution.
Le choix d'une réaction de dosage doit satisfaire à trois exigences. Elle doit être:
* unique (non parasitée par une autre réaction ayant les mêmes réactifs mais des produits
différents),
* totale (disparition d'au moins l'un des réactifs mis en présence),
* rapide (parvenir à son terme instantanément ou dans un délai très bref).
Travaux Pratiques Licence SM et ST Page 20
Dosage de l’acidité d’un vinaigre
Un titrage acido-basique est un dosage au cours duquel la réaction est une réaction acido-
basique. Il peut être suivi par :
* colorimétrie en utilisant un indicateur coloré.
* pH-métrie en suivant l’évolution du pH au cours de la réaction.
* conductimétrie en suivant l’évolution de la conductivité de la solution au cours de la
réaction.
Un titrage acido-basique colorimétrique consiste à repérer l'équivalence à l'aide du virage
d'un indicateur coloré acido-basique approprié, placé en petite quantité dans la prise d’essai
d’un des réactifs.
Rappelons qu’à l’équivalence, les réactifs sont introduits dans les proportions
stœchiométriques de la réaction de dosage et on aura : NAcide.VAcide = NBase.VBase
Dans le cas d’un monoacide et d’une monobase, cette relation devient :
CAcide.VAcide = CBase.VBase.
Remarque
* Lorsque l’on titre un acide fort par une base forte (ou inversement), l’équation du dosage
sera : 𝐇𝟑 𝐎+(𝐚𝐪) + 𝐎𝐇 −(𝐚𝐪) → 𝟐 𝐇𝟐 𝐎(𝐥) .
* Dans le cas du titrage d’un acide faible (HA) par une base forte (BOH), l’équation bilan de
la réaction de dosage s’écrit : 𝐇𝐀 (𝐚𝐪) + 𝐎𝐇 −(𝐚𝐪) → 𝐀−(𝐚𝐪) + 𝐇𝟐 𝐎(𝐥) .
Choix d’un indicateur coloré
Un indicateur coloré convient pour le titrage si sa zone de virage (ou zone de teinte
sensible) contient le pH à l'équivalence. Le saut de pH étant en général très brutal à
Travaux Pratiques Licence SM et ST Page 21
Dosage de l’acidité d’un vinaigre
l'équivalence, l'ajout d'une seule goutte de réactif provenant de la burette suffit à provoquer le
virage de l'indicateur.
Définition et propriétés des indicateurs colorés
Un indicateur coloré acido-basique (ou indicateur de pH) est un couple acide/base, noté
HIn/In-, dont les espèces conjuguées ont des teintes (ou couleurs) différentes. En solution
aqueuse, la forme acide (HIn) et la forme basique (In-) participent à l’équilibre chimique
suivant :
𝐇𝐈𝐧(𝐚𝐪) + 𝐇𝟐 𝐎(𝐥) ⇄ 𝐇𝟑 𝐎+(𝐚𝐪) + 𝐈𝐧−(𝐚𝐪)
Acide (Couleur A) Base conjuguée (Couleur B)
La constante de cet équilibre est la constante d’acidité Ka du couple HIn/In− :
H 3 O + In −
Ka = .
HIn éq
La forme acide et sa base conjuguée ont des couleurs différentes. La couleur de la solution
que l’on observe dépend de la forme prédominante et donc du pH de la solution.
* Si [HIn] >10[In-] pH < pKa-1, la solution prend alors la couleur A de la forme acide ;
* Si [In-] > 10[HIn] pH > pKa+1, la solution prend alors la couleur B de la forme basique ;
* Si [HIn] = [In-] pH = pKa et on a un mélange des 2 couleurs A et B ou teinte sensible.
On considère donc que la zone de virage (non distinction des 2 couleurs) est située dans le
domaine
pKa-1 < pH < pKa+1. Le tableau ci-dessous donne quelques exemples d’indicateurs acido-
basiques usuels :
Nom de l’indicateur Intervalle du pH Couleur dans la zone acide Couleur dans la zone basique
Bleu de bromothymol 6,0 – 7,6 Jaune Bleu
Rouge de phénol 6,4 – 8,0 Jaune Rouge
Phénolphtaléine 8,0 – 10,0 Incolore Rose foncé
Bleu de bromophénol 3,0 – 4,7 Orange-jaune Violet
Exemples
* A l’équivalence du dosage d’un acide fort par une base forte, le pH est égal à 7, à 25°C. On
peut alors utiliser le bleu de bromothymol comme indicateur coloré acido-basique car sa zone
de virage (6 - 7,6) contient le pH à l’équivalence.
* Lors du dosage d’un acide faible par une base forte, la solution à l’équivalence est basique,
le pHéq est aux alentours de 8 (un peu plus). D’après les indicateurs donnés, la phénophtaléine
Travaux Pratiques Licence SM et ST Page 22
Dosage de l’acidité d’un vinaigre
semble le mieux convenir car le pH à l’équivalence appartient à la zone de virage de cet
indicateur coloré.
III- Manipulations
III-1 Principe
Doser une espèce dans une solution signifie déterminer la concentration de cette espèce dans
la solution. Un titrage est une méthode de dosage mettant en œuvre une réaction chimique
entre l'espèce à doser (espèce titrée) et un réactif convenablement choisi, appelé réactif titrant.
Il s’agit dans ce TP de réaliser un dosage volumétrique et colorimétrique acido-basique pour
vérifier le degré d’acidité d’un vinaigre blanc de commerce.
III-2 Matériel et produits
Matériel Produits
- Béchers - Burette graduée - Vinaigre blanc de commerce (5°)
- Erlenmeyers - Solution de soude (NaOH) 0,1 M
- Pipette graduée de 10 mL - Phénolphtaléine
- Fiole jaugée de 100 mL - Eau distillée
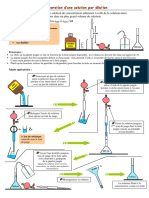
III-3 Mode opératoire
a) Dilution de la solution commerciale (S0)
On veut effectuer une dilution de 10 de la solution commerciale (S0).
CM
Solution mère (S0) : CM, VM → Solution fille (S) : VF = 100 mL et F = = 10. Le facteur
CF
VF
de dilution étant égal à 10 VM = = 10 mL.
10
b) Dosage de la solution diluée (S) par NaOH
- Remplir la burette, préalablement rincée, avec la
solution de soude (NaOH) de concentration molaire
CB = 0,1 mol.L-1.
- Vérifier l’absence de bulle d’air dans le bas de la
burette et ajuster au zéro.
- Dans un erlenmeyer, introduire avec précision
Vp = 10,0 mL de solution S.
- Ajouter alors deux gouttes de phénolphtaléine (notée
φφ).
Travaux Pratiques Licence SM et ST Page 23
Dosage de l’acidité d’un vinaigre
- Procéder au dosage en faisant d’abord un dosage rapide puis un dosage précis (à la goutte)
trois fois.
Dosage rapide (détermination d’un encadrement du volume équivalent)
- Ajouter la solution de soude millilitre par millilitre et noter la couleur de la solution.
Lorsque la solution change de couleur, noter le volume équivalent correspondant.
Ce dosage permet d’encadrer la zone d’équivalence.
Dosage précis (ou dosage à la goutte)
- Recommencer à nouveau le titrage depuis le début.
- Verser rapidement la solution de soude jusqu’à 1,5 mL ou 2 mL de la zone d’équivalence,
puis goutte à goutte jusqu’à l’équivalence. Noter alors le volume équivalent Véq.
III-4 Exploitation des résultats de mesure
A l’équivalence : NA.VA = NB.VB. Or CH3COOH est un monoacide et NaOH est une
monobase, la relation précédente devient : CA.VA = CB.VB. On aura donc : C.Vp = CB.Véq
𝐂𝐁 𝐕é𝐪
avec Vp le volume de la prise d’essai de la solution S C = .
𝐕𝐩
Or la solution commerciale est F fois plus concentrée C0 = F.C.
On définit le degré d’acidité d’un vinaigre (D°) comme étant la masse d’acide éthanoïque
pur (CH3COOH) contenu dans 100 g de vinaigre.
C0 représente le nombre de moles de CH3COOH dans 1000 mL de vinaigre. Ce nombre de
moles est noté n0.
En passant aux masses, on aura :
m
Pour l’acide éthanoïque : m0 = Mn0 et pour le vinaigre : ρvinaigre = m = ρvinaigre . V
V
avec V = 1000 mL. On obtient alors :
Mn0 (g) → 1000vinaigre (g)
D° → 100 (g)
100Mn 0 𝐌𝐧𝟎
D° = 1000 ρ D° = 𝟏𝟎𝛒
vinaigre 𝐯𝐢𝐧𝐚𝐢𝐠𝐫𝐞
Remarque
La relation finale entre la grandeur calculée et les grandeurs mesurées est telle que :
𝐅𝐂𝐁 𝐕é𝐪 𝐌
D° = 𝟏𝟎𝐕
𝐩 𝛒𝐯𝐢𝐧𝐚𝐢𝐠𝐫𝐞
On donne : Vp = 10,0 mL, F = 10, CB = 0,1 M, MCH 3 COOH = 60 g.mol-1 et ρvinaigre =
Travaux Pratiques Licence SM et ST Page 24
Vous aimerez peut-être aussi
- Le Système EndocrinienDocument30 pagesLe Système EndocrinienMoni RethPas encore d'évaluation
- Troubles de L Equilibre Acido-BasiqueDocument20 pagesTroubles de L Equilibre Acido-BasiqueBendris Osman100% (1)
- Les Formules de BiophysiqueDocument3 pagesLes Formules de BiophysiqueChristian Ngala100% (1)
- Biophysique TD Corriges Diffusion Dans La Phase LiquidesDocument4 pagesBiophysique TD Corriges Diffusion Dans La Phase LiquidesYacine AchPas encore d'évaluation
- TD1 AtomistiqueDocument4 pagesTD1 AtomistiquerochdibaatiPas encore d'évaluation
- Cours BiophysiqueDocument55 pagesCours BiophysiqueLionel DahePas encore d'évaluation
- Solvants en Chimie OrganiqueDocument3 pagesSolvants en Chimie OrganiqueMvone100% (2)
- Première Année Médecine Dentaire Module de Physique Chapitre 5 Optique Géométrique Résumé Prof Karim MANSOURDocument13 pagesPremière Année Médecine Dentaire Module de Physique Chapitre 5 Optique Géométrique Résumé Prof Karim MANSOURwiamePas encore d'évaluation
- Les Acides & Amines CoursDocument5 pagesLes Acides & Amines Courslebete100% (1)
- Cours 2 Equilibre Hydrosode-1Document24 pagesCours 2 Equilibre Hydrosode-1Abdoul karim SamakePas encore d'évaluation
- Rabat Ratt 2017 PDFDocument4 pagesRabat Ratt 2017 PDFAya El kotbiPas encore d'évaluation
- TP Chimie Compte Rendu Preparation Dune SolutionDocument6 pagesTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- DM en Plein Coeur Enoncé-CorrigéDocument8 pagesDM en Plein Coeur Enoncé-CorrigédalyyyamaraPas encore d'évaluation
- Chap.3 ProtéineDocument46 pagesChap.3 ProtéineIngenieur AgroPas encore d'évaluation
- Exercice INTI ReponseDocument4 pagesExercice INTI Reponseyazid haidarani0% (1)
- Acido BasiqueDocument7 pagesAcido BasiquesimokatyPas encore d'évaluation
- AlimentationDocument9 pagesAlimentationEssassi AmmarPas encore d'évaluation
- Ae 18 Dosage Par Etalonnage Conductimetrie Avec CorrectionDocument6 pagesAe 18 Dosage Par Etalonnage Conductimetrie Avec Correctionsanterre100% (1)
- 9-Système Renine Angiotensine AldostéroneDocument30 pages9-Système Renine Angiotensine AldostéroneRaïssa sawadogoPas encore d'évaluation
- 2020 - Chapitre 2 - Propriétés Colligatives - Suite Et FinDocument15 pages2020 - Chapitre 2 - Propriétés Colligatives - Suite Et FinAmélie Charleene ViennotPas encore d'évaluation
- Chapitre 1 Corps Pur Et MelangesDocument30 pagesChapitre 1 Corps Pur Et MelangesLAYNA LAYNA100% (1)
- Chapitre 3 Mc3a9langesDocument27 pagesChapitre 3 Mc3a9langesabderrahim hafoudPas encore d'évaluation
- Biochimie2an-Equilibre Acidobasique2021demmakDocument15 pagesBiochimie2an-Equilibre Acidobasique2021demmakGlobule RougePas encore d'évaluation
- Les ProtidesDocument17 pagesLes Protidescoursenligne.lille1100% (1)
- Pharmacodynamie Et Interactions MédicamenteusesDocument19 pagesPharmacodynamie Et Interactions MédicamenteusesChaima FatnassiPas encore d'évaluation
- 1 Les Antiépileptiques 2017Document56 pages1 Les Antiépileptiques 2017Na FesPas encore d'évaluation
- Polycopié de Biophysique-28!03!2020Document77 pagesPolycopié de Biophysique-28!03!2020Oumia HarbitPas encore d'évaluation
- BB 2018 Spé Physique-1Document10 pagesBB 2018 Spé Physique-1De la fuente100% (1)
- Digramme de Davenport 2020-2021Document84 pagesDigramme de Davenport 2020-2021DFGSPas encore d'évaluation
- NomenclatureDocument10 pagesNomenclatureKallel JihenePas encore d'évaluation
- CréatineDocument3 pagesCréatineIngenieur AgroPas encore d'évaluation
- Cours ProtéineDocument111 pagesCours ProtéinesaliPas encore d'évaluation
- Hydrostatique (Énoncé Exercice)Document1 pageHydrostatique (Énoncé Exercice)Iyed GawaPas encore d'évaluation
- TD N°1-Corrigé Ex 9 À 21Document5 pagesTD N°1-Corrigé Ex 9 À 21lucas lucasPas encore d'évaluation
- Cours Chimie Organique 2 (S4) TC BCG-convertiDocument126 pagesCours Chimie Organique 2 (S4) TC BCG-convertiRim ElmoutaoukkilPas encore d'évaluation
- Equilibre Acido Basique 1erDocument38 pagesEquilibre Acido Basique 1erSafaa MedPas encore d'évaluation
- Physiologie Cardiovasculaire (I)Document46 pagesPhysiologie Cardiovasculaire (I)Sami MaghrebiPas encore d'évaluation
- Thermodynamique 2nd Cycle Parcours Innovation Sujet Juin 2020Document2 pagesThermodynamique 2nd Cycle Parcours Innovation Sujet Juin 2020Willi BallaPas encore d'évaluation
- Série N°1-CorrigéeDocument9 pagesSérie N°1-CorrigéeZineb DahmaniPas encore d'évaluation
- Dosage ProtolymetriqufatDocument8 pagesDosage ProtolymetriqufatSellam AnisPas encore d'évaluation
- Chimie ch8Document10 pagesChimie ch8nadpharm13Pas encore d'évaluation
- Alimentation Selon WikipédiaDocument4 pagesAlimentation Selon WikipédiaNom100% (1)
- TD Biophysique 2013Document18 pagesTD Biophysique 2013sarraPas encore d'évaluation
- Biophysique II GroujDocument42 pagesBiophysique II GroujAdonis Serghini100% (1)
- PCEM1 Physio Renale Objectifs Plan Dec Ours RudimentsDocument8 pagesPCEM1 Physio Renale Objectifs Plan Dec Ours RudimentsGhassen SouissiPas encore d'évaluation
- Cours de BIOCHIMIE 2021Document21 pagesCours de BIOCHIMIE 2021Konan fulgence KouassiPas encore d'évaluation
- TP DissolutionDocument8 pagesTP DissolutionNadia amelPas encore d'évaluation
- Alcool Tres ImportantDocument19 pagesAlcool Tres ImportantOumar TraoréPas encore d'évaluation
- La Guerre D'algérieDocument46 pagesLa Guerre D'algérieILKA DESPAGNEPas encore d'évaluation
- Cours Lipides - Part 1Document74 pagesCours Lipides - Part 1AhmedPas encore d'évaluation
- Epreuve de Biochimie Session de Mai 2000: Universite Cadi Ayyad Faculte de Medecine Et de Pharmacie MarrakechDocument3 pagesEpreuve de Biochimie Session de Mai 2000: Universite Cadi Ayyad Faculte de Medecine Et de Pharmacie MarrakechBrahim ChahbanePas encore d'évaluation
- Coeur Et Circulation SanguineDocument4 pagesCoeur Et Circulation Sanguinewaly sowPas encore d'évaluation
- 3.définition Et Mesure Du PH PDFDocument3 pages3.définition Et Mesure Du PH PDFkimmikPas encore d'évaluation
- Gastro EntérologieDocument141 pagesGastro EntérologieDương Tấn PhongPas encore d'évaluation
- Dosage Direct Du Calcium Ionise PlasmatiqueDocument7 pagesDosage Direct Du Calcium Ionise PlasmatiqueDaoud IssaPas encore d'évaluation
- Corrigé Contro Continu Chimie 4 2019Document2 pagesCorrigé Contro Continu Chimie 4 2019evilievPas encore d'évaluation
- Ue6 - Fiche Cours 3 PD PK - GarraffoDocument11 pagesUe6 - Fiche Cours 3 PD PK - GarraffoLinaPas encore d'évaluation
- Des souris et des hommes de John Steinbeck (Fiche de lecture): Analyse complète de l'oeuvreD'EverandDes souris et des hommes de John Steinbeck (Fiche de lecture): Analyse complète de l'oeuvrePas encore d'évaluation
- Nettoyer Betons AnciensDocument5 pagesNettoyer Betons AnciensManon BrPas encore d'évaluation
- Série TD 2 ChimieDocument3 pagesSérie TD 2 ChimieDalila LilaPas encore d'évaluation
- Devoir Synthèse-1 - 4 ScExp-2022Document6 pagesDevoir Synthèse-1 - 4 ScExp-2022Riadh BesbesPas encore d'évaluation
- Cours - Exercices de Chromatographie c1Document3 pagesCours - Exercices de Chromatographie c1Farid HammouPas encore d'évaluation
- BLPC 218 49-58Document12 pagesBLPC 218 49-58Kenza RhimiPas encore d'évaluation
- Chapitre II - Solutions AqueusesDocument1 pageChapitre II - Solutions Aqueusesfkcxt78m9xPas encore d'évaluation
- Chim311-2021-Mécanismes RéactionelsDocument51 pagesChim311-2021-Mécanismes RéactionelsKornichonPas encore d'évaluation
- Ch04 96 Livre Du ProfDocument16 pagesCh04 96 Livre Du ProfAubin SchneiderPas encore d'évaluation
- Expose Sur Les Halogène: Réalisé Par: - Douhi Mohamed Riad - Gaid MeriemDocument14 pagesExpose Sur Les Halogène: Réalisé Par: - Douhi Mohamed Riad - Gaid MeriemriadPas encore d'évaluation
- 201701271158125 (3)Document9 pages201701271158125 (3)Ali RammalPas encore d'évaluation
- Fiche de TD Biohp (Iffusion)Document2 pagesFiche de TD Biohp (Iffusion)Saoussen Benmohamed0% (1)
- TD3 Chimie en Solution FSBMDocument2 pagesTD3 Chimie en Solution FSBMDil HaPas encore d'évaluation
- Potentiometre Brochure FRDocument18 pagesPotentiometre Brochure FREl Mehdi GhalabPas encore d'évaluation
- Mode Op DilutionDocument1 pageMode Op DilutionValère Richu Fokou Tchemebe100% (1)
- Série. Les Lois de La Réaction ChimiqueDocument2 pagesSérie. Les Lois de La Réaction ChimiqueAyoub EchahelPas encore d'évaluation
- En 12350-4Document9 pagesEn 12350-4NDATAPas encore d'évaluation
- SUJET ET CORRIGE PCTDocument8 pagesSUJET ET CORRIGE PCTSabirou BAPARAPEPas encore d'évaluation
- Support Cours Liaison Chimique S1 PR JENNAN 2023-2024Document37 pagesSupport Cours Liaison Chimique S1 PR JENNAN 2023-2024idmarwaa2Pas encore d'évaluation
- Ft-Prokils330 AfDocument1 pageFt-Prokils330 AfPablo SizarPas encore d'évaluation
- TP Chimie OrganiqueDocument8 pagesTP Chimie OrganiqueSamar Zedam100% (1)
- Produits Fabrication EcransDocument4 pagesProduits Fabrication EcransErnest KekeyiPas encore d'évaluation
- Atomes Et Ions - 3 AC PDFDocument3 pagesAtomes Et Ions - 3 AC PDFaznag hicham100% (1)
- Série Hydrocarbures AliphatiquesDocument3 pagesSérie Hydrocarbures Aliphatiqueszeineb fadhelPas encore d'évaluation
- Proprietes ColligativesDocument46 pagesProprietes ColligativesSERIGNE MAYORO THIAMPas encore d'évaluation
- Chapitre III Etude Des MétauxDocument11 pagesChapitre III Etude Des Métauxmadomano1971Pas encore d'évaluation
- Corrigé Exos V Et VI Série 1Document10 pagesCorrigé Exos V Et VI Série 1Soufiane Rouchad100% (1)
- Cours Chimie Organique 2 C245 BCG S4Document93 pagesCours Chimie Organique 2 C245 BCG S4elhafyanifatima20Pas encore d'évaluation
- 2 - Statiques Des Fluides TPE FEv 2024Document114 pages2 - Statiques Des Fluides TPE FEv 2024manidjuisorellePas encore d'évaluation
- Traitement Par Ionisation - 2 Techniques Pour Un Résultat 100% FiableDocument5 pagesTraitement Par Ionisation - 2 Techniques Pour Un Résultat 100% Fiableamine2263Pas encore d'évaluation
- Preparation Et Caracterisation Des Catalyseurs Rh/Al2O3 Et Rh/Znoeal2O3Document16 pagesPreparation Et Caracterisation Des Catalyseurs Rh/Al2O3 Et Rh/Znoeal2O3Belinda DancheuPas encore d'évaluation