Académique Documents
Professionnel Documents
Culture Documents
Réaction Entre Les Ions Peroxodisulfate Et Iodure-Correction
Transféré par
Meryam MessaoudiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Réaction Entre Les Ions Peroxodisulfate Et Iodure-Correction
Transféré par
Meryam MessaoudiDroits d'auteur :
Formats disponibles
REACTION ENTRE LES IONS PEROXODISULFATE ET LES IONS IODURE-
CORRECTION
1) Concentration initiale des ions peroxodisulfate dans le mélange réactionnel.
S O
2 8
2
i
C1V1
20 x10 3 x1
V1 V2 120 x10 3
1,66 x10 1 mol.L1
2) La réaction fournit du diiode(I2) et des ions sulfate (SO42-). Ecrire l’équation qui se déroule entre les deux
réactifs.
½ réaction de réduction (gain d’électrons)
S2O82- +2e- = 2SO42-
½ réaction d’oxydation (perte d’électrons)
2I- = I2 + 2e-
équation d’oxydoréduction
S2O82- + 2 I- = 2 SO42- + I2
3) La réaction se termine quand il n’y a plus d’ions S2O82-
n1 – xmax = 0
C1V1 – xmax = 0
xmax = 20x10-3 mol
ou quand il n’y a plus d’ions I-
n2 – 2xmax = 0 ; xmax = n2/2 = C2V2/2 = 5x10-2 mol
5x10-2 mol > 20x10-3 mol , le réactif en excès est l’ion iodure, le mélange n’est pas stœchiométrique
4) Les valeurs des quantités de matière sont en mole
Etat du Avancement S2O82- 2 I- 2 SO42- I2
système
État initial x=0 C1V1 = 2x10-2 C2V2= 10-1 0 0
En cours x(t) 2x10-2-x(t) 10-1-2x(t) 2x(t) x(t)
Etat final x = xmax =2x10-2 0 10-1-2xmax= 6x10-2 2xmax = 4x10-2 xmax = 2x10-2
5) a) Relation entre la valeur de l’avancement au cours du temps x(t) et n(S 2O82-) t
n(S2O82-) t = 2x10-2-x(t)
x(t) = 2x10-2 - n(S2O82-) t
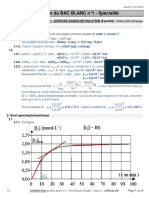
b) Tracé la courbe x(t)
t(min) 0 2.5 5 10 15 20 25 30
n(S2O82-) x10-3 20 18 16.6 14.1 12.3 10.8 9.6 8.8
mol
x(t) = 2x10-2- 0 2 3.4 6.9 7.7 9.2 10.4 11.2
n(S2O82-) t
6) Déduire de la courbe à t = 7,5 minutes la quantité de matière de diiode formée.
D’après la courbe ci dessus à t = 7,5 min :
x(7,5 min) = 4,8x10-3 mol
or d’après le tableau d’avancement x(t) = n(I2)formé,t
donc n(I2)formé, t = 7,5 min = 4,8x10-3 mol
Vous aimerez peut-être aussi
- Ly 10Document3 pagesLy 10baatout oumaymaPas encore d'évaluation
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2D'EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Pas encore d'évaluation
- CR de CCDocument4 pagesCR de CCrahmanov.dz.05Pas encore d'évaluation
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- 6-Suivi Cinétique Par Titrage-A Préparatoire Du TP Christine 2007Document3 pages6-Suivi Cinétique Par Titrage-A Préparatoire Du TP Christine 2007Daniela DinicaPas encore d'évaluation
- Solution Exercices de Suivi Temporeldune Transformation Vitesse DereactionDocument13 pagesSolution Exercices de Suivi Temporeldune Transformation Vitesse DereactionTsu BakiPas encore d'évaluation
- Chimie 4 SUIVI TEMPOREL D'UNE TRANSFORMATION CHIMIQUE PAR TITRAGEDocument1 pageChimie 4 SUIVI TEMPOREL D'UNE TRANSFORMATION CHIMIQUE PAR TITRAGELamsaaf MohamedPas encore d'évaluation
- TS - Chim 2 - TP Ch1 CorrigéDocument2 pagesTS - Chim 2 - TP Ch1 CorrigéZakaria AIT EL CAIDPas encore d'évaluation
- Série Cinétique Chimique 2bac: P T P T RDocument9 pagesSérie Cinétique Chimique 2bac: P T P T Rrkibi.khadija2006Pas encore d'évaluation
- Serie 1 E Et 2 E (Cinétique Chimique) PDFDocument9 pagesSerie 1 E Et 2 E (Cinétique Chimique) PDFbouaounPas encore d'évaluation
- A. Etude Cinétique de La Transformation Des Ions Peroxodisulfate Et Des Ions IoduresDocument5 pagesA. Etude Cinétique de La Transformation Des Ions Peroxodisulfate Et Des Ions IoduresZahra Zahra50% (2)
- TSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25Document5 pagesTSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25mohPas encore d'évaluation
- TP .Avancement .4sc - Exp.2022Document6 pagesTP .Avancement .4sc - Exp.2022Med Brini100% (1)
- 1S CHIM CH6 TP8 AVANCEMENT CorrigeDocument2 pages1S CHIM CH6 TP8 AVANCEMENT CorrigeITIE SALOMEPas encore d'évaluation
- TS Chim Chap2 PDFDocument6 pagesTS Chim Chap2 PDFDadati SouPas encore d'évaluation
- ch5 Acide Stearique Na2so4 Tab Avanct Concentration ds12pt CDocument2 pagesch5 Acide Stearique Na2so4 Tab Avanct Concentration ds12pt Crio.. avkPas encore d'évaluation
- Exercice Suivi Temporelle ChimieDocument4 pagesExercice Suivi Temporelle ChimiePhobos ElfaPas encore d'évaluation
- DS2 Correction LMA 09 11 2019 Avancement - OxydoreductionDocument4 pagesDS2 Correction LMA 09 11 2019 Avancement - Oxydoreductiondiomande Aminata Sarah FatimPas encore d'évaluation
- SerieDocument7 pagesSeriemehdi benmassoudPas encore d'évaluation
- ChimieTS TP2 CorrigéDocument3 pagesChimieTS TP2 Corrigéfoud18Pas encore d'évaluation
- Ob s1 Cinetique ChimiqueDocument2 pagesOb s1 Cinetique Chimiquemedabdellahisamba34Pas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFأبوأحمد الجزيري0% (1)
- Série D'exercices - Sciences Physiques Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFDocument2 pagesSérie D'exercices - Sciences Physiques Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFAzizElheniPas encore d'évaluation
- Chimie A Chap3 Suivi - Temporel - TransformationDocument5 pagesChimie A Chap3 Suivi - Temporel - TransformationMohammed ElhlouPas encore d'évaluation
- TP Soha - rtf2Document12 pagesTP Soha - rtf2Zakariae BennacerPas encore d'évaluation
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- 2003 Polynesie Correction Exo2 Cinetique 2 5ptsDocument2 pages2003 Polynesie Correction Exo2 Cinetique 2 5ptsdansoujosemorelePas encore d'évaluation
- Chimie TP2 Dosage CorrDocument3 pagesChimie TP2 Dosage CorrChartier JulienPas encore d'évaluation
- Chimie A Chap1 Correction ExosDocument3 pagesChimie A Chap1 Correction ExosAllaya AmeniiPas encore d'évaluation
- Série de Révision 2021 SciencesDocument38 pagesSérie de Révision 2021 SciencesWiem BenchahbounPas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- Exercices de Re Visions - PC - Ts-2Document16 pagesExercices de Re Visions - PC - Ts-2baatout oumaymaPas encore d'évaluation
- Exercices Revisions Physiques Chimie 1Document13 pagesExercices Revisions Physiques Chimie 1Loup Jouandet-DahlenPas encore d'évaluation
- Série de Révision 2021 Sciences Corrigé Ma ClasseDocument72 pagesSérie de Révision 2021 Sciences Corrigé Ma ClasseSamir LoqmanePas encore d'évaluation
- Série de Révision 2023 PDFDocument58 pagesSérie de Révision 2023 PDFnur alouiPas encore d'évaluation
- tp12 Dosage Diiode Corrige 2009-2010-2Document2 pagestp12 Dosage Diiode Corrige 2009-2010-2ibrahimaPas encore d'évaluation
- Activité Expérimentale 2: La Couleur, Indicatrice de L'avancement D'une RéactionDocument3 pagesActivité Expérimentale 2: La Couleur, Indicatrice de L'avancement D'une RéactionmmoohhaammeeddllaakkhhhaallPas encore d'évaluation
- CorrecDocument4 pagesCorrecSyryne DridiPas encore d'évaluation
- AvancementDocument2 pagesAvancementYoussef Ben AmarPas encore d'évaluation
- Oscillateurs N Deg LiberteDocument19 pagesOscillateurs N Deg LibertealphaPas encore d'évaluation
- Correction TP4 de CinétiqueDocument5 pagesCorrection TP4 de CinétiqueDjaafeurMenouar80% (5)
- Chimie (5points)Document7 pagesChimie (5points)melekPas encore d'évaluation
- Chimie (5points)Document7 pagesChimie (5points)khlifisamir19Pas encore d'évaluation
- Exercice Corrigé Suivi Temporel D'une Transformation Chimique PDFDocument2 pagesExercice Corrigé Suivi Temporel D'une Transformation Chimique PDFMohammed Elhlou75% (8)
- Travaux Pratiques Cinétique: Faculté de Chimie Département de Génie Des MatériauxDocument4 pagesTravaux Pratiques Cinétique: Faculté de Chimie Département de Génie Des MatériauxmehalasmaaPas encore d'évaluation
- C2Chim Suivi Cinetique ExercicesDocument8 pagesC2Chim Suivi Cinetique ExercicesMohamed El OuahdaniPas encore d'évaluation
- CO1 TS2 2020 IaslDocument4 pagesCO1 TS2 2020 Iasl9g6k44vffzPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- TSP2SP2Ch9T5-TP13 SpectrophotometrieDocument4 pagesTSP2SP2Ch9T5-TP13 SpectrophotometriebintbouhazPas encore d'évaluation
- 5 - Etude Quantitative DDocument1 page5 - Etude Quantitative Dkarlaboujaoude99Pas encore d'évaluation
- Evolution D-Une Reaction Chimique PDFDocument6 pagesEvolution D-Une Reaction Chimique PDFouzin23Pas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFDocument4 pagesSérie D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFAzizElheniPas encore d'évaluation
- 1ER-PC-CHAP 03 ExercicesDocument33 pages1ER-PC-CHAP 03 Exercicesarthur pasquet100% (1)
- 4é DC 2009 2010Document4 pages4é DC 2009 2010fethi1100% (2)
- TP Dosage Redox Diiode CorrectionDocument3 pagesTP Dosage Redox Diiode CorrectionSk CissePas encore d'évaluation
- 3b Interférences Suite - Mob 1Document6 pages3b Interférences Suite - Mob 1yaya dialloPas encore d'évaluation
- Chimie Cinétique Chimique 2013 2014 (Afdal Ali)Document6 pagesChimie Cinétique Chimique 2013 2014 (Afdal Ali)Hassan Rifki100% (1)
- La Boîte A MerveillesDocument13 pagesLa Boîte A MerveillesMeryam Messaoudi100% (1)
- 4 5805303270171739549Document168 pages4 5805303270171739549Tewodros2014Pas encore d'évaluation
- Les Questions Que Se Posent Les PhysiciensDocument3 pagesLes Questions Que Se Posent Les PhysiciensMeryam MessaoudiPas encore d'évaluation
- 4 5805303270171739549Document168 pages4 5805303270171739549Tewodros2014Pas encore d'évaluation
- Exercices 8 Suivi TemporelDocument1 pageExercices 8 Suivi TemporelMeryam MessaoudiPas encore d'évaluation
- Partie1 CorriDocument31 pagesPartie1 CorriMeryam MessaoudiPas encore d'évaluation
- 1bac Biof SM Exo Travail Et Puissance (2) Youtube 22-11-20Document1 page1bac Biof SM Exo Travail Et Puissance (2) Youtube 22-11-20Meryam MessaoudiPas encore d'évaluation
- 1bac Biof SM Exo Travail Et Puissance (1) Youtube 22-11-20Document1 page1bac Biof SM Exo Travail Et Puissance (1) Youtube 22-11-20Meryam MessaoudiPas encore d'évaluation
- Travail Et Puissance Travail Et Puissance Dune Force Dune Force - CompressDocument6 pagesTravail Et Puissance Travail Et Puissance Dune Force Dune Force - CompressMeryam MessaoudiPas encore d'évaluation
- 1bac Biof Exercice Rotation CJDocument4 pages1bac Biof Exercice Rotation CJMeryam Messaoudi100% (1)
- 1s p06 Travail Force Exos CDocument5 pages1s p06 Travail Force Exos CMeryam MessaoudiPas encore d'évaluation
- Grandeurs Physiques Liees A La Quantite de Matiere Exercices Non Corriges 2 1Document4 pagesGrandeurs Physiques Liees A La Quantite de Matiere Exercices Non Corriges 2 1Meryam MessaoudiPas encore d'évaluation
- 28010476cadre de Reference CollegeDocument9 pages28010476cadre de Reference CollegeMeryam MessaoudiPas encore d'évaluation
- Série018 Logie 1smDocument1 pageSérie018 Logie 1smMeryam MessaoudiPas encore d'évaluation
- Serie-2 BAC 2Document5 pagesSerie-2 BAC 2Meryam MessaoudiPas encore d'évaluation
- Quant Matie Rex oDocument3 pagesQuant Matie Rex oAbdelouahed OuarrarPas encore d'évaluation
- Reglement Simplifie de HBDocument2 pagesReglement Simplifie de HBlegobayouPas encore d'évaluation
- Reglement Simplifie de HBDocument2 pagesReglement Simplifie de HBlegobayouPas encore d'évaluation
- Exercice 1Document2 pagesExercice 1Abdelouahab ABDELAOUIPas encore d'évaluation