Académique Documents
Professionnel Documents
Culture Documents
2003 Polynesie Correction Exo2 Cinetique 2 5pts
Transféré par
dansoujosemoreleTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2003 Polynesie Correction Exo2 Cinetique 2 5pts
Transféré par
dansoujosemoreleDroits d'auteur :
Formats disponibles
Polynésie EXERCICE II.
ÉTUDE CINÉTIQUE PAR SUIVI SPECTROPHOTOMÉTRIQUE
06/2003 Correction http://labolycee.org ©
1. Étude théorique de la réaction
1.1. Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
1.2. Couple H2O2(aq)/H2O(l) réduction de l'eau oxygénée H2O2(aq) + 2H+(aq) + 2e– = 2 H2O(l)
Couple I2(aq) / I–(aq) oxydation des ions iodure 2 I–(aq) = I2(aq) + 2e–
2. Suivi de la réaction
2.1. n1 = n(I–)i = C1×V1 = 0,10×20,0.10-3 = 2,0 mmol
n2 = n(H2O2)i = C2×V2 = 0,10×2,0.10-3 = 0,20 mmol
n
(I −)i
D'après l’équation de la réaction, les réactifs sont en proportions stœchiométriques si = n(H , or
2 2O2)i
n
(I −)i
ici n(H )i = , les réactifs ne sont pas dans les conditions stœchiométriques
2O2 10
2.2.
Équation H2O2(aq) + 2 I–(aq) + 2 H3O+(aq) = I2(aq) + 4 H2O(l)
État initial n2 n1 Excès 0 beaucoup
État
n2 – x n1 – 2x Excès x beaucoup
intermédiaire
État final n2 – xf n1 – 2xf Excès xf beaucoup
n2 – x(300) = n1 – 2x(300) =
t = 300 s 0,20 – 0,09 = 2,0 – 2×0,09 = Excès x(300) = 0,09 beaucoup
(en mmol) 0,11 1,8
x
2.3. [I2(aq)] = avec VT = 20,0 + 8,0 + 2,0 = 30 mL
VT
n1
2.4. Si le diiode est le réactif limitant alors n1 – 2xmax = 0, soit xmax = = 1,0 mmol
2
Si l'eau oxygénée est le réactif limitant alors n2 – xmax = 0, soit xmax =n2 = 0,20 mmol
Le réactif limitant est l'eau oxygénée car elle conduit à la valeur de xmax la plus faible.
xmax 0,20
[I2(aq)]th = = = 6,7.10 –3 mol.L-1 = 6,7 mmol.L–1 lorsque la transformation est terminée.
VT 30
3. Exploitation des résultats
d
t1/2
300
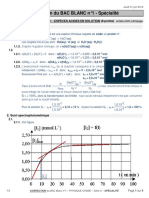
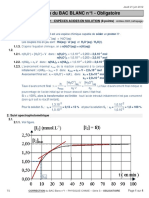
3.1. Méthode: On utilise l'échelle horizontale du document: 2500 s représentées par L =14,8 cm
300 s représentées par d cm
14,8 × 300
d= = 1,8 cm. On trace un segment de d = 1,8 cm pour repérer t = 300 s.
2500
On utilise la courbe pour trouver x(300s).
On utilise l'échelle verticale: 2,5×10–4 mol représentée par H =11,3 cm
x(300) mol représentée par h = 4,2 cm
−4
2,5 × 10 × 4,2
soit x(300) = = 0,93×10–4 mol = 0,093 mmol. Vu le manque de précision, on décide de
11,3
ne conserver qu'un seul chiffre significatif soit x(300) = 0,09 mmol
Pour la composition voir tableau 2.2.
1 dx dx
3.2. v = où représente le coefficient directeur de la tangente à la courbe x = f(t) à la date t, on
V dt dt
voit sur la courbe que cette valeur diminue au cours du temps. La vitesse volumique de réaction diminue
au cours du temps. Le facteur cinétique responsable de cette diminution est la concentration des réactifs
(qui diminue au cours du temps).
3.3. Le temps de demi-réaction est la durée pour laquelle l’avancement vaut xf / 2 .
2,0 × 10−4
Sur le graphique, on lit t1/2 pour x = .
2
Voir courbe: t1/2 = 3.102 s (1 seul chiffre significatif, lecture peu précise)
Vous aimerez peut-être aussi
- 2 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument31 pages2 - Suivi Temporel D'une Transformation - Vitesse de Réactionlahcen essPas encore d'évaluation
- Équations différentielles: Les Grands Articles d'UniversalisD'EverandÉquations différentielles: Les Grands Articles d'UniversalisPas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- TP4 La Reaction Persulfate IodureDocument4 pagesTP4 La Reaction Persulfate IodureSellam Anis100% (1)
- 1 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument12 pages1 - Suivi Temporel D'une Transformation - Vitesse de RéactionTaha BoulmanePas encore d'évaluation
- 0607 C Exo S VitesseDocument3 pages0607 C Exo S VitesseSeverin LouaPas encore d'évaluation
- Entrainement Physique-Chimie Ts PDFDocument2 pagesEntrainement Physique-Chimie Ts PDFEl Hadje CoulibalyPas encore d'évaluation
- Le Millenium Bridge - Mines-Ponts MP I 2016 - CorrigéDocument5 pagesLe Millenium Bridge - Mines-Ponts MP I 2016 - CorrigéAymen LaaroussiPas encore d'évaluation
- Correction TP4 de CinétiqueDocument5 pagesCorrection TP4 de CinétiqueDjaafeurMenouar80% (5)
- Corriges Chimie 05Document3 pagesCorriges Chimie 05Ĥä MžãPas encore d'évaluation
- Chimie A Chap3 Suivi - Temporel - TransformationDocument5 pagesChimie A Chap3 Suivi - Temporel - TransformationMohammed ElhlouPas encore d'évaluation
- Correc Devoir Ts 1Document4 pagesCorrec Devoir Ts 1phytanjaPas encore d'évaluation
- 2010 Polynesie Exo2 Sujet OscillationsPC 6ptsDocument5 pages2010 Polynesie Exo2 Sujet OscillationsPC 6ptsla physique selon le programme FrançaisPas encore d'évaluation
- Agreg 2010 - LaplacienDocument6 pagesAgreg 2010 - Laplacienbilly debasePas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - ObligatoireDocument4 pagesTS - BAC Blanc N°1 Corrigé - ObligatoirephytanjaPas encore d'évaluation
- Exercice Corrigé Suivi Temporel D'une Transformation Chimique PDFDocument2 pagesExercice Corrigé Suivi Temporel D'une Transformation Chimique PDFMohammed Elhlou75% (8)
- TD1 - Rappels MathDocument2 pagesTD1 - Rappels Mathpierre14000Pas encore d'évaluation
- DS2 Oct08Document6 pagesDS2 Oct08la physique selon le programme FrançaisPas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2Document5 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2MOSTAFA HABIRKOUPas encore d'évaluation
- 2011 Antilles Exo1 Correction Luminol 6 5pointsDocument3 pages2011 Antilles Exo1 Correction Luminol 6 5pointsmohamedPas encore d'évaluation
- Ds Math FourrierDocument1 pageDs Math FourrierSabri MahmoudPas encore d'évaluation
- Série D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI Ezedinejuini rawiaPas encore d'évaluation
- Methode de RayleighDocument4 pagesMethode de RayleighFatima FatimaPas encore d'évaluation
- TD Phys Ato MolDocument9 pagesTD Phys Ato MolTrandafir LacramioaraPas encore d'évaluation
- TS - Chim 2 - TP Ch1 CorrigéDocument2 pagesTS - Chim 2 - TP Ch1 CorrigéZakaria AIT EL CAIDPas encore d'évaluation
- 4 5949436273771940485Document2 pages4 5949436273771940485olivieralexandre954Pas encore d'évaluation
- TSP2SP2Ch9T5-TP13 SpectrophotometrieDocument4 pagesTSP2SP2Ch9T5-TP13 SpectrophotometriebintbouhazPas encore d'évaluation
- Site TS C 02 Suivi Temporelle D'une Transfo ChimDocument8 pagesSite TS C 02 Suivi Temporelle D'une Transfo ChimPecorellaPas encore d'évaluation
- TD2 Correction PDFDocument8 pagesTD2 Correction PDFKhadija LakhdiriPas encore d'évaluation
- IE Sujet2010 08L MODocument3 pagesIE Sujet2010 08L MObulenstimothePas encore d'évaluation
- Corrigés Séries de TD Termodynamique Des Équilibres L3 2023Document45 pagesCorrigés Séries de TD Termodynamique Des Équilibres L3 2023chakiircherfPas encore d'évaluation
- Equation Edp TDDocument3 pagesEquation Edp TDsoufiennePas encore d'évaluation
- Chimie A Chap1 Correction ExosDocument3 pagesChimie A Chap1 Correction ExosAllaya AmeniiPas encore d'évaluation
- Ly 10Document3 pagesLy 10baatout oumaymaPas encore d'évaluation
- TS - DM2 Corrigé - Phys 2-Chim 3Document3 pagesTS - DM2 Corrigé - Phys 2-Chim 3phytanjaPas encore d'évaluation
- 2007 Afrique Exo3 Correction CinetiqueDocument2 pages2007 Afrique Exo3 Correction Cinetiquepopi22377Pas encore d'évaluation
- 2010 Reunion Exo3 Correction CinetiqueGaz 4ptsDocument2 pages2010 Reunion Exo3 Correction CinetiqueGaz 4ptsmohamedPas encore d'évaluation
- TP Cinetique Spectro 2020 MaisonDocument3 pagesTP Cinetique Spectro 2020 MaisonkadraouichaymaePas encore d'évaluation
- LU2MA236-Examen+Corr-2022-2023 (4)Document6 pagesLU2MA236-Examen+Corr-2022-2023 (4)Ibrahim CoulibalyPas encore d'évaluation
- Correction DC1 19 20Document3 pagesCorrection DC1 19 20amir bougachaPas encore d'évaluation
- 1 Ere S Eval Decembre 2014Document4 pages1 Ere S Eval Decembre 2014Hadri MohamedPas encore d'évaluation
- CorrecDocument4 pagesCorrecSyryne DridiPas encore d'évaluation
- TD3 de Méthodes & Calcul Numérique "SMP S6"Document1 pageTD3 de Méthodes & Calcul Numérique "SMP S6"Mouääd100% (1)
- 2009 Afrique Exo1 Correction Pomme 6 5ptsDocument2 pages2009 Afrique Exo1 Correction Pomme 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFأبوأحمد الجزيري0% (1)
- 277 - Corrige Bac Blanc 2010Document7 pages277 - Corrige Bac Blanc 2010fouad2009Pas encore d'évaluation
- Cours X SpinDocument77 pagesCours X Spinabdellaoui0% (1)
- معادلات تفاضلية جزئية خطية من الدرجة الثانيةDocument7 pagesمعادلات تفاضلية جزئية خطية من الدرجة الثانيةarze tristePas encore d'évaluation
- Cinétique Chimique TD Corrigé 05Document8 pagesCinétique Chimique TD Corrigé 05elie mij kisalePas encore d'évaluation
- Examen MMC Jan 2011 Sujet Et CorrectionDocument3 pagesExamen MMC Jan 2011 Sujet Et CorrectionHoussem HassanetPas encore d'évaluation
- Cours SMP4Document65 pagesCours SMP4HATIM OMARIPas encore d'évaluation
- Eml2012 2Document3 pagesEml2012 2Clémentine BRUGUEROLLEPas encore d'évaluation
- Turb M2 Exam0809Document4 pagesTurb M2 Exam0809issaPas encore d'évaluation
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- Notes TmmsDocument32 pagesNotes TmmsMai MinhPas encore d'évaluation
- Bac S 2009 Physique Obligatoire Chimie CorrectionDocument4 pagesBac S 2009 Physique Obligatoire Chimie CorrectionLetudiant.fr93% (40)
- CNC MP 2005 Physique 2 CorrigeDocument4 pagesCNC MP 2005 Physique 2 Corrigesaid ramziPas encore d'évaluation
- exo_hiver2006_07Document84 pagesexo_hiver2006_07Lilia BennaceurPas encore d'évaluation
- TD2Document1 pageTD2dansoujosemorelePas encore d'évaluation
- TD1 2023Document2 pagesTD1 2023dansoujosemorelePas encore d'évaluation
- VHNP17 18Document568 pagesVHNP17 18valePas encore d'évaluation
- 2008 Reunion Exo3 Correction Alcoolemie 4ptsDocument1 page2008 Reunion Exo3 Correction Alcoolemie 4ptsdansoujosemorelePas encore d'évaluation
- Mecanique Du Point - 2eme EditionDocument338 pagesMecanique Du Point - 2eme EditionMouad Riyad100% (4)
- Le Processus StratégiqueDocument2 pagesLe Processus StratégiqueNajwa AmellalPas encore d'évaluation
- Ex5 Modalisation Exercice Attitude PropoDocument5 pagesEx5 Modalisation Exercice Attitude Proposan draPas encore d'évaluation
- Gamme Operatoire G.O.5. Demonter Une Pompe Volumetrique: Banc de Maintenance de Pompe - MBP 102Document6 pagesGamme Operatoire G.O.5. Demonter Une Pompe Volumetrique: Banc de Maintenance de Pompe - MBP 102fedelogement allierPas encore d'évaluation
- Examen EDO 2016-2017Document2 pagesExamen EDO 2016-2017interactif tchatcheuPas encore d'évaluation
- Concours National Deug Epreuve de Francais 2004Document4 pagesConcours National Deug Epreuve de Francais 2004Majed JallouliPas encore d'évaluation
- Stop en Cas de Danger / Sécuriser / Reprendre Le Travail: ConstructionDocument1 pageStop en Cas de Danger / Sécuriser / Reprendre Le Travail: ConstructionLanciné Djene KouroumaPas encore d'évaluation
- Đề cương - L'OCÉAN INDIENDocument6 pagesĐề cương - L'OCÉAN INDIENK60 Tạ Hà LinhPas encore d'évaluation
- TP 2 Les PointeursDocument2 pagesTP 2 Les PointeursYoussefxoPas encore d'évaluation
- Béton FibréDocument9 pagesBéton FibréYoucef BenmoussaPas encore d'évaluation
- S1 ML0524 B - T6CSH Single Vane PumpDocument8 pagesS1 ML0524 B - T6CSH Single Vane PumpBernardo Orozco LariosPas encore d'évaluation
- Juhel J 2013 Niveaux D Observation Et APDocument90 pagesJuhel J 2013 Niveaux D Observation Et APMauro Rocha MontfortPas encore d'évaluation
- Projet Fin D'etudeDocument34 pagesProjet Fin D'etudehjjh100% (1)
- IFRS 15 Produits Des Activites Ordinaires Tires de Contrats Conclus Avec Des ClientsDocument5 pagesIFRS 15 Produits Des Activites Ordinaires Tires de Contrats Conclus Avec Des ClientsAchraf YenguiPas encore d'évaluation
- Le Centre D'Enfouissement Technique Réalisation Et Fonctionnement PDF Décharge (Déchet) DéchetsDocument1 pageLe Centre D'Enfouissement Technique Réalisation Et Fonctionnement PDF Décharge (Déchet) DéchetsAlle GuigPas encore d'évaluation
- Devoir de Contrôle N°1Document5 pagesDevoir de Contrôle N°1Karem SAADPas encore d'évaluation
- Structure Globe Terrestre ExercicesDocument2 pagesStructure Globe Terrestre ExerciceskyllianPas encore d'évaluation
- L'impact de La Communication Interne Sur La Performance Des Salariés Cas Pratique Danone Djurdjura Akbou (Bejaia)Document130 pagesL'impact de La Communication Interne Sur La Performance Des Salariés Cas Pratique Danone Djurdjura Akbou (Bejaia)saliha ameziane100% (1)
- 125 Bouddine BenfaidaDocument38 pages125 Bouddine BenfaidaOthmane BenfaidaPas encore d'évaluation
- Bevel To Degree Conversion ChartDocument1 pageBevel To Degree Conversion ChartScott NorrisPas encore d'évaluation
- 17 EquaDiffScalaires1 CompletDocument4 pages17 EquaDiffScalaires1 CompletTtabi VeydiPas encore d'évaluation
- Inventaire de Nos Fautes Les Plus Usuelles - Sylva ClapinDocument194 pagesInventaire de Nos Fautes Les Plus Usuelles - Sylva Clapinpetros dionPas encore d'évaluation
- Variateur de Fréquence - HTML PDFDocument17 pagesVariateur de Fréquence - HTML PDFAnonymous oyUAtpK0% (1)
- Bases Fondamentales de La Préparation Des Minerais 2011Document124 pagesBases Fondamentales de La Préparation Des Minerais 2011Vicbeau350% (2)
- Une Combinaison Du E-Learning Et de L'enseignement TraditionnelDocument2 pagesUne Combinaison Du E-Learning Et de L'enseignement TraditionnelAshraf MedPas encore d'évaluation
- Séquence Passerelle de 2AMDocument2 pagesSéquence Passerelle de 2AMbelabed100% (1)
- CdA ZeroDocument40 pagesCdA ZeroangedesjolisbasPas encore d'évaluation
- L'entretienDocument24 pagesL'entretienhanae elharounPas encore d'évaluation
- Histoire Et Climat PDFDocument34 pagesHistoire Et Climat PDFSoumia Deriet AmarPas encore d'évaluation
- Compte Rendu Chimie: 1: Vaporisation de L'eau DistilléeDocument9 pagesCompte Rendu Chimie: 1: Vaporisation de L'eau DistilléeWalid Ouabas100% (3)
- Nos Radiateurs Éléctriques - Nos Radiateurs Éléctriques CarreraDocument1 pageNos Radiateurs Éléctriques - Nos Radiateurs Éléctriques CarreraChristophe DUMAZET MARTINPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Direction, Alignment, Commitment: Achieving Better Results Through Leadership, First Edition (French)D'EverandDirection, Alignment, Commitment: Achieving Better Results Through Leadership, First Edition (French)Pas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)