Académique Documents
Professionnel Documents
Culture Documents
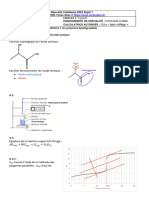
Correction Exercice 2 Optimisation de La Synthese de Lethanoate de Benzyle 5 Points
Transféré par
josiastite22Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Correction Exercice 2 Optimisation de La Synthese de Lethanoate de Benzyle 5 Points
Transféré par
josiastite22Droits d'auteur :
Formats disponibles
Amérique du Nord 2022 Sujet 1
CORRECTION Yohan Atlan © https://www.vecteurbac.fr/
CLASSE : Terminale EXERCICE A : au choix du candidat (5 points)
VOIE : ☒ Générale ENSEIGNEMENT : physique-chimie
DURÉE DE L’ÉPREUVE : 0h53 CALCULATRICE AUTORISÉE : ☒Oui sans mémoire, « type collège »
EXERCICE 2 Optimisation de la synthèse de l'éthanoate de benzyle (5 points)
A. Formation de l’ester
Q.1.
Formule brute de l’alcool benzylique : C7H8O
Q.2.
Q.3.
Formule brute de la molécule A : C8H12O
Formule brute de la molécule B : C7H8O
Formule brute de l’alcool benzylique : C7H8O
La molécule B et l’alcool benzylique ont la même formule brute et une formule développée différente :
la molécule B et l’alcool benzylique sont isomères.
CORRECTION Yohan Atlan © www.vecteurbac.fr
Q.4.
Deux conditions expérimentales qui peuvent rendre une transformation plus rapide :
Ø Augmenter la température
Ø Ajouter un catalyseur.
B. Optimisation du rendement de la synthèse
Q.5.
m
n=
M
Or
m
ρ=
V
m=ρ×V
ρ×V
n=
M
ρ" × V"
n!" =
M"
1,05 × 2,7
n!" =
60,0
n!" = 4,7 × 10#$ mol
ρ$ × V$
n!$ =
M$
1,04 × 4,9
n!$ =
108,0
n!$ = 4,7 × 10#$ mol
Q.6.
L’équation de la réaction modélisant la synthèse de l’éthanoate de benzyle est la suivante :
Les coefficients stœchiométriques valent 1 : pour une molécule d’acide éthanoïque consommée, une
molécule d’éthanoate de benzyle est produite.
Ainsi
n%&!'( &*+,. = n(,.(/
Q.7.
L’équation de la réaction support du titrage est : CH3COOH(aq) + HO-(aq) → CH3COO-(aq) + H2O(ℓ).
A l’équivalence :
(2
n%&!'( /(,.. n01!
=
1 1
CORRECTION Yohan Atlan © www.vecteurbac.fr
(2
n%&!'( /(,.. = n01!
n%&!'( /(,.. = C3 × V(2
n%&!'( /(,.. = 2,0 × 8,5 × 10#4
n%&!'( /(,.. = 2,0 × 8,5 × 10#4
n%&!'( /(,.. = 1,7 × 10#$ mol
Q.8.
Rendement r de la synthèse :
n(,.(/ (56
r=
n(,.(/ .7é*/!29(
Or
n(,.(/ .7é*/!29( = n!"
n(,.(/ (56 = n!" − n%&!'( /(,..
n!" − n%&!'( /(,..
r=
n!"
4,7 × 10#$ − 1,7 × 10#$
r=
4,7 × 10#$
r = 0,64 = 64%
Le rendement n’est pas de 100% : la réaction est limitée.
Q.9.
Si on modifie la quantité de matière de l’une des espèces chimiques présentes dans un système
chimique en équilibre, l’évolution de ce système s’oppose à cette modification :
En augmentant le volume et donc la quantité de matière d’un réactif, le quotient de réaction diminue et
ainsi Q / < 𝐾 , le système chimique évolue spontanément dans le sens « direct ».
Lorsqu’une espèce chimique est apportée, l’évolution du système se fait dans le sens de sa
consommation.
CORRECTION Yohan Atlan © www.vecteurbac.fr
Vous aimerez peut-être aussi
- Le Marketing Digital Pour Les NulsDocument453 pagesLe Marketing Digital Pour Les NulsAMINEPas encore d'évaluation
- Les Points Clé Pour Bien Écrire.Document60 pagesLes Points Clé Pour Bien Écrire.HanKethyaneth100% (1)
- Fascicule Ts Chimie 2020Document25 pagesFascicule Ts Chimie 2020Camara laye100% (2)
- ExercicesDocument24 pagesExercicesYoussouf MaâzouPas encore d'évaluation
- Exercices Is LM BPDocument6 pagesExercices Is LM BPDachka Ridore100% (1)
- Fonction Convertir Machines Synchrones Triphases CoursDocument5 pagesFonction Convertir Machines Synchrones Triphases CoursdddddPas encore d'évaluation
- Les Produits D EntretienDocument3 pagesLes Produits D EntretienSandrine CharinPas encore d'évaluation
- Pont Mixte FINALDocument26 pagesPont Mixte FINALĐíßMohammedRiadPas encore d'évaluation
- Examen Blanc 5 - FinalDocument8 pagesExamen Blanc 5 - FinalBouchra100% (1)
- Bac Blanc 2 SM (21-22)Document9 pagesBac Blanc 2 SM (21-22)Salma BendaoudPas encore d'évaluation
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- 10-11 Ester +evolutionDocument11 pages10-11 Ester +evolutionEnidroun OutPas encore d'évaluation
- Exercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFDocument5 pagesExercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFBouba KhedherPas encore d'évaluation
- Examen National 2016 Session Normal-SVTDocument6 pagesExamen National 2016 Session Normal-SVTMohamed El OuahdaniPas encore d'évaluation
- Exams Physique Chimie - SVT - 2016 2019 BIOFDocument45 pagesExams Physique Chimie - SVT - 2016 2019 BIOFSaid MottaqiPas encore d'évaluation
- Exercices PC 2bac Science International FR 22 4Document4 pagesExercices PC 2bac Science International FR 22 4Sara MountaPas encore d'évaluation
- Série D'exercices N°7-2BAC PC-CHIMIEDocument2 pagesSérie D'exercices N°7-2BAC PC-CHIMIEAymanePas encore d'évaluation
- Ece 23 PC 3Document4 pagesEce 23 PC 3souidiPas encore d'évaluation
- 2010 Antilles Exo1 Correction Ylang Ylang 6 5ptsDocument2 pages2010 Antilles Exo1 Correction Ylang Ylang 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- EsterficationsDocument9 pagesEsterficationssaid khachouPas encore d'évaluation
- Envoi Mail Exercice Ts Estrification-HydrolyseDocument5 pagesEnvoi Mail Exercice Ts Estrification-HydrolyseSteve CohenPas encore d'évaluation
- Correction Un Polymere BiodegradableDocument5 pagesCorrection Un Polymere BiodegradablegrajzgrPas encore d'évaluation
- 7SP06TEWO1720Document11 pages7SP06TEWO1720Nathan YikouPas encore d'évaluation
- ECE 23 PC 04 2268d1de29Document4 pagesECE 23 PC 04 2268d1de29fouziPas encore d'évaluation
- Exercices PC 2bac Science International FR 22 2Document5 pagesExercices PC 2bac Science International FR 22 2HAMADA1972Pas encore d'évaluation
- 2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsDocument4 pages2022 09 Metro J1 Exo1 Sujet AcideMethanoique 10ptsgrajzgrPas encore d'évaluation
- HydrobenzoineDocument7 pagesHydrobenzoinethecookerPas encore d'évaluation
- SEQ 2 CHIMIE THEORIQUE Tle CDDocument3 pagesSEQ 2 CHIMIE THEORIQUE Tle CDUlriche Enama EbandaPas encore d'évaluation
- Allantoine CorrectionDocument4 pagesAllantoine CorrectionzemmourmarwenPas encore d'évaluation
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 pagesExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalPas encore d'évaluation
- TS TPC11 Strategie Chimie Orga ComparaisonProtocolesDocument4 pagesTS TPC11 Strategie Chimie Orga ComparaisonProtocolesMouhamed NadirPas encore d'évaluation
- Exo Acide Carboxylique Et DérivésDocument3 pagesExo Acide Carboxylique Et DérivésOusmane DiarraPas encore d'évaluation
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Document8 pagesControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- Compte Rendu: TP Opération UnitaireDocument8 pagesCompte Rendu: TP Opération UnitaireCamelia BensmaiaPas encore d'évaluation
- Chap 4 Calcul Algébrique ELEVEDocument8 pagesChap 4 Calcul Algébrique ELEVEEmmanuel ChasPas encore d'évaluation
- Coll Jean Tabi Chimie TC-TD Seq2 2021-2022 Sujetexa - ComDocument3 pagesColl Jean Tabi Chimie TC-TD Seq2 2021-2022 Sujetexa - ComMilliardaire RüssëPas encore d'évaluation
- Exercice Pile DosageDocument4 pagesExercice Pile DosageAngélique GUAZPas encore d'évaluation
- 2021-09-Metro - Exo1-Correction-SyntheseEster-10ptsDocument3 pages2021-09-Metro - Exo1-Correction-SyntheseEster-10ptsMartin SALEHPas encore d'évaluation
- TP22 La Combustion de L Ethanol 2018 2019Document2 pagesTP22 La Combustion de L Ethanol 2018 2019pascal PascalPas encore d'évaluation
- Bac PCDocument4 pagesBac PCSawadogo LassinaPas encore d'évaluation
- Ts dst1 16-17Document2 pagesTs dst1 16-17Najimou Alade TidjaniPas encore d'évaluation
- 10 - DistillationDocument14 pages10 - DistillationEtienne jeoffreyPas encore d'évaluation
- TD Tampon 2019 LSLL WahabdiopDocument2 pagesTD Tampon 2019 LSLL WahabdiopOumou Khaïry DiopPas encore d'évaluation
- Bac CH 2000Document2 pagesBac CH 2000Haman Bello OumarouPas encore d'évaluation
- Epreuve de Chimie: Exercice 2: Application Des Savoirs 8 PointsDocument2 pagesEpreuve de Chimie: Exercice 2: Application Des Savoirs 8 Pointsmichelakon1Pas encore d'évaluation
- TP BiodieselDocument5 pagesTP Biodieselmotivation extraPas encore d'évaluation
- RCI 2017 BAC Serie D Physique ChimieDocument4 pagesRCI 2017 BAC Serie D Physique ChimieJunior RaymondPas encore d'évaluation
- Manip 2 OrgDocument4 pagesManip 2 OrgEddouks FatimazahraePas encore d'évaluation
- DM7 Reaction Equilibree Correction PDFDocument2 pagesDM7 Reaction Equilibree Correction PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- SERIEC1Document4 pagesSERIEC1Mouhamed lamine SonkoPas encore d'évaluation
- Livre Soleil Chimie APCDocument150 pagesLivre Soleil Chimie APCgzqg9cp7mtPas encore d'évaluation
- Énoncé Et Corrigé Du Devoir Maison #1 - 5Document1 pageÉnoncé Et Corrigé Du Devoir Maison #1 - 5Swahiboudine MohamedPas encore d'évaluation
- 2022 NelleCaledo J1 ExoA Correction AcBenzoique 5ptsDocument2 pages2022 NelleCaledo J1 ExoA Correction AcBenzoique 5ptsredatwitch2006Pas encore d'évaluation
- No9 26 Avril 2024 Sujetexa - ComDocument2 pagesNo9 26 Avril 2024 Sujetexa - ComAubin TcheunouPas encore d'évaluation
- tp02 ConvertiDocument10 pagestp02 ConvertiBrahmia MalakPas encore d'évaluation
- CO2 TS2 2016 LSLL Interrompu WahabdiopDocument4 pagesCO2 TS2 2016 LSLL Interrompu WahabdiopMed BriniPas encore d'évaluation
- OS Corrige OrganiqueDocument27 pagesOS Corrige OrganiqueJimmy Wright100% (1)
- Derniere Ligne Droite Bacc 2023Document12 pagesDerniere Ligne Droite Bacc 2023ArchPas encore d'évaluation
- 2021-09-Metro - Exo1-Correction-SyntheseEster-10ptsDocument3 pages2021-09-Metro - Exo1-Correction-SyntheseEster-10ptsOumaima BiyoudPas encore d'évaluation
- TIGps EB2 CHIM T-CDE Avril2022Document7 pagesTIGps EB2 CHIM T-CDE Avril2022grandmere307Pas encore d'évaluation
- ChimieDocument8 pagesChimieoneilltsayemPas encore d'évaluation
- Expériences ChimieDocument9 pagesExpériences Chimieami rPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Correction LAgrivoltaïsme Enseignement Scientifique TerminaleDocument2 pagesCorrection LAgrivoltaïsme Enseignement Scientifique Terminalejosiastite22Pas encore d'évaluation
- E3c Histoire Geographie General Terminale 05546 Sujet OfficielDocument4 pagesE3c Histoire Geographie General Terminale 05546 Sujet Officieljosiastite22Pas encore d'évaluation
- Évaluations Communes: GTCHIGE05665 GTCHIGE05665Document7 pagesÉvaluations Communes: GTCHIGE05665 GTCHIGE05665yourmomowerfwe//Pas encore d'évaluation
- Bonheur AITQ 09Document58 pagesBonheur AITQ 09josiastite22Pas encore d'évaluation
- Escalier WDocument1 pageEscalier WAMINE BENPas encore d'évaluation
- Exposé Réorganisation Du CapitalfinalDocument30 pagesExposé Réorganisation Du CapitalfinalAdil BentalebPas encore d'évaluation
- NXO 5v7ds7NU PDFDocument69 pagesNXO 5v7ds7NU PDFChristophe GarnierPas encore d'évaluation
- 425 914 1 SMDocument10 pages425 914 1 SMkami ouachemPas encore d'évaluation
- La Motivation Des Élèves de Formation ProfessionnelleDocument22 pagesLa Motivation Des Élèves de Formation ProfessionnelleOlsen MalagaPas encore d'évaluation
- French Gr5 Final RevDocument5 pagesFrench Gr5 Final Revezzeldin3khaterPas encore d'évaluation
- Elaboration Et Caracterisation Des Compo 20150413142733 582136Document5 pagesElaboration Et Caracterisation Des Compo 20150413142733 582136Fox FouPas encore d'évaluation
- Finances Publiques - Raya ChoubaniDocument37 pagesFinances Publiques - Raya Choubaniمنير بعكةPas encore d'évaluation
- Cours 4 Introduction À La Génomique 2021Document10 pagesCours 4 Introduction À La Génomique 2021fsxnsstoaehkbhlzygPas encore d'évaluation
- Osp 1168-35-4 La Notion de Projet en Psychologie de L OrientationDocument13 pagesOsp 1168-35-4 La Notion de Projet en Psychologie de L OrientationMus OubPas encore d'évaluation
- JumiaDocument3 pagesJumiakhalidPas encore d'évaluation
- Antoche 1497Document21 pagesAntoche 1497Flynders PetryePas encore d'évaluation
- Colle 02Document2 pagesColle 02Hamed TraorePas encore d'évaluation
- Projet PFE01Document127 pagesProjet PFE01soukaPas encore d'évaluation
- PédopsyDocument3 pagesPédopsyTASMINE HAMZAPas encore d'évaluation
- Sujet 2022Document4 pagesSujet 2022baha brahmiPas encore d'évaluation
- 2les NavigateursDocument2 pages2les NavigateursImane TlmPas encore d'évaluation
- Fiche ROME BrasseurDocument5 pagesFiche ROME BrasseuryannplmrPas encore d'évaluation
- Registre D'élevage Gratuit Plateforme Du MielDocument12 pagesRegistre D'élevage Gratuit Plateforme Du Mielmas.eric34Pas encore d'évaluation
- La Création de ValeurDocument68 pagesLa Création de Valeursene seydina mouhamedPas encore d'évaluation
- Plastiques TechniquesDocument1 pagePlastiques Techniquesbagueneau YOUTUBEPas encore d'évaluation
- Convention PFE EntrepriseenTunisieDocument3 pagesConvention PFE EntrepriseenTunisieChaima BelhediPas encore d'évaluation
- Cours No 10-Ostèologie (Suite)Document7 pagesCours No 10-Ostèologie (Suite)Feriel FerielPas encore d'évaluation
- Ystème NerveuxDocument4 pagesYstème NerveuxRabab Tamouh0% (1)
- Trading Price Action TRENDSDocument53 pagesTrading Price Action TRENDSKOUASSI KOFFI JEAN DE CAPISTRANPas encore d'évaluation