Académique Documents
Professionnel Documents
Culture Documents
TD Acide Fort Base Forte Dosage TS2
Transféré par
pathediakhate4Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TD Acide Fort Base Forte Dosage TS2
Transféré par
pathediakhate4Droits d'auteur :
Formats disponibles
INSTITUT MBACKÉ MATHS
C
O AL
N
R NA TIO
UR
S P RI V
COURS PRIVÉS EN LIGNE INTERNATIONAL
S TE
(+221) 70 713 09 21
É
I
N
EN
L IG N E
TD ACIDE FORT – BASE FORTE - DOSAGE
CORRECTION DISPONIBLE DANS NOS COURS EN LIGNE
PROF : M.DIOP (PC) ANNEE 2023-2024 Niveau : Terminale S2
Le volume molaire sera pris égal à 24,8 L à 25∘ C sous la pression de 1 bar. Les
mesures de pH se font toutes à 25∘ C.
❖ Exercice 1:
Le sulfate de sodium du commerce est un solide ionique hydraté de formule
Na2 SO4 , 10H2 O.
1. Quelle masse de ce composé faut-il placer dans une fiole jaugée de
250 mL pour que la solution aqueuse obtenue après la dilution ait une
concentration C = 0,20 mol. L−1 ?
2. Quelles sont alors les concentrations des ions Na+ et SO4 2− qu'elle
contient, sachant que la dissolution du sulfate de sodium s'accompagne
d'une dispersion totale de ces ions ?
3. La solution de sulfate de sodium est-elle électriquement neutre ?
4. Que1le masse de chlorure de sodium pur faudrait-il peser pour obtenir
100 mL d'une solution aqueuse de même concentration en ion Na+ ?
❖ Exercice 2:
On dispose d'une bouteille d'acide méthanoïque titrant 98% en masse. La
masse volumique de l'acide est 1,22 g ⋅ cm−3 . Avec une pipette, on prélève
11,5 cm3 de l'acide que l'on verse dans une fiole jaugée de 1 L. On verse
ensuite de l'eau pure pour obtenir 1 L de solution que l'on note S3 .
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 1
1. Déterminer la masse 𝑚 d'acide méthanoïque prélevée.
2. Déterminer la concentration C1 de la solution S1 .
3. Quel volume d'eau pure faut-il verser sur les 20 mL de la solution 𝑆1
pour avoir une solution S2 de concentration C2 = 0,10 mol−1 L−1
4. On dilue 10 fois la solution 𝑆2 . Calculer le volume d'eau pure nécessaire à
cette dilution et la concentration C3 de la solution S3 obtenue.
❖ Exercice 3:
1. Préparation d'une solution d'acide bromhydrique
Une solution de 1 L d'acide bromhydrique (qui est un acide fort) a un pH = 3.
Quel volume de bromure d'hydrogène (considéré comme un gaz parfait) a-t-il
fallu dissoudre dans 1 L d'eau pure pour obtenir cette solution?
2. Préparation d'une solution d'hydroxyde de potassium
Le pH d'une solution de 1 L d'hydroxyde de potassium (qui est une base
forte) vaut 9,5.
Quelle masse de KOH a-t-il fallu utiliser pour obtenir une telle solution?
3. Dilution et 𝐩𝐇
On considère une solution aqueuse d'acide nitrique (H3 O+ + NO3 − )de volume
VA = 50 mL et de concentration CA = 6,3 ⋅ 10−4 mol. L−1 . Le pH est 3,2 .
1. Montrer que l'acide nitrique est un acide fort. Ecrire l'équation de la
réaction de dissolution.
2. On prélève 𝑉1 = 20 mL de cette solution et on complète avec de l'eau
pure afin d'obtenir un volume final 𝑉 = 100 mL. Préciser la verrerie
nécessaire.
3. Calculer le pH de la solution finale.
4. Ion éthanolate
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 2
On dispose d'une solution d'éthanoate de sodium, de volume 25 mL et de
concentration 6, 3.10−3 mol. 𝐿−1.
Le pH mesuré est de 11,8.
1. L'ion éthanoate est-il une base forte ? Si oui, écrire l'équation de sa
réaction avec l'eau pure.
2. On prélève 10 mL de la solution et on complète avec 90 mL d'eau pure.
Quel est le pH de la solution finale?
5. Dilution et Mélange d'acides
1-Une solution d'acide chlorhydrique a un pH = 2,4.
a) Dans un volume 𝑉1 = 10 cm3 de cette solution chlorhydrique, on ajoute un
volume 𝑉2 = 5 cm3
d'eau pure. Quel est le pH final ?
b) Quel volume d'eau 𝑉 faudrait-il verser dans un volume 𝑉1 = 10 cm3 de la
solution initiale pour que le pH augmente de 1 unité ?
2-On mélange, un volume V1 = 100 mL d'une solution d'acide chlorhydrique de
pH = 2,7 et un volume V2 = 300 mL d'une solution d'acide chlorhydrique de
pH = 4. Quel est le pH de la solution finale ?
3- On mélange un volume V3 = 50 mL d'une solution d'acide iodhydrique HI
(acide fort) de pH inconnu et un volume V4 = 150 mL d'une solution d'acide
chlorhydrique de pH = 4,5. Le pH de la solution ainsi obtenue est de 3,2. Quel
est le pH inconnu ?
❖ Exercice 4:
I- Potasse et acide iodhydrique
On mélange un volume VB = 20 mL d'une solution d'hydroxyde de potassium ou
potasse (K + + OH− ) de concentration CB inconnue et volume VA = 10 mL
d'acide iodhydrique (H3 O+ + I − )de concentration
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 3
CA = 10−2 mol ⋅ L−1. Le mélange a un pH = 10.
1. Ecrire l'équation de la réaction et calculer les quantités de matière puis
les concentrations des différentes espèces présentes dans la solution.
2. Déterminer CB et en déduire le pH de la solution initiale d'acide
iodhydrique.
3. Quel volume 𝑉 d'acide iodhydrique doit-on rajouter pour atteindre
l'équivalence ? Que vaut alors le pH ?
II-Acide bromhydrique et soude
On mélange un volume VA = 50 mL d'acide bromhydrique (H3 O+ + Br − ), de
pH = 2,3 et volume VB = 50 mL de solution d'hydroxyde de sodium de pH
inconnu.
1. Écrire l'équation de la réaction ayant lieu.
2. Quel devrait être le pH de la solution de soude pour que le pH du
mélange soit égal à 7 ?
3. On suppose cette condition réalisée. Si on ajoute V ′ = 5 mL de la
solution d'hydroxyde de sodium au mélange précédent, quel sera le pH
final ?
III-éthanolate de sodium et d'acide chlorhydrique
On mélange VB = 20 mL d'une solution d'éthanolate de sodium de
concentration CB = 2.10−3 mol−L avec 𝑉𝐴 = 30 mL d'acide chlorhydrique de
−1
concentration 𝐶𝐴 = 4.10−3 mol. 𝐿−1 .
1. Quel est le pH des deux solutions avant leur mélange ?
2. Écrire l'équation de la réaction qui se produit.
3. Calculer les quantités de matière puis les concentrations des espèces
présentes en solution. La solution obtenue est-elle acide ou basique?
Déterminer son pH.
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 4
❖ Exercice 5:
L'acide sulfurique (H2 SO4 ) est un diacide fort.
Un litre d'une solution 𝑆 d'acide sulfurique a été préparé en diluant un volume
𝑉0 = 5 mL d'une solution commerciale, notée S0 . On dose un volume V = 10 mL
de S par une solution B d'hydroxyde de sodium de concentration
𝐶𝐵 = 0,1 mol/L. L'équivalence est obtenue pour un volume VB = 16 mL.
1. Écrire l'équation bilan de dissolution de l'acide sulfurique dans l'eau.
2. Décrire très précisément la préparation de la solution 𝑆 à partir de 𝑆0 .
3. Pour vérifier la présence d'ion sulfate dans la solution 𝑆, on ajoute une
solution de chlorure de baryum (BaCl2 ). Que se passe-t- il ? Écrire
l'équation bilan de la réaction correspondante.
4. Déterminer la concentration des ions H3 O+ dans la solution S; en déduire
la concentration C de la solution S, puis la concentration C0 de S0 .
5. L'étiquette du flacon contenant la solution commerciale 𝑆0 indique :
«densité par rapport à l'eau 𝑑 = 1,81; 90% en masse d'acide sulfurique».
Les résultats trouvés sont-ils en accord avec ces indications ?
❖ Exercice 6:
Dosage d'une solution d'acide chlorhydrique par la soude
Dans un bécher contenant un volume VA = 100 mL d'acide chlorhydrique, on
verse, à l'aide d'une burette, une solution d'hydroxyde de sodium de
concentration 𝐶𝐵 = 0,1 mol. 𝐿−1 . Le tableau cidessous indique pour différentes
valeurs du volume 𝑉𝐵 en mL de la solution de base versée, les valeurs
correspondantes du pH.
𝑉𝐵 (𝑚𝐿) 0 1,5 3 5 7 7,5 8 8,5 8,7 9 9,3 9,5 10 10,5 11 13
pH 2,1 2,2 2,3 2,4 2,7 2,8 3,0 3,4 3,7 7,0 10,0 10,4 10,8 11,0 11,2 11,4
1. Construire le graphique pH = f(VB ) sur papier millimétré, en indiquant
l'échelle.
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 5
2. Déterminer la concentration CA , en mol. L−1 , de la solution d'acide
chlorhydrique utilisée.
3. Écrire l'équation-bilan de la réaction entre l'ion hydroxyde et l'acide
chlorhydrique.
4. Parmi les trois indicateurs colorés cités ci-dessous quels sont ceux qui
pourraient servir au dosage de l'acide ? Comment serait repéré le
volume équivalent ?
Indicateurs rouge 3,1 orange 4,4 jaune
Hélianthine jaune 6,0 vert 7,6 bleu
Bleu de bromothymol jaune 10,1 orange 12 rouge
jaune d'alizarine
❖ Exercice 7:
L'étiquette d'une bouteille contenant une solution S0 d'acide chlorhydrique
porte les indications suivantes : «Acide chlorhydrique : masse volumique
𝜇 = 1190 g ⋅ L−1 ; pourcentage en masse d'acide chlorhydrique : 37%»
On introduit V = 4,2 mL de S0 dans une fiole jaugée de 500 mL contenant
environ 100 mL d'eau distillée puis on complète, jusqu'au trait de jauge, avec
de l'eau distillée.
1. Décrire le prélèvement des 4,2 mL.
2. Pourquoi a-t-on introduit de l'eau distillée dans la fiole jaugée avant
d'introduire la solution d'acide chlorhydrique?
3. Déterminer l'ordre de grandeur de la concentration de la solution 𝑆 ainsi
préparée.
4. Afin de vérifier cette concentration, on dose 𝑆 par une solution 𝐵
d'hydroxyde de potassium de concentration Cb = 4.10−2 mol. L−1 .
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 6
Dans 20 mL de la solution B, on verse VsmL de la solution S et l'on mesure le
pH après chaque ajout. On obtient les résultats suivants :
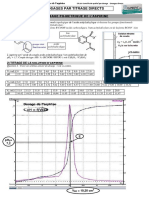
a) Construire la courbe pH = f(Vs). Déterminer le point équivalent VSE .
b) En déduire la concentration de la solution S. Conclure.
5. Choisir, dans la liste ci-dessous, un indicateur coloré adapté pour ce
dosage, et indiquer l'évolution de teinte lors du virage. Justifier la
réponse
Indicateur coloré
• Hélianthine
• Bleu de bromophénol
• Bleu de bromothymol
Zone de virage et couleur
• rouge 3,1 − 4,4 jaune
• jaune 3,0 − 4,6 bleu
• jaune 6,0 − 7,6 bleu
❖ Exercice 8:
Dans un laboratoire on dispose des produits suivants
• Une solution d'hydroxyde de sodium de masse volumique 𝜌 = 1,2 kg ⋅ L−1
et pourcentage
massique d'hydroxyde de sodium pur 16,7%
• Une solution d'acide sulfurique de concentration volumique C0
• De l'eau distillée
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 7
1. Montrer que la concentration volumique Cb de la solution S d'hydroxyde
167
de sodium peut s'écrire : 𝐶𝑏 = 𝜌 ( 𝜌 étant exprimée en kg. L−1 )
40
2. On prélève 10 mL de la solution 𝑆 qu'on dilue pour obtenir une solution 𝑆 ′
de concentration molaire volumique 𝐶 ′ 𝑏 = 0,1 mol.L-1. Déterminer le
volume d'eau distillée nécessaire à la préparation de S'
3. Afin de déterminer la concentration C0 de la solution d'acide sulfurique,
on dose 10 mL de celle-ci par la solution diluée S' d'hydroxyde de
sodium
a) Écrire l'équation bilan de la réaction.
b) A l'équivalence, le volume de la solution S' d'hydroxyde de sodium utilisé
est de 20 mL. Définir l'équivalence acido-basique et évaluer, justification à
l'appui, le pH du mélange à l'équivalence.
c) Calculer la concentration C0 de la solution sulfurique
d) Calculer les concentrations molaires volumiques des espèces présentes dans
le mélange obtenu à l'équivalence.
❖ Exercice 9:
1. On mesure le pH d'une solution aqueuse S0 d'acide perchlorique HClO4 ,
dont la concentration est C0 = 2,5 ⋅ 10−3 mol ⋅ L−1. On trouve pH = 2,6
1.1. Montrer que l'acide perchlorique est un monoacide fort
1.2. Écrire l'équation de la réaction de l'acide perchlorique avec l'eau
1.3. Indiquer le mode opératoire et la verrerie utilisée pour obtenir 100 mL de
solution 𝑆1 d'acide perchlorique de concentration C1 = 1,00 ⋅ 10−4 mol ⋅ L−1 à
partir de la solution précédente
1.4. Quel est le pH de la solution S1 ?
2. Une solution commerciale S0 d'hydroxyde de calcium Ca(OH)2 dibase
forte a une densité par rapport à l'eau d = 1,4 et titre 37% d'hydroxyde
de calcium en masse
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 8
2.1. Montrer que la concentration molaire de cette solution S ′ 0 est C0 =
−1
7 mol−L
2.2. Quel volume V' 0 de cette solution S ′ 0 doit-on diluer par de l'eau pure
pour obtenir 2 L de solution S1 1 de pH égal à 12,5 ? avec quelle verrerie
mesure-t-on V ′ 0 ?
3. 𝐴𝑉𝐴 = 175 mL de la solution 𝑆0 d'acide perchlorique, on ajoute 𝑉0 =
25 mL de la solution 𝑆1 d'hydroxyde de calcium
3.1. Écrire l'équation bilan de la réaction acide-base qui se produit.
3.2. La solution obtenue est-elle acide, neutre ou basique ? justifier la
réponse
3.3. Quel est le pH du mélange ?
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 9
INSTITUT MBACKE MATHS
https://www.mbackemaths.com/ǀǀ COURS PRIVÉS EN LIGNE 10
Vous aimerez peut-être aussi
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 pagesCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyPas encore d'évaluation
- Série DosageDocument8 pagesSérie DosageAicha Daou100% (1)
- Dosage Acide Base IndicDocument3 pagesDosage Acide Base IndicAs Ma50% (2)
- Chimie Organique: Professeur Chargé deDocument2 pagesChimie Organique: Professeur Chargé deOuedraogo HarounaPas encore d'évaluation
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- Acide Base Faible CoupleDocument5 pagesAcide Base Faible CoupleBicaba MarkissPas encore d'évaluation
- Exercice Corrigé - Dosage D'un Acide Fort Avec Une Base Faible (Allure de La Courbe PH F (Va)Document5 pagesExercice Corrigé - Dosage D'un Acide Fort Avec Une Base Faible (Allure de La Courbe PH F (Va)Baye ModouPas encore d'évaluation
- 2022 Examen 1 Chimie Solutions Corrigé LDDocument10 pages2022 Examen 1 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 pagesSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Chimie Tes 2019-1Document151 pagesChimie Tes 2019-1efoalphonse5Pas encore d'évaluation
- Devoir Contrôle N°1 Avec Correction - Physique - Lycée Hédi Chaker Sfax - Bac TunisieDocument6 pagesDevoir Contrôle N°1 Avec Correction - Physique - Lycée Hédi Chaker Sfax - Bac TunisieNidhàl BouzidiPas encore d'évaluation
- Acides Et Bases de BronstedDocument2 pagesAcides Et Bases de BronstedSmaali Faouzi Smaali100% (1)
- Série Acide Base Concour de ReorientationDocument2 pagesSérie Acide Base Concour de Reorientationfethi10% (1)
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 pagesSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahPas encore d'évaluation
- Exercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de SodiumDocument4 pagesExercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de Sodiumkhaoula elhansaliPas encore d'évaluation
- Exercices Mole-Masse Molaire-Concentration Molaire 1a12Document2 pagesExercices Mole-Masse Molaire-Concentration Molaire 1a12sana latifi100% (1)
- Les Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtDocument4 pagesLes Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtNjipnangPas encore d'évaluation
- Lycee Zahrouni-Tunis-: Mouvement Du Point MatérielDocument2 pagesLycee Zahrouni-Tunis-: Mouvement Du Point MatérielAnonymous YhXkmsEQWkPas encore d'évaluation
- Es1 CorrectionDocument2 pagesEs1 CorrectionShirley HePas encore d'évaluation
- Cours - Chimie - Les Acides Et Les BasesDocument6 pagesCours - Chimie - Les Acides Et Les BasesDaghsni Said100% (2)
- Serie 2 PHDocument3 pagesSerie 2 PHWassim Ben TanfousPas encore d'évaluation
- Concentration Et Solutions Électrolytiques: Exercice 1Document9 pagesConcentration Et Solutions Électrolytiques: Exercice 1king of DarknessPas encore d'évaluation
- RCI 2017 BAC Serie D Physique ChimieDocument4 pagesRCI 2017 BAC Serie D Physique ChimieJunior RaymondPas encore d'évaluation
- Série D'exercices - Sciences Physiques Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFDocument2 pagesSérie D'exercices - Sciences Physiques Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFAzizElheniPas encore d'évaluation
- Stock LesPdf Examens BAC Comores Corr 2018 Comores Corr A4 Mathematique Bac 2018Document6 pagesStock LesPdf Examens BAC Comores Corr 2018 Comores Corr A4 Mathematique Bac 2018Mahamoud Bacar100% (1)
- Brochure de Chimie TSM Tse (1) - 1Document46 pagesBrochure de Chimie TSM Tse (1) - 1Elhadj BahPas encore d'évaluation
- Ouvrir SA Chap1 ConductimétrieDocument44 pagesOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- Bac 2014 Bac Tech Epreuve Physique Session Controle Correction PDFDocument5 pagesBac 2014 Bac Tech Epreuve Physique Session Controle Correction PDFmomme deyahiPas encore d'évaluation
- Biophysique TD Corriges Diffusion Dans La Phase LiquidesDocument4 pagesBiophysique TD Corriges Diffusion Dans La Phase LiquidesYacine AchPas encore d'évaluation
- Cours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIDocument2 pagesCours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIMohamed HamdenePas encore d'évaluation
- Devoir - TN Devoir de Contrôle N°1 2014 2015 (Foued Bahlous) PDFDocument3 pagesDevoir - TN Devoir de Contrôle N°1 2014 2015 (Foued Bahlous) PDFyassine tanabenePas encore d'évaluation
- Serie 2 ENSA 22-23Document2 pagesSerie 2 ENSA 22-23ismailPas encore d'évaluation
- Exercices PDFDocument4 pagesExercices PDFالغزيزال الحسن EL GHZIZAL Hassane100% (3)
- Mélange en SocieteDocument28 pagesMélange en SocieteBill644Pas encore d'évaluation
- 2017 Acide-Base PDFDocument3 pages2017 Acide-Base PDFBen Mamia MahmoudPas encore d'évaluation
- Examen National Physique Chimie SPC 2009 Rattrapage SujetDocument6 pagesExamen National Physique Chimie SPC 2009 Rattrapage SujetŤăhã ÊìîPas encore d'évaluation
- Série D'exercices - Chimie Les Amides Aliphatiques - Bac Sciences Exp (2012-2013) MR Trayia Nabil 3Document1 pageSérie D'exercices - Chimie Les Amides Aliphatiques - Bac Sciences Exp (2012-2013) MR Trayia Nabil 3akrem300Pas encore d'évaluation
- Série 2 1ère S2 Nafooré 2122Document4 pagesSérie 2 1ère S2 Nafooré 2122mvlik.02Pas encore d'évaluation
- Devoir de Synthèse N°1 Avec CorrectionDocument8 pagesDevoir de Synthèse N°1 Avec CorrectionHaykelGaouaPas encore d'évaluation
- Sujet SVT Séries S2 S4 1 Ère Groupe Bac Sénégal 2017Document3 pagesSujet SVT Séries S2 S4 1 Ère Groupe Bac Sénégal 2017Ali SafiaPas encore d'évaluation
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucinePas encore d'évaluation
- Exercices Et CorrectionsDocument4 pagesExercices Et Correctionsrafacas100% (1)
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 pagesAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoPas encore d'évaluation
- 1 Bac Les Reactions Acido Basiques Cours 1Document6 pages1 Bac Les Reactions Acido Basiques Cours 1rihabPas encore d'évaluation
- Variation Du PH Au Cours Des Dosages Acide PDFDocument13 pagesVariation Du PH Au Cours Des Dosages Acide PDFAzizElheniPas encore d'évaluation
- Acides Et Bases Selon BrönstedDocument3 pagesAcides Et Bases Selon BrönstedLotfi Chimie100% (1)
- 6-Acides CarboxyliquesDocument1 page6-Acides CarboxyliquesBen Slema AzizPas encore d'évaluation
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Document8 pagesControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- Chemie 1Document1 pageChemie 1Jose YoussefPas encore d'évaluation
- Chap.3 ProtéineDocument46 pagesChap.3 ProtéineIngenieur AgroPas encore d'évaluation
- Acides Bases PDFDocument8 pagesAcides Bases PDFHafidi AhmedPas encore d'évaluation
- TD RedoxDocument3 pagesTD RedoxBamonPas encore d'évaluation
- Serie 5 Et 6 Solution Aqueuse Acide Fort Base ForteDocument7 pagesSerie 5 Et 6 Solution Aqueuse Acide Fort Base ForteCheujeu chaldouPas encore d'évaluation
- AFBF2021Document2 pagesAFBF2021Abdourahmane BaPas encore d'évaluation
- TD Solutions Aqueuses - Acide Fort Base Forte PH 2016Document6 pagesTD Solutions Aqueuses - Acide Fort Base Forte PH 2016Oumar Traoré100% (2)
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Mesure Du PH de Solutions DDocument5 pagesMesure Du PH de Solutions DMira OnPas encore d'évaluation
- Cours de Chimie: Niveau: Terminale SDocument14 pagesCours de Chimie: Niveau: Terminale SmedPas encore d'évaluation
- Exercice 5Document4 pagesExercice 5Il NBPas encore d'évaluation
- Indicateur Coloré UniverselDocument3 pagesIndicateur Coloré UniverselFabvfdgfdgPas encore d'évaluation
- Les Solutions Acides Et Les Solutions Basiques - Prof - TAHIRI (WWW - Pc1.ma)Document4 pagesLes Solutions Acides Et Les Solutions Basiques - Prof - TAHIRI (WWW - Pc1.ma)Start TechPas encore d'évaluation
- Acide 2 Calculs de PH 2Document11 pagesAcide 2 Calculs de PH 2ezezaeaPas encore d'évaluation
- 2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsDocument3 pages2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsHaman Bello OumarouPas encore d'évaluation
- ERC 18 Chapitre 7BDocument7 pagesERC 18 Chapitre 7Bبدر الذهابيPas encore d'évaluation
- TPacidite PDFDocument3 pagesTPacidite PDFMarouane TaibiniPas encore d'évaluation
- Interpretation GazometrieDocument1 pageInterpretation GazometrieAsmae OuissadenPas encore d'évaluation
- PH AcideDocument2 pagesPH AcideRezgui AbderrahimPas encore d'évaluation
- 1 Acides Exercices MelangesDocument5 pages1 Acides Exercices MelangesandoPas encore d'évaluation
- TP #01 - 2e Année - Fiche de TP 2021-2022Document3 pagesTP #01 - 2e Année - Fiche de TP 2021-2022asma belkheirPas encore d'évaluation
- C6 TDDocument2 pagesC6 TDKld Mnt0% (1)
- Corrigé TD2 CSDocument5 pagesCorrigé TD2 CSSimo MaroPas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Correction Serie N1 Analytique 1Document6 pagesCorrection Serie N1 Analytique 1Hk Eh100% (1)
- 12-TP Destop PH MetrieDocument4 pages12-TP Destop PH MetriesoufianePas encore d'évaluation
- Equilibre Acido-BasiqueDocument2 pagesEquilibre Acido-Basiquetiennou.lololPas encore d'évaluation
- Quelque Solution TomponDocument3 pagesQuelque Solution Tomponfoufou samsamPas encore d'évaluation
- Chapitre 6 - Reactions Acido - BasiquesDocument3 pagesChapitre 6 - Reactions Acido - BasiquesFongar gamingPas encore d'évaluation
- Chimie TleC, DDocument52 pagesChimie TleC, DDeffo100% (1)
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Correction Des Exercices Acides-Bases PDFDocument4 pagesCorrection Des Exercices Acides-Bases PDFbenkrimaPas encore d'évaluation
- Jenway PH Meter 550Document20 pagesJenway PH Meter 550Aldyan AnshariPas encore d'évaluation
- TP-PH Solution AqDocument2 pagesTP-PH Solution AqAnis DahnenPas encore d'évaluation
- Chimie Wts PDFDocument79 pagesChimie Wts PDFAbdoul-lahi Saâdou MoussaPas encore d'évaluation
- AL7SP02TDPA0212 Sequence 05 PDFDocument110 pagesAL7SP02TDPA0212 Sequence 05 PDFjulyimadiPas encore d'évaluation
- PH Acide Fort Ka. 2020-WahabDiopDocument3 pagesPH Acide Fort Ka. 2020-WahabDiopMohamed Aly SawadogoPas encore d'évaluation