Académique Documents
Professionnel Documents
Culture Documents
Ex Anodi
Transféré par
stepdies2Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ex Anodi
Transféré par
stepdies2Droits d'auteur :
Formats disponibles
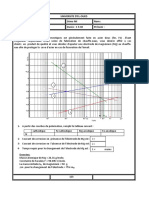
Sujet 45 : ANODISATION DE L’ALUMINIUM
Un amateur d’aéromodélisme souhaite protéger des rayures les pièces en aluminium présentes dans
son modèle réduit d’avion. Pour cela, il utilise un traitement de surface qui consiste à anodiser
l’aluminium afin de le durcir.
En effet, une couche d’alumine (Al2O3) de très faible épaisseur recouvre naturellement l’aluminium mais
cette couche fine est sujette à la détérioration.
L’anodisation consiste à oxyder en surface la pièce en aluminium ; la couche d’alumine ainsi formée est
plus épaisse et garantit une plus grande dureté.
Données :
Couples oxydant/réducteur : Al2O3(s) / Al(s) ; O2(g) /H2O(l) ; H+(aq) / H2(g).
Constante d’Avogadro : NA = 6,02 × 1023 mol–1 ;
Charge électrique élémentaire : e = 1,6 × 10–19 C ;
Masse molaire de l’alumine M(Al2O3) = 102 g.mol-1
Masse volumique de l’alumine ρ(Al2O3) = 4,0 g.cm-3
1) Principe de l’anodisation
La pièce d’aluminium propre est utilisée comme anode lors de l’électrolyse d’une solution aqueuse
d’acide sulfurique (2H+(aq) + SO42-(aq)) de concentration molaire en soluté apporté C = 2,0 mol.L-1. La
cathode est constituée d’un bâton de graphite. On utilise un générateur de tension continue et un
ampèremètre.
1.1. Indiquer le sens conventionnel du courant électrique et le sens de circulation des électrons sur la
figure ci-dessus.
1.2. Un dégagement gazeux se produit à la cathode. Écrire la demi-équation (1) d’oxydo-réduction
expliquant cette observation en utilisant l’un des couples cités dans les données précédentes. Justifier le
choix du couple.
1.3. Sachant que la pièce en aluminium doit être oxydée, indiquer sur la figure ci-dessus l’emplacement
du bâton de graphite et celui de la pièce.
1.4. Écrire la demi-équation (2) associée au couple Al2O3(s) / Al(s).
1.5. En déduire que l’équation d’oxydo-réduction de la réaction d’électrolyse s’écrit :
2 Al(s) + 3 H2O(l) = Al2O3(s) + 3 H2(g)
1.6. S’agit-il d’une transformation spontanée ou forcée ? Justifier.
2) Étude quantitative de l’électrolyse
La surface de la pièce à anodiser est S = 9,0 cm2. L’intensité I du courant délivrée par le générateur est
maintenue à 120 mA pendant la durée ∆t = 18 min de l’électrolyse.
2.1. Exprimer la quantité de matière d’électrons échangée, notée n(e-), pendant l’électrolyse en fonction
de I, NA, ∆t et e.
2.2. Quelle relation existe-t-il entre la quantité de matière d’alumine formée, notée n(Al2O3), et la
quantité de matière d’électrons échangée, n(e-) ?
2.3. Montrer que la masse maximale mmax d’alumine formée au niveau de la pièce a pour expression :
I t
m max M( Al 2 O 3 ) ; Calculer sa valeur.
6 NA e
2.4. Le rendement r de l’électrolyse est de 90 %. En déduire la masse m(Al2O3) d’alumine réellement
formée.
2.5. L’amateur d’aéromodélisme souhaite obtenir une couche d’alumine d’une épaisseur minimale d =
7,0 µm sur toute la surface de la pièce.
a) Calculer le volume V’(Al2O3) d’alumine minimal à déposer.
b) Déterminer la masse m’(Al2O3) correspondante.
c) L’épaisseur minimale d’alumine souhaitée n’est pas obtenue. Quels paramètres de
l’électrolyse peut-il modifier pour augmenter la quantité d’alumine déposée ?
Vous aimerez peut-être aussi
- Technologie de l’acier: Les Grands Articles d'UniversalisD'EverandTechnologie de l’acier: Les Grands Articles d'UniversalisPas encore d'évaluation
- Creer Famillier ElementauxDocument7 pagesCreer Famillier ElementauxvincentPas encore d'évaluation
- TD - Electrochimie - IUT Bobo Mai 2022Document5 pagesTD - Electrochimie - IUT Bobo Mai 2022Abdoul Kader OUATTARAPas encore d'évaluation
- TP N° 05 Dosage Des Protéines Totales Dans Un Blanc D'œuf Par La Méthode Du Biuret (Spectrophotométrie Indirecte)Document3 pagesTP N° 05 Dosage Des Protéines Totales Dans Un Blanc D'œuf Par La Méthode Du Biuret (Spectrophotométrie Indirecte)Bak RedaPas encore d'évaluation
- Serie Electrolyse Transformations ForcéesDocument6 pagesSerie Electrolyse Transformations ForcéesDaghsni Said100% (4)
- Diag Ellingham ExercicesDocument2 pagesDiag Ellingham ExercicesIsmailBelguith33% (3)
- ZincgageDocument6 pagesZincgageAmourat Papaha100% (1)
- Courbes I F (E) Aspect CinétiqueDocument13 pagesCourbes I F (E) Aspect Cinétiquebchedhly malakPas encore d'évaluation
- Re2210-18-01 NM 10.1.051 (2008)Document1 pageRe2210-18-01 NM 10.1.051 (2008)SAMI BERNOUSSIPas encore d'évaluation
- Examen 2014Document5 pagesExamen 2014Shining StarPas encore d'évaluation
- Exercice Corrigé N°2 Extraction De-L'aluminiumDocument6 pagesExercice Corrigé N°2 Extraction De-L'aluminiumLed Âutomobile Skikda100% (3)
- Electrolyse SerieDocument3 pagesElectrolyse SerieMeryem ChakriPas encore d'évaluation
- Reactions OxydoreductionDocument4 pagesReactions Oxydoreductionfouda fouda aloys baudouinPas encore d'évaluation
- PC Chimie1Document12 pagesPC Chimie1Kouka RoukeyaPas encore d'évaluation
- CH 25 Corrosion TDDocument14 pagesCH 25 Corrosion TDFatima BenPas encore d'évaluation
- Oxydoréduction PDFDocument5 pagesOxydoréduction PDFGaniyou AdenidjiPas encore d'évaluation
- A 98 Chimie PC École Nationale DesDocument11 pagesA 98 Chimie PC École Nationale Desrodrigue2010Pas encore d'évaluation
- Evaluation Solides Cristallins Sujet A À FDocument10 pagesEvaluation Solides Cristallins Sujet A À Frania rejebPas encore d'évaluation
- 1-Série 5 Chimie ElectrolyseDocument2 pages1-Série 5 Chimie Electrolysebelhajala25Pas encore d'évaluation
- Serie 16 ElectrolyseDocument3 pagesSerie 16 Electrolysee.maskarPas encore d'évaluation
- TD Applications Corrosion2020Document4 pagesTD Applications Corrosion2020Fatima BenPas encore d'évaluation
- TD ElectrochimieDocument4 pagesTD ElectrochimieRaja RajouPas encore d'évaluation
- EXAM Djelfa MI Corrosion 2012-2013Document3 pagesEXAM Djelfa MI Corrosion 2012-2013ميكانيك الوادي100% (1)
- Correction Examen Corrosion 2012Document7 pagesCorrection Examen Corrosion 2012claraliegeoisPas encore d'évaluation
- Exercices de CorrosionDocument2 pagesExercices de Corrosionadam.rial00Pas encore d'évaluation
- Travaux Dirigés de Science Des Matériaux (2018-2019) L2: Exercice 2DDocument3 pagesTravaux Dirigés de Science Des Matériaux (2018-2019) L2: Exercice 2DMelchisedek MeignanPas encore d'évaluation
- MP-Phys ChimDocument16 pagesMP-Phys ChimMetyPas encore d'évaluation
- CH18 ExercicesDocument2 pagesCH18 ExercicesHAMADA1972100% (1)
- EXAMEN FINAL Du Mardi 20 Janvier 2009 Partie A: Propriétés Mécaniques Des Matériaux (10 Points)Document4 pagesEXAMEN FINAL Du Mardi 20 Janvier 2009 Partie A: Propriétés Mécaniques Des Matériaux (10 Points)Hassan KamilPas encore d'évaluation
- TD1 PMM-Master2MDocument3 pagesTD1 PMM-Master2MNema NemaPas encore d'évaluation
- 64300b96248e1 - Magazine 2-Electrolyse - Enoncé Taki ChimieDocument5 pages64300b96248e1 - Magazine 2-Electrolyse - Enoncé Taki ChimieameuroussemaPas encore d'évaluation
- Corrigé SMC3 Normale 20 21Document4 pagesCorrigé SMC3 Normale 20 21Talel pdf100% (1)
- TD2 Caq 2022 2023Document4 pagesTD2 Caq 2022 2023Ayoub GhannamiPas encore d'évaluation
- PDF TD M1-01 2006Document6 pagesPDF TD M1-01 2006MohamedPas encore d'évaluation
- TD Cristalographie 2017-2018Document2 pagesTD Cristalographie 2017-2018HOUSSAME NAIM100% (3)
- 1035a02efs PDFDocument16 pages1035a02efs PDFMohamed0% (1)
- Bfem 2022 PCDocument3 pagesBfem 2022 PCSerigne Abdou DiopPas encore d'évaluation
- Recueil BODA ELECTRO. PG 2016Document12 pagesRecueil BODA ELECTRO. PG 2016mycorpbPas encore d'évaluation
- Electrolyse Exercices Corriges 03Document6 pagesElectrolyse Exercices Corriges 03znidi mohaPas encore d'évaluation
- 2021 Adn2 ADocument3 pages2021 Adn2 AManchester CityPas encore d'évaluation
- TD N 2 CHIMIE 1ère CDTIDocument2 pagesTD N 2 CHIMIE 1ère CDTIANDRE ELOCKPas encore d'évaluation
- CHAP3 Us ElechimDocument15 pagesCHAP3 Us ElechimKhaLed BenKaPas encore d'évaluation
- Activités 2 Transformations ForcéesDocument2 pagesActivités 2 Transformations ForcéesMed KassiouiPas encore d'évaluation
- Chimie Série 4 FBDocument10 pagesChimie Série 4 FBZayd Taibi0% (1)
- Activité Redox - CorrectionDocument2 pagesActivité Redox - CorrectionEl Mehdi (203) EL AZHARIPas encore d'évaluation
- Serie Exo Defaut Et Deformation Plastique 20Document8 pagesSerie Exo Defaut Et Deformation Plastique 20Ayoub DjouabiPas encore d'évaluation
- Cristallo ExercicesDocument8 pagesCristallo Exercicesemmanuel cerda adonaïPas encore d'évaluation
- Série Réaction RédoxDocument2 pagesSérie Réaction Rédoxاپن فلسىطين المتمرد شخصىيآPas encore d'évaluation
- Exercice 1Document2 pagesExercice 1عدنان كروميPas encore d'évaluation
- TD Métallurgie SE1 Exercice 1: Université Moulay Ismail ENSAM, MeknèsDocument8 pagesTD Métallurgie SE1 Exercice 1: Université Moulay Ismail ENSAM, Meknèsmathématiques de zéro. physiques de zéro.100% (1)
- Controle 1 3ème SciencesDocument4 pagesControle 1 3ème SciencesSmaali Faouzi SmaaliPas encore d'évaluation
- Physique Nucleaire TD SC 05Document2 pagesPhysique Nucleaire TD SC 05Abbé Marc LESSAMBAPas encore d'évaluation
- ExercicesDocument4 pagesExercicesYouness BenzekriPas encore d'évaluation
- Bfem PC 2022Document3 pagesBfem PC 2022sprezzidPas encore d'évaluation
- TD Cristalographie 20-21Document2 pagesTD Cristalographie 20-21Anas Edits100% (1)
- 8199 E4 U41 Ab Bts TM 2013 Partie 1 SujetDocument6 pages8199 E4 U41 Ab Bts TM 2013 Partie 1 SujetChokri AtefPas encore d'évaluation
- TD Ions MetalliquesDocument2 pagesTD Ions MetalliquessavadogowmauricePas encore d'évaluation
- Bacs Oblig 2009 Antilles Sept Sujet PDFDocument13 pagesBacs Oblig 2009 Antilles Sept Sujet PDFaa.aa1Pas encore d'évaluation
- Transformations Forcees Electrolyse Exercices Non Corriges 5 PDFDocument4 pagesTransformations Forcees Electrolyse Exercices Non Corriges 5 PDFnajiPas encore d'évaluation
- TD Etat Cristallin PDFDocument4 pagesTD Etat Cristallin PDFbenhadinPas encore d'évaluation
- TD Revêtements CorrosionDocument4 pagesTD Revêtements CorrosionChãìmá BøùręnnanePas encore d'évaluation
- TP MDC N°4Document4 pagesTP MDC N°4Adel KadiPas encore d'évaluation
- Detergence 2 Fiche SeanceDocument1 pageDetergence 2 Fiche SeanceRim NouriPas encore d'évaluation
- 3.2.roannaise SDEP Phase3Document151 pages3.2.roannaise SDEP Phase3GoudjilPas encore d'évaluation
- ChromatographieDocument29 pagesChromatographieidealchqPas encore d'évaluation
- Les États de La Matière (Unité 2)Document36 pagesLes États de La Matière (Unité 2)Dde DjdPas encore d'évaluation
- Thése TalbiDocument154 pagesThése TalbiChirazed ElbachirPas encore d'évaluation
- AfriqueScience PDFDocument11 pagesAfriqueScience PDFMarc Tokou LabitePas encore d'évaluation
- Progression Annuelle SecondeDocument2 pagesProgression Annuelle SecondeSahadat YameogoPas encore d'évaluation
- RecristalisationDocument10 pagesRecristalisationMoed Moed0% (1)
- Bilan Des Activités AtmosphèreDocument2 pagesBilan Des Activités AtmosphèreJanani mourougane100% (1)
- Réseau Eau Injection PALANCADocument2 pagesRéseau Eau Injection PALANCAredwanePas encore d'évaluation
- Série C3 Liaisons Chimiques 2nde S WWW - Axloutoth.snDocument2 pagesSérie C3 Liaisons Chimiques 2nde S WWW - Axloutoth.snDaouda FallPas encore d'évaluation
- Chimie - Fiche 1 - Grandeurs Caract RistiquesDocument6 pagesChimie - Fiche 1 - Grandeurs Caract RistiquesLucie GuillonPas encore d'évaluation
- 3 - Potabilisation de L'eauDocument33 pages3 - Potabilisation de L'eauHanan BenhmaidaPas encore d'évaluation
- Devoir LibreDocument2 pagesDevoir Librelobna souhaPas encore d'évaluation
- Bts1 Iacc Cours Biochimie Structurale Kouakou ChristelleDocument81 pagesBts1 Iacc Cours Biochimie Structurale Kouakou ChristelleKOUASSI ZABOPas encore d'évaluation
- MARMI M2GE Géochimie Cours Séances Janvier2021Document14 pagesMARMI M2GE Géochimie Cours Séances Janvier2021Hissein HabibPas encore d'évaluation
- Fiche Technique Interzinc 52Document4 pagesFiche Technique Interzinc 52As De PiquePas encore d'évaluation
- Cours MateriauxDocument15 pagesCours MateriauxSanaa TabitPas encore d'évaluation
- Cours La Cinétique FormelleDocument7 pagesCours La Cinétique Formellesafae ziyatiPas encore d'évaluation
- Ait Gherbi, ChafiaDocument115 pagesAit Gherbi, ChafiaWendkouni Josoé OUEDRAOGOPas encore d'évaluation
- FichierDocument3 pagesFichierwalid bakkouriPas encore d'évaluation
- Incertitude Et Logiciel GUM (MPRN)Document8 pagesIncertitude Et Logiciel GUM (MPRN)sofianesedkaouiPas encore d'évaluation
- TP PCMDocument8 pagesTP PCMNihel Tmi100% (1)
- CK45Document71 pagesCK45Baraa BaizidiPas encore d'évaluation
- Sciences Physiques: Année de L'enseignement de Base Collèges PilotesDocument200 pagesSciences Physiques: Année de L'enseignement de Base Collèges PilotesEssam SemmarPas encore d'évaluation