Académique Documents
Professionnel Documents
Culture Documents
Chapitre 2 Les Transformation
Transféré par
bakkari MCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 2 Les Transformation
Transféré par
bakkari MDroits d'auteur :
Formats disponibles
Machines thermiques
Chapitre 2
Les transformations réversibles
Objectifs
A la fin de ce chapitre, l'étudiant doit être capable de
- distinguer les différentes transformations
- tracer les différentes transformations dans les diagrammes (P,V) et( T,S)
I. Transformations réversibles des gaz parfaits
Le fonctionnement d’une machine thermique est décrit par un cycle thermodynamique formé
d’une succession de plusieurs transformations, supposées réversibles.
Dans ce qui suit, on va étudier uniquement les systèmes fermés subissant des transformations
réversibles.
1. Systèmes fermés
1.1. Transformation isochore
Dans le cas d’une transformation isochore le volume reste constant (V1 = V2).
Le travail
Entre les deux états 1 et 2 est : � � = � ∫ −�dV est nul, donc W12 = 0 car dV = 0.
La chaleur
Le premier principe s'écrit alors :
∆ = � − = Équation 28
La variation de l’énergie interne se traduit en chaleur.
Les échanges thermiques accompagnant une transformation isochore est égale à la variation de
l’énergie interne du système.
A.Taieb et Y.Ben Salem Page 15
Machines thermiques
1.2. Transformation isobare
La pression du gaz étant constante entre deux états 1 et 2 (P1 = P2).
Le travail
Le travail entre 1 et 2 vaut :
�=�∫ − =− ∫ =�− − Équation 29
La chaleur
∆ = + = − ∆ Équation 30
=�∆ + ∆ =∆ + Équation 31
On introduit la grandeur H , qui est l’enthalpie du système. Elle est définie par la relation
�= + Équation 32
Pour un temps dt, la relation s’écrit : � = + + ; En conséquence, =� +
=− + devient� = �− , Or dP=0 (transformation isobare), on en déduit
que, les échanges thermiques accompagnant une transformation isobare est égale à la variation
de l’enthalpie du système : = ∆�
1.3. Transformation isotherme
L'équation d'état donne : PV = Cte.
Le travail
Le travail échangé au cours de la transformation s'écrit :
�=�∫ − Équation 33
La pression varie suivant la loi PV = nRT => P1V1 = P2V2, d'ou l'expression du travail pour une
transformation isotherme :
�=�∫ − = −� ∫ = −� � Équation 34
Ce qui équivaut à:
�=� � � = � � Équation 35
La chaleur
La chaleur échangée est donnée par l'application du premier principe de la thermodynamique
ΔU12 = 0 :
= −� =� � =�− � ���������������������Équation 36
A.Taieb et Y.Ben Salem Page 16
Machines thermiques
1.4. Transformation adiabatique (isentropique S = 0)
La transformation adiabatique s'effectue sans échange de chaleur (système thermiquement isolé)
alors Q12 = 0.
Relation de Laplace
=� + ������������������������������������������Équation 37
Considérons une masse d’un gaz parfait qui décrit une transformation adiabatique :
� =�− � � = ����������������Équation 38
Sachant que ���������������������� = + = n R dT Équation 39
De (39), on déduit ���������������� = + Équation 40
�
− = + Équation 41
� �
Ou encore ���������������� + +� = Équation 42
� �
�
+ = Équation 43
V P
En divisant par V×P, on obtient l’équation suivante : C +�C =
V P
P p V
On peut aussi réécrire sous la forme + =
P v V
� P V
On introduit le coefficient = on aura
P
+γ
V
=
Qui s’intègre en : ���ln + ln =
�
��u�b�en�ln =
�d′ �u�������������� � = Équation 44
p
�V v =�cst : l’adiabacité : relation de Laplace
RT -1
En remplaçant P = , on obtient en variables (T, V) : TV = Cte
V
−γ
De même, en variables (P, T) : �. � γ = C�e
A.Taieb et Y.Ben Salem Page 17
Machines thermiques
Le travail
Le travail est défini par :
�=�∫ − ���������������������������������Équation 45
Puisque PV = P1V1 = P2V2 = Cte, on écrit :
γ dV γ dV
� � = � −� V ∫ γ
= � −� V ∫ γ
V V
On en déduit l'expression du travail :
. � − − . � − −
�=� ( − )= ( − ) Équation 46
− −
En utilisant la loi d'état, les chaleurs molaire ou massique, l'expression du travail peut s'écrire
sous d'autres formes :
n� m�
���� = n. C � − � = � m. c � − � =� � � − � �=� � � −�
γ− γ−
L’énergie interne
L'application du premier principe donne W12 + Q12 = ΔU12 avec Q12 = 0. Alors :
ΔU12 = W12
1.5.Transformation polytropique
Dans le cas de transformations réelles, les relations entre les grandeurs d'état sont plus ou moins
bornées par la transformation isotherme et la transformation adiabatique. Elles sont nommées
transformations polytropiques, telles que : PV k = Cte. avec 1< k < .
Le travail
Pour le calcul du travail échangé au cours d'une transformation polytropique, il s'agit du même
calcul que pour la transformation adiabatique en remplaçant γ par k :
�= � − Équation 47
−
A.Taieb et Y.Ben Salem Page 18
Machines thermiques
La chaleur
La chaleur échangée au cours d'une transformation polytropique n'est pas nulle, le premier
principe donne :
−
=∆ −� �= .� − �� � −� Équation 48
−
On la donne également sous la forme :
−�
∆
=� ������������������������� Équation 49
−
Règle générale
La formule PVk=Cte englobe toutes les transformations précédentes:
Si K=0: transformation isobare
Si k=1: transformation isotherme
Si 1<k<� : transformation polytropique
Si K=� : transformation adiabatique
Si k=∞: transformation isochore
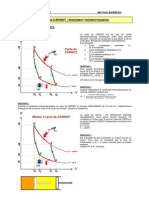
La presentation des differentes transformations dans le diagramme PV sont montrés
respectivement dans la figure suivante :
Figure 10: Allure des courbes caractéristiques isentropiques, isochore, isobare,
isotherme sur le diagramme (P, V)
A.Taieb et Y.Ben Salem Page 19
Machines thermiques
Application 1
Dans un corps de pompe muni d’un piston mobile, on place 0.0β mole d’un gaz parfait
diatomique. A l’état initial le piston est en équilibre avec une pression extérieure constante Pext=
1,013 bar à la température de 300K.
On fait subir à ce gaz les transformations successives suivantes :
Etat 1-Etat 2 : compression isotherme réversible jusqu’à une pression de β atm
Etat2-Etat3 : chauffage isobare le ramenant à son volume initial
Etat3-Etat1 : refroidissement isochore le ramenant à l’état initial
1) Donner pour chaque état, les valeurs des variables (P, V, T). Présenter les résultats dans
un tableau
2) Tracer le diagramme P=f(V)
3) Déterminer les valeurs de W, Q et ∆H correspondant à chacune des transformations
On donne
= ; R= 8.31 J.mol-1.K-1=0.082 l.atm.mol-1K-1
Réponse
1) – Etat 1 : état d’équilibre P1= Pext=1.013 bar ; T1=300K
L’équation d’état d’un gaz parfait s’écrit : �V = n��
=� ; AN: = . �
- Etat 2 : T2=T1=300K (transformation isotherme(T reste constante)) ; P2=2atm
=� ; AN: = .
-Etat 3 : = = �� (Transformation isobare) ; = = . �
=� =
2) Diagramme P= f(V)
A.Taieb et Y.Ben Salem Page 20
Machines thermiques
3) =�− or on a une transformation réversible = �
V V V
dV V
� = ∫ −� x dV = ∫ −� dV = ∫ −n�� = �n�� l��
V V V V V
���� = , �J
∆H=0 et ∆U =0 (Car la transformation est isotherme)
Le 1er principe de la thermodynamique s’écrit ∆� = � + � = donc
� = −� = − . �J
- Transformation 2-3 : chauffage isobare (P constante)
V V
� − =∫ −� x �dV = −� x ∫ dV = � x V − V =�− . �J
V V
T
∆� = � = ∫ nC d� = n ∗ ⁄ � � − � = . J
T
-Transformation 3-1 : refroidissement isochore (V constant)
V=cst ; dV=0 =
T
� − = � ∆� = ∫ nC d� = nC � − � =− . �J
T
T
∆� = � ∫ nC d� = nC � − � =�− . �J
T
A.Taieb et Y.Ben Salem Page 21
Machines thermiques
Application 2
Soit un récipient de 15 litres de volume initialement du dioxyde de carbone CO2 à 25°C et sous
une atmosphère. On suppose que, dans ces conditions, le gaz se comporte comme gaz parfait.
1) Dans une première expérience, le gaz est comprimé réversiblement et de manière
adiabatique de cet état à un état final où le volume est de 10 litres et la température de
335 K.
Sachant que la capacité calorifique molaire à volume constant du dioxyde de carbone est
égale à 6 cals K-1mol-1, Calculer :
a) La quantité de chaleur échangée avec l’extérieur
b) Le travail effectué au cours de cette transformation en joules
2) Dans une deuxième expérience, le gaz est comprimé réversiblement et de manière
isotherme jusqu’à un volume de 10 litres
a) Calculer le travail effectué au cours de cette transformation en joules
b) Déduire la quantité de chaleur échangée au cours de cette transformation
Réponse
1) a. Transformation adiabatique Q=0
b. ∆� = � + ������ = ��d�nc�∆� = � = � ∫ = ( − �)
�
PV
Gaz parfait PV=nRT donc n = AN : n= 0.614 mol
RT
�= . �J
V V V V
2) a. compression réversible � = ∫V f −� x dV = ∫V f −� dV = −n�� ∫V f
i i i V
V
= n�� l�� V ; AN: W= 620,3J
b. ∆ = + �; � = � ∆ − or ∆U=0 (car U est une fonction d’état et toute
fonction d’état ne dépend que de la température)
Q=-W= -620,3 J
A.Taieb et Y.Ben Salem Page 22
Machines thermiques
Exercices d’application
Exercice 1
Un gaz parfait sous une pression de 0.5 bars et une température de 15°C subit une compression
réversible dans un système fermé jusqu'à la pression de 7 bars. La température atteinte à la fin de
compression est 207 °C.
Déterminer le type de la transformation réalisée.
On donne =1.4
Réponse
PVk=Cte et PV=nRT
Donc: P(nRT/P)k= Cte et P1-kTk=Cte1
Ainsi, PA1-kTAk= PB1-kTBk
( ) =
On applique le logarithme Népérien on obtient
− ln�
=
ln�
Et on obtient (1-k)/k=-0.19
Et donc k=1.23: transformation polytropique
Exercice 2
Un piston parfaitement calorifugé contient un gaz parfait à la température T0=20°C, P0=1 bar et
V0=10l. On augmente progressivement la pression jusqu'à atteindre le volume V1=V0/10.
Calculer V1, T1, P1 et les énergies échangées au cours de cette transformation.
Réponse
A.Taieb et Y.Ben Salem Page 23
Machines thermiques
Parfaitement calorifugé=adiabatique reversible
V1=1l
P0V0 = P1V1
Donc P1=P0(V0/V1) =25,44 105Pa
De plus P0V0=nRT0 et P1V1=nRT1 donc T0(P1V1/P0V0)=T1=735,8K
Compression adiabatique: Q=0
W=nR(T1-T0)/( -1)
= ( − )
−
W=3827,44J
Exercice 3
L'état initial d'une mole de gaz parfait est caractérisé par P0=2 bars et V0=14l. On fait subir
successivement à ce gaz :
- Une détente isobare qui double son volume
- Une compression isotherme qui le ramène à son volume initial
- Un refroidissement isochore qui le ramène à son état initial
1. Déterminer P, V et T aux différents points
2. Représentez le cycle dans le diagramme PV
3. Calculer les énergies échangées pour chaque transformation
Réponse
1.
P( bars) T(K) V(l)
Point 0 2 336,78 14
A.Taieb et Y.Ben Salem Page 24
Machines thermiques
Point 1 2 673,5 28
Point 2 3,99 673,5 14
Exemple de calcul: P0V0=nRT0 et donc T0=P0V0/nR=336,78K
2.
3.
W01=-P(V1-V0)=-2800 J
Q01=∆H=nR (T1-T0)/( -1)=9815,6 J
W12=-nRTln(V2/V1)=1685,61 J
Q12=-W12=-1685,61 J
W20=0J
Pour Q20, on peut déduire directement vu que pour un cycle ∆U=0=ƸQ+ƸW ou faire le calcul
de la chaleur avec la formule Q20=nCv(T0-T2)
A.Taieb et Y.Ben Salem Page 25
Machines thermiques
Exercice4
On considère deux moles d’un gaz parfait qui subissent le cycle de transformations suivant :
Une compression isobare irréversible qui le fait passer de l’état A (PA, VA, TA) à l’état B
(PB, VB, TB) tel que VB=� V , VA=10 L et PA= 1atm
Un chauffage isochore et réversible jusqu’à une pression PC=6 PB
Une détente isobare irréversible qui le ramène à un volume VA
Un refroidissement isochore et irréversible jusqu’à son état initial.
Données
-La capacité calorifique molaire à pression constante C = c�l. m�l− � −
- La constante du gaz � = . �J� − m�l−
1) Déterminer les caractéristiques du gaz (P, T et V) aux différents points.
2) Donner l'allure du cycle sur un diagramme (P, V)
3) Calculer le travail échangé par le gaz au cours de chacune des quatre transformations.
Déduire le travail global échangé.
4) Calculer la quantité de chaleur échangée par le gaz au cours de chacune des quatre
étapes. En déduire la quantité de chaleur globale échangée
5) Déterminer la variation de l’énergie interne de chacune des évolutions. Calculer la
variation d’énergie interne globale
6) Donner l’expression de la variation de l’enthalpie. Calculer l’enthalpie globale
Réponse
1.
Point Pression (Pa) Température (K) Volume (l)
A 103 60 10
B 105 20 3.33
A.Taieb et Y.Ben Salem Page 26
Machines thermiques
C 5.105 100 3.33
D 5.105 300.45 10
2.
3.� = . �J ; � = ; =�− . ; =
= + + + =�− .
4.� = − . J; � = . J;� = J;� =− . J
�=� +� +� +� = . J
5.∆� = − , J ; ∆� = . J ; ∆� = . J ; ∆� = − , J
∆� = ∆ +∆ +∆ +∆ = .
A.Taieb et Y.Ben Salem Page 27
Machines thermiques
Exercice 5
La densité d’un gaz G par rapport au dioxygène O2 est d=1,25.
3.85 Kg de G occupe un volume V1 à la température T1= 500K sous la pression P1= 5 bar
1) Calculer son volume V1
2) On fait subir à G les transformations réversibles suivantes : AB, détente adiabatique ; BC,
échauffement à pression constante (état B : PB= 1bar , TB, VB ; état C PC, TC, VC); CA,
compression isotherme .
Calculer TB, VB et Vc
Déterminer le travail reçu par le gaz G au cours des trois transformations WAB, WBC et
WCA
3) Calculer la capacité calorifique à pression constante CP du gaz G.
4) Calculer la quantité de chaleur QBC reçue par G pendant la transformation BC .Montrer
que QBC peut être déduire des résultats de la question 2.
Réponse
1.V = .
2.
V = . � ;�� = . ;V = �
� − =�− , ;�� =�− �;��� = , �
3.
− −
C = .
4. � = , �
Pour le cycle∆� = =� + + + + + .
Les travaux sont connus (question 2), QAB=0 et QCA=-WCA si bien que
QBC= -(WAB+WBC)= 473,5 Kj
A.Taieb et Y.Ben Salem Page 28
Vous aimerez peut-être aussi
- TP Machine Thermique4Document12 pagesTP Machine Thermique4SOUKAINA HANINEPas encore d'évaluation
- Cours 2stm Manuel ApplicationDocument97 pagesCours 2stm Manuel Applicationyassine2267% (6)
- Compte Rendu TP3Document6 pagesCompte Rendu TP3Abd El Basset BeNmansour100% (1)
- 11 Machines ThermiquesDocument6 pages11 Machines ThermiquesMohamed Hichem Guesmi0% (1)
- TP CN FraisageDocument4 pagesTP CN FraisageWael Ben RomdhanePas encore d'évaluation
- TP MoteurDocument6 pagesTP Moteurdan100% (2)
- Avant ProposDocument2 pagesAvant ProposAnonymous y0LSdyM6YTPas encore d'évaluation
- Examen Conversion EnergieDocument3 pagesExamen Conversion EnergieBoutaharPas encore d'évaluation
- TP1 Transfert Thermique L3 Construction MécaniqueDocument3 pagesTP1 Transfert Thermique L3 Construction Mécaniquetayeb FittPas encore d'évaluation
- Bac SSI 2009 Actionneur Commande Vol A380Document34 pagesBac SSI 2009 Actionneur Commande Vol A380kingofdarkness2010Pas encore d'évaluation
- TP Compress Eur 2011Document7 pagesTP Compress Eur 2011Khalil Lasfer67% (3)
- TP SoufflerieDocument4 pagesTP SoufflerienidhalePas encore d'évaluation
- Solution - TD1 - Cycle de Miller-AtkinsonDocument5 pagesSolution - TD1 - Cycle de Miller-AtkinsonhousamPas encore d'évaluation
- Machine ThermiqueDocument34 pagesMachine ThermiqueAzzeddine MokhtarPas encore d'évaluation
- 643 PDFDocument118 pages643 PDFZi Nou100% (1)
- Puissance 2Document5 pagesPuissance 2Nacef ÏslãmPas encore d'évaluation
- Machines Thermiques Alternatives - CompletDocument78 pagesMachines Thermiques Alternatives - Completachraf100% (1)
- TP Moteur A Combustion InterneDocument12 pagesTP Moteur A Combustion InterneBenaissa DjaberPas encore d'évaluation
- MMC Enim TDDocument16 pagesMMC Enim TDWassim Ben SalahPas encore d'évaluation
- TP - 3 - Essai Sur Un Ventilateur AxialDocument4 pagesTP - 3 - Essai Sur Un Ventilateur AxialMohammed ALMUSHIAA100% (1)
- Compte Rendu:: Influence Des Paramètres de Coupe Sur L'état de SurfaceDocument10 pagesCompte Rendu:: Influence Des Paramètres de Coupe Sur L'état de SurfaceFerchichi HajerPas encore d'évaluation
- Cahier de Charge Enetcom PlanneurDocument9 pagesCahier de Charge Enetcom PlanneurOussama AziziPas encore d'évaluation
- Vibration de Systèmes ContinusDocument10 pagesVibration de Systèmes ContinusMohamed El Hadi Redjaimia100% (1)
- Texte TP Deltalab TractionDocument6 pagesTexte TP Deltalab TractionPramod Rathoa100% (1)
- Tp4 Calcul Raideur Rdm6 Optimisation de Structure Logiciel RDM Le ManDocument5 pagesTp4 Calcul Raideur Rdm6 Optimisation de Structure Logiciel RDM Le ManAmine RdPas encore d'évaluation
- Compte Rendu TP FAO AvancéeDocument9 pagesCompte Rendu TP FAO AvancéemahdiPas encore d'évaluation
- TP 2Document5 pagesTP 2Hana HosniPas encore d'évaluation
- Pfe MecaniqueDocument5 pagesPfe MecaniqueAmira Warhéni100% (1)
- Act (Tour Pinacho - Embrayage) P143-147 PDFDocument5 pagesAct (Tour Pinacho - Embrayage) P143-147 PDFnassim100% (1)
- Chap 1-Turbomachine approfondie-M1E-S2Document7 pagesChap 1-Turbomachine approfondie-M1E-S2Allai WafaPas encore d'évaluation
- 4.TP4 - Equilibrage Des MassesDocument12 pages4.TP4 - Equilibrage Des MassesHicham KhalloukiPas encore d'évaluation
- Chapitre I - TurbomachineDocument11 pagesChapitre I - TurbomachinezinebPas encore d'évaluation
- Chapitre 2Document106 pagesChapitre 2bezaPas encore d'évaluation
- Chapitre IV. Compression Des GazDocument10 pagesChapitre IV. Compression Des GazBilal Bouakrif100% (1)
- Mini ProjetDocument22 pagesMini ProjetOumar SissokoPas encore d'évaluation
- TD3 - Mécanique Des ContactsDocument2 pagesTD3 - Mécanique Des ContactsKhaled GammoudiPas encore d'évaluation
- TP Pompe À EngrenageDocument8 pagesTP Pompe À EngrenagehoussemPas encore d'évaluation
- Catalogue Choix Vérins HydrauliquesDocument60 pagesCatalogue Choix Vérins HydrauliquesStephane Tchoriang100% (1)
- TP TractionDocument11 pagesTP TractionOussema TrikiPas encore d'évaluation
- TP1 - Banc D'essai de Flexion - TomDocument17 pagesTP1 - Banc D'essai de Flexion - TomNancy DakdoukiPas encore d'évaluation
- Cours 1 CFAO.Document13 pagesCours 1 CFAO.Bibo LovitchePas encore d'évaluation
- 03-Interpolation Polynômiale by MR KAMMOUSDocument46 pages03-Interpolation Polynômiale by MR KAMMOUSOUMAIMA BAHAFIDPas encore d'évaluation
- Chapitre 2 Ecoulement Isentropique 1DDocument17 pagesChapitre 2 Ecoulement Isentropique 1DMarwan Dhib100% (1)
- Rapport PeugeotDocument39 pagesRapport PeugeotHãĐiR chetouiPas encore d'évaluation
- Un Tableau Comparatif Entre Diesel Et - HTMLDocument2 pagesUn Tableau Comparatif Entre Diesel Et - HTMLOualid OuadoudiPas encore d'évaluation
- Cohésion CorrectionDocument36 pagesCohésion CorrectionYahya BelbassiPas encore d'évaluation
- CFL01 - Introduction À L'utilisation Du Logiciel FluidSIM - Pneumatique Et ÉlectropneumatiqueDocument17 pagesCFL01 - Introduction À L'utilisation Du Logiciel FluidSIM - Pneumatique Et ÉlectropneumatiqueYassine Azougagh0% (1)
- TP SoufflerieDocument6 pagesTP SoufflerieAchraf BouhayekPas encore d'évaluation
- TD0 - Rappel Thermodynamique Sur MCIDocument3 pagesTD0 - Rappel Thermodynamique Sur MCIhousamPas encore d'évaluation
- 03 Cisaillement RDMDocument2 pages03 Cisaillement RDMInes BhaPas encore d'évaluation
- TP Les Dispersions en UsinageDocument5 pagesTP Les Dispersions en UsinageBilel Boulehmi0% (1)
- Calcul Vérin Et DistribDocument2 pagesCalcul Vérin Et DistribdolokhovPas encore d'évaluation
- Rapport Simulation AnsysDocument9 pagesRapport Simulation AnsysOmar SerhirPas encore d'évaluation
- Conversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanD'EverandConversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanPas encore d'évaluation
- Simulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysD'EverandSimulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysPas encore d'évaluation
- Les Compteurs Et Decompteurs PDFDocument11 pagesLes Compteurs Et Decompteurs PDFbakkari MPas encore d'évaluation
- Grafcet Et Point de Vue PDFDocument4 pagesGrafcet Et Point de Vue PDFbakkari MPas encore d'évaluation
- Chapitre 4 Cycles Des Moteurs Combustion Interne PDFDocument22 pagesChapitre 4 Cycles Des Moteurs Combustion Interne PDFbakkari MPas encore d'évaluation
- TDTH4 09 10Document4 pagesTDTH4 09 10ELArabiFatimaezzahraaPas encore d'évaluation
- TDTH4 09 10Document4 pagesTDTH4 09 10ELArabiFatimaezzahraaPas encore d'évaluation
- Chapitre 5 Machines FrigorifiquesDocument16 pagesChapitre 5 Machines Frigorifiquesbakkari MPas encore d'évaluation
- TD Thermo5Document1 pageTD Thermo5Ahlam MimiPas encore d'évaluation
- Chapitre 5 Machines FrigorifiquesDocument16 pagesChapitre 5 Machines Frigorifiquesbakkari MPas encore d'évaluation
- Cycle Machines VapeurDocument22 pagesCycle Machines Vapeurbakkari MPas encore d'évaluation
- Ecoconso - Que Signifient Les Nouveaux Pictogrammes de Danger - 2023-02-01Document4 pagesEcoconso - Que Signifient Les Nouveaux Pictogrammes de Danger - 2023-02-01Dieudonné NofodjiPas encore d'évaluation
- Calcul Des Roulements 2Document11 pagesCalcul Des Roulements 2Amine MechPas encore d'évaluation
- Grille-Observation EgronDocument10 pagesGrille-Observation EgronSofia KHOUBBANEPas encore d'évaluation
- AVENTURE DE L'ELECTRICITE - C'est Pas Sorcier Spécial Enseignant - Yoshi37Document2 pagesAVENTURE DE L'ELECTRICITE - C'est Pas Sorcier Spécial Enseignant - Yoshi37BarbaraPas encore d'évaluation
- B 800 Cbe 59Document2 pagesB 800 Cbe 59mahdi elmayPas encore d'évaluation
- Cours 21-26 (Unite 6 +7)Document54 pagesCours 21-26 (Unite 6 +7)Maria SimotaPas encore d'évaluation
- 2015 04 17 - Business Plan 2015 2017 - FRDocument88 pages2015 04 17 - Business Plan 2015 2017 - FRfohi2009Pas encore d'évaluation
- TP Mineralogie PDFDocument40 pagesTP Mineralogie PDFMohamed Al100% (3)
- Chapitre - 1 PH201Document15 pagesChapitre - 1 PH201FanxyvPas encore d'évaluation
- Tchekhov Les Trois SoeursDocument28 pagesTchekhov Les Trois SoeursCristina MiaPas encore d'évaluation
- Diabete Gestationnel SynthDocument12 pagesDiabete Gestationnel SynthDumas Tchibozo100% (1)
- Colchicine Dans La Goutte Usage Et MésusageDocument6 pagesColchicine Dans La Goutte Usage Et MésusageAmine DounanePas encore d'évaluation
- MemoireDocument120 pagesMemoireabdelndam904Pas encore d'évaluation
- 14 Antalgiques PDFDocument50 pages14 Antalgiques PDFLonely SnailPas encore d'évaluation
- Dosage de La Vitamine CDocument10 pagesDosage de La Vitamine CalexisbradPas encore d'évaluation
- TD BetonDocument10 pagesTD BetonAggoun YounesPas encore d'évaluation
- Brochure Charte Audit Interne 2015def22x23def16pages Corrig2e 1Document16 pagesBrochure Charte Audit Interne 2015def22x23def16pages Corrig2e 1ʚïɞ Fi Fi ʚïɞPas encore d'évaluation
- Abord Premier de L'artère Mésentérique Supérieure Au Cours de La Duodénopancréatectomie CéphaliqueDocument3 pagesAbord Premier de L'artère Mésentérique Supérieure Au Cours de La Duodénopancréatectomie CéphaliquefdroooPas encore d'évaluation
- 25 - Workflow Demande de ModificationDocument1 page25 - Workflow Demande de ModificationSerge VolpiPas encore d'évaluation
- Graniscel S55Document2 pagesGraniscel S55Aîda hajriPas encore d'évaluation
- Comprendre La SchizophrénieDocument25 pagesComprendre La SchizophrénieMontada DjazaironaPas encore d'évaluation
- Coloration GramDocument6 pagesColoration GramFatmazohra RAHILPas encore d'évaluation
- Mesures Anthropométriques Pour L'évaluation de L'état Nutritionnel D'un Individu & La Situation Dans Une CommunautéDocument67 pagesMesures Anthropométriques Pour L'évaluation de L'état Nutritionnel D'un Individu & La Situation Dans Une CommunautéIbrahim HamadouPas encore d'évaluation
- FIT Manioc 2014Document2 pagesFIT Manioc 2014Williams Koffi100% (1)
- SN5 Corrige3 VFDocument23 pagesSN5 Corrige3 VFSimrat KaurPas encore d'évaluation
- CND SRDocument2 pagesCND SRFethi BELOUISPas encore d'évaluation
- RTEC Cassette - R410A - InverterDocument2 pagesRTEC Cassette - R410A - InverterMohamed KhaldiPas encore d'évaluation
- 01-03 - Dec10 - Philippe Dozoul - AFNOR - FDX50-252 - Francais PDFDocument24 pages01-03 - Dec10 - Philippe Dozoul - AFNOR - FDX50-252 - Francais PDFNassima Bendjeddou100% (1)
- Protocole Reherche 15 Sept 2023Document78 pagesProtocole Reherche 15 Sept 2023Ali AIT-MOHANDPas encore d'évaluation
- Get File PDFDocument28 pagesGet File PDFHichemPas encore d'évaluation