Académique Documents
Professionnel Documents
Culture Documents
Cours Conductance
Transféré par
فيديو بالعربيCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Cours Conductance
Transféré par
فيديو بالعربيDroits d'auteur :
Formats disponibles
Détermination d’une quantité
de matière
( Par mesure de grandeur physique
Et conductimètrie )
I/ Détermination de la quantité de matière par mesure d’une grandeur physique
Formulaire
On note que la quantité de matière représente le nombre de moles d’une substance et elle s’exprime en mol
La quantité de matière peut être égal :
𝒎
1) n = 𝑴 m : masse de l’échantillon en gramme ( g )
M : masse molaire du substance en gramme par mol ( g.mol-1 )
2) Pour une solution aqueuse n = C.V C : Concentration molaire de la solution ( mol.L-1 )
V : Volume de la solution en litre ( L )
𝑽
3) Pour une substance gazeuse n = 𝑽 V : Volume du gaz en Litre ( L )
𝑴
VM : Volume molaire en litre par mol ( L.mol-1 )
Remarque
On veut déterminer le nombre de mol n d’une substance A de masse volumique ρA et de densité dA
𝒎𝑨
On a n = or mA = ρA .VA et ρA = dA. ρeau ( On note que ρeau =1g.cm-3 )
𝑴( 𝑨 )
𝑽𝑨
D’où on trouve n = dA ρea
𝑴( 𝑨 )
II/ Par conductance
Définition :
La conductance G d’une portion de solution électrolytique est égal à l’inverse de sa résistance électrique R
𝟏
Soit G = , elle s’exprime en siemens ( S ) et R en ohm ( Ω )
𝑹
Remarque :
Soit U la tension aux bornes de la portion électrolytique ( V )
Soit I l’intensité du courant qui circule dans le circuit ( A )
𝑈
D’après la loi d’ohm U = R.I d’où R = 𝐼 donc on peut déduire
𝑰
que G =
𝑼
Donc expérimentalement on peut déterminer la conductance G
par la mesure de la tension U à l’aide du voltmètre et la mesure
de I à l’aide du voltmètre
( Cation + Anion )
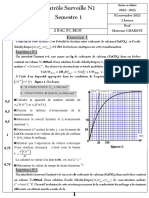
On peut tracer la courbe de la conductance G en fonction de la concentration
G ( mS ) La courbe de G = f ( c ) est une droite linéaire d’équation G = KC
K : la pente de la droite
Soit n la quantité de matière contenue dans la solution
𝑮
n = C.V = 𝑲 .V
C ( mol .L-1 )
Vous aimerez peut-être aussi
- Caractéristiques de Quelques Dipôles PassifsDocument7 pagesCaractéristiques de Quelques Dipôles Passifsrawya AkimakhPas encore d'évaluation
- Gsa 2bac 1819 Eb2 PCF PCDocument5 pagesGsa 2bac 1819 Eb2 PCF PCHAMADA1972Pas encore d'évaluation
- Cours 4 Pr. Hicham Mahajar Pr. Youssef TabitDocument6 pagesCours 4 Pr. Hicham Mahajar Pr. Youssef TabitMohamed JaadiPas encore d'évaluation
- ds1 PCDocument4 pagesds1 PCFATIMA fatiiiPas encore d'évaluation
- DSFR 2 Bac 4Document3 pagesDSFR 2 Bac 4Mouhibi AbdellahPas encore d'évaluation
- Chapitre-4 - Etat D'équilibre D'un Système Chimique (Compléte)Document11 pagesChapitre-4 - Etat D'équilibre D'un Système Chimique (Compléte)a houssPas encore d'évaluation
- Suivi TeporelleDocument16 pagesSuivi TeporelleMustapha Zaki0% (1)
- Devoir Maison 01-2bac-BIOFDocument1 pageDevoir Maison 01-2bac-BIOFFatima EssalhiPas encore d'évaluation
- Ph2le Diple RLDocument11 pagesPh2le Diple RLpPas encore d'évaluation
- Nucleaire 2 BACDocument6 pagesNucleaire 2 BACaymanebenaissa20Pas encore d'évaluation
- Noyau-Masse-Énergieprof - Asnaoui Omar (WWW - Pc1.ma)Document5 pagesNoyau-Masse-Énergieprof - Asnaoui Omar (WWW - Pc1.ma)mohamed laghribPas encore d'évaluation
- Controle N1 2BAC PC BIOF 22 OmarDocument4 pagesControle N1 2BAC PC BIOF 22 Omarassad saisPas encore d'évaluation
- Devoir de Contrôle N°2 Lycée Pilote - Sciences Physiques - Bac Technique (2012-2013) MR Imed RADHOUANIDocument6 pagesDevoir de Contrôle N°2 Lycée Pilote - Sciences Physiques - Bac Technique (2012-2013) MR Imed RADHOUANIKhalil Bkekri0% (1)
- Devoir de Contrôle N°3 - Math - Bac Math (2010-2011) MR AzaiezDocument2 pagesDevoir de Contrôle N°3 - Math - Bac Math (2010-2011) MR AzaiezGogo100% (1)
- Analogie Entre Les Oscillations Électriques Et Les Oscillations MécaniquesDocument2 pagesAnalogie Entre Les Oscillations Électriques Et Les Oscillations Mécaniqueslinda Ben AttiaPas encore d'évaluation
- Examen National 2016 Session Normal-SVTDocument6 pagesExamen National 2016 Session Normal-SVTMohamed El OuahdaniPas encore d'évaluation
- ExamenBlanc PC FR 2022 Visa - 230528 - 075809Document9 pagesExamenBlanc PC FR 2022 Visa - 230528 - 075809Imane HachamiPas encore d'évaluation
- Equilibre Esterification-Hydrolyse PDFDocument7 pagesEquilibre Esterification-Hydrolyse PDFAzizElheniPas encore d'évaluation
- Grandeurs Physiques Liees A La Quantite de Matiere Cours 1 4Document3 pagesGrandeurs Physiques Liees A La Quantite de Matiere Cours 1 4Lucifer MorningstarPas encore d'évaluation
- Resonance Intensite ScexpDocument2 pagesResonance Intensite ScexpNesrine Ben Aziz100% (1)
- La Décroissance Radioactive1-1Document8 pagesLa Décroissance Radioactive1-1Jad BensaidPas encore d'évaluation
- Dynamique Des Mouvements de TranslationDocument6 pagesDynamique Des Mouvements de TranslationnassimPas encore d'évaluation
- Les Mouvements PlanaireDocument6 pagesLes Mouvements PlanaireAbdolilahe EssaPas encore d'évaluation
- Mouvement Dans Champ MagnDocument10 pagesMouvement Dans Champ MagnMehdi BnmssdPas encore d'évaluation
- Exercice Suivi Temporelle ChimieDocument4 pagesExercice Suivi Temporelle ChimiePhobos ElfaPas encore d'évaluation
- Examen Blanc 2BAC PC Modèle 3 (WWW - Chtoukaphysique.com) 2Document8 pagesExamen Blanc 2BAC PC Modèle 3 (WWW - Chtoukaphysique.com) 2Wissal ChoukiPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques LA BOBINE ET LE DIPOLE RL - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFDocument5 pagesSérie D'exercices N°2 - Sciences Physiques LA BOBINE ET LE DIPOLE RL - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFMahmoud Essahbi Sahbi DaghsniPas encore d'évaluation
- TS - 06 - RC Et RLDocument3 pagesTS - 06 - RC Et RLالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Cours - Sciences Physiques DIPOLE RL - Bac Math (2015-2016) ACADEMIE ARCHIMEDE EL MOUROUJ PDFDocument5 pagesCours - Sciences Physiques DIPOLE RL - Bac Math (2015-2016) ACADEMIE ARCHIMEDE EL MOUROUJ PDFLotfi HammamiPas encore d'évaluation
- RL ProfDocument5 pagesRL Profelmahdi12Pas encore d'évaluation
- Gabarit 1 2021 Cours Bac CondensateurDocument4 pagesGabarit 1 2021 Cours Bac CondensateurjurassiqueparkPas encore d'évaluation
- Série Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 2Document10 pagesSérie Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 2chadaPas encore d'évaluation
- Bac Mauritanie DDocument3 pagesBac Mauritanie DMed AbdessalamPas encore d'évaluation
- Controle 2 - 4 S2 PC 1bac FRDocument1 pageControle 2 - 4 S2 PC 1bac FRmohmedPas encore d'évaluation
- Examen National Physique Chimie SPC 2010 Normale SujetDocument6 pagesExamen National Physique Chimie SPC 2010 Normale SujetŤăhã ÊìîPas encore d'évaluation
- Circuit RLC Serie en Regime Sinusoidal Force Cours Latex 1Document8 pagesCircuit RLC Serie en Regime Sinusoidal Force Cours Latex 1Salsabile LaminePas encore d'évaluation
- 12 Mecanique Oscillations Forcees ExercicesDocument2 pages12 Mecanique Oscillations Forcees ExercicesLucas Imren100% (1)
- Serie2 PhysiquesDocument5 pagesSerie2 PhysiquesJabri ImenePas encore d'évaluation
- Vert de Bromocrésol 2008-2009Document3 pagesVert de Bromocrésol 2008-2009Daniela Dinica100% (1)
- Dipole RCDocument4 pagesDipole RCTAOUFIK MACHTALAYPas encore d'évaluation
- TP14 Travail D'une Force EC2021Document4 pagesTP14 Travail D'une Force EC2021Maxime DecouvelaerePas encore d'évaluation
- Chimie (08points) : Correction de Devoir de Synthese N°1Document3 pagesChimie (08points) : Correction de Devoir de Synthese N°1Slimi FaridPas encore d'évaluation
- Cours - Chimie - RESUME EQUILIBRE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFDocument3 pagesCours - Chimie - RESUME EQUILIBRE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFMohamed HamdenePas encore d'évaluation
- Série D'exercices N°6 - Math Dérivabilités - 3ème Sciences Exp (2022-2023) MR Douma AliDocument4 pagesSérie D'exercices N°6 - Math Dérivabilités - 3ème Sciences Exp (2022-2023) MR Douma Alifazaa imed0% (1)
- دروس الفيزياء والكيمياء أولى باك علوم رياضية خيار فرنسيةDocument301 pagesدروس الفيزياء والكيمياء أولى باك علوم رياضية خيار فرنسيةAli OuchnPas encore d'évaluation
- Extrait de Cours Sciences Physiques TerminaleDocument15 pagesExtrait de Cours Sciences Physiques TerminaleAmine schoolPas encore d'évaluation
- Décroissance Radioactive CoursDocument21 pagesDécroissance Radioactive CoursÅnþôņīo Məđ100% (1)
- Dipole RL Prof - Sbiro (WWW - Pc1.ma)Document5 pagesDipole RL Prof - Sbiro (WWW - Pc1.ma)lahcen essPas encore d'évaluation
- Site TS-P 05 La Decroissance RadioactiveDocument5 pagesSite TS-P 05 La Decroissance RadioactivePecorellaPas encore d'évaluation
- Chapitre 7, Dip - Le RL, Activit - S, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDDocument5 pagesChapitre 7, Dip - Le RL, Activit - S, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDMondher DhahriPas encore d'évaluation
- Devoir 2 Modele 5 Mathematiques 2 Bac SPC Semestre 1Document1 pageDevoir 2 Modele 5 Mathematiques 2 Bac SPC Semestre 1Zakaria AjichePas encore d'évaluation
- Normal 2018 PDFDocument10 pagesNormal 2018 PDFMohamed El OuahdaniPas encore d'évaluation
- Série D'exercices N°1 Lycée Pilote - Sciences Physiques CINEMATIQUE - Bac Sciences (2012-2013) MR Abdellahi Ahmed TalebDocument2 pagesSérie D'exercices N°1 Lycée Pilote - Sciences Physiques CINEMATIQUE - Bac Sciences (2012-2013) MR Abdellahi Ahmed TalebWiem BenchahbounPas encore d'évaluation
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucinePas encore d'évaluation
- Série D'exercices - Physique Filtre - Bac Technique (2012-2013) MR Trayia NabilDocument2 pagesSérie D'exercices - Physique Filtre - Bac Technique (2012-2013) MR Trayia NabilLam LamPas encore d'évaluation
- 09 - La Propagation D'une Onde Sinusoïdale EntretenueDocument7 pages09 - La Propagation D'une Onde Sinusoïdale EntretenuedaddouPas encore d'évaluation
- PR: Mazigh Mohamed Tel: 0600134474: Série D'exercice Chute Verticale D'un Corps SolideDocument6 pagesPR: Mazigh Mohamed Tel: 0600134474: Série D'exercice Chute Verticale D'un Corps SolideMohamed MazighPas encore d'évaluation
- Cours Dynamique Des StructuresDocument2 pagesCours Dynamique Des StructuresAbderrahim Boulanouar100% (1)
- Resumer Onde Et SuiviDocument27 pagesResumer Onde Et SuiviZiad BounejmaPas encore d'évaluation
- Cours - Physique Dipole RL - Bac Sciences Exp (2011-2012) MR Chawki RahaliDocument5 pagesCours - Physique Dipole RL - Bac Sciences Exp (2011-2012) MR Chawki RahaliGastØn El GassPas encore d'évaluation
- Cours - Sciences Physiques - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal AliDocument5 pagesCours - Sciences Physiques - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal Aliفيديو بالعربيPas encore d'évaluation
- Cours Et Exercices Corrigés en PascalDocument71 pagesCours Et Exercices Corrigés en PascalBabacar Ngom71% (7)
- PhyDocument3 pagesPhyفيديو بالعربيPas encore d'évaluation
- XXXXCCDocument165 pagesXXXXCCفيديو بالعربيPas encore d'évaluation
- Cours Et Exercices Corrigés en PascalDocument71 pagesCours Et Exercices Corrigés en PascalBabacar Ngom71% (7)
- Devoir de Contrôle N°1 (AVec Correction) - Physique - 2ème TI (2010-2011) MR Abdessatar PDFDocument4 pagesDevoir de Contrôle N°1 (AVec Correction) - Physique - 2ème TI (2010-2011) MR Abdessatar PDFفيديو بالعربيPas encore d'évaluation
- Cours Et Exercices Corrigés en PascalDocument71 pagesCours Et Exercices Corrigés en PascalBabacar Ngom71% (7)
- FICHE Dosage WebDocument4 pagesFICHE Dosage Webفيديو بالعربيPas encore d'évaluation
- Drainage AgricoleDocument21 pagesDrainage AgricoleMamadou lamine CamaraPas encore d'évaluation
- FICHE TD Etat MoteurDocument12 pagesFICHE TD Etat MoteurFakhreddine Ben MhenniPas encore d'évaluation
- Tunnel - 4 Note de Calcul PDFDocument56 pagesTunnel - 4 Note de Calcul PDFGhani LrPas encore d'évaluation
- Colle Pour Carreaux de Plâtre PF 3 SINIAT, 5 KG Leroy MerlinDocument1 pageColle Pour Carreaux de Plâtre PF 3 SINIAT, 5 KG Leroy MerlinClaudiuPas encore d'évaluation
- Catalogue SanoTek RetailDocument8 pagesCatalogue SanoTek RetailEssamoual MohamedPas encore d'évaluation
- SDF MaintenanceDocument151 pagesSDF MaintenanceNour Imane100% (1)
- TL TD02Document2 pagesTL TD02NoureddineRmilaPas encore d'évaluation
- C2 JavelDocument3 pagesC2 JavelFoudil LaouiciPas encore d'évaluation
- Extrait 42150210 PDFDocument91 pagesExtrait 42150210 PDFRabii Monta100% (1)
- DEMOULIN Marc - Transvasements Gazeux Dans Les Moteurs ThermiquesDocument27 pagesDEMOULIN Marc - Transvasements Gazeux Dans Les Moteurs ThermiquesYodaScribdPas encore d'évaluation
- 4 Formule BruteDocument2 pages4 Formule BruteNajib Nouisser100% (2)
- Manual PewagDocument60 pagesManual Pewagmrpt2015Pas encore d'évaluation
- Martin LudovicDocument54 pagesMartin LudovicLoubna MiagePas encore d'évaluation
- Anios Steril AES+ECODocument1 pageAnios Steril AES+ECOYassine JazoulierPas encore d'évaluation
- Lettre Motivation Dut Informatique 5Document2 pagesLettre Motivation Dut Informatique 5Stephane LoePas encore d'évaluation
- Haute Disponibilité Avec Partage de Charge PDFDocument24 pagesHaute Disponibilité Avec Partage de Charge PDFMarouani AmorPas encore d'évaluation
- Mon GPS en ActionDocument296 pagesMon GPS en ActionnasrudinePas encore d'évaluation
- Valorisation Des Fibres de Kénaf Dans Des Applications Textiles Et ParatextilesDocument153 pagesValorisation Des Fibres de Kénaf Dans Des Applications Textiles Et Paratextilesserhrouchni nourelhoudaPas encore d'évaluation
- Ds Topographie 1GC Iset Nabeul 2012Document3 pagesDs Topographie 1GC Iset Nabeul 2012Soulaima Seddiki100% (1)
- DT SB V3-Parfum Fr-Lazer Rev A.1Document8 pagesDT SB V3-Parfum Fr-Lazer Rev A.1Jan OlivierPas encore d'évaluation
- SDM TPDocument7 pagesSDM TPGOUAL SaraPas encore d'évaluation
- VSOMFT Formation Vmware Vsphere With Operations Management Fast Track PDFDocument3 pagesVSOMFT Formation Vmware Vsphere With Operations Management Fast Track PDFCertyouFormationPas encore d'évaluation
- Circuit Electrique Dun Bruleur A Air SouffleDocument8 pagesCircuit Electrique Dun Bruleur A Air Soufflelyoussimosab2003Pas encore d'évaluation
- Guide Exploitation FR2Document13 pagesGuide Exploitation FR2zouhairabdelatif100% (1)
- TP TalendDocument29 pagesTP TalendKawtarSolo100% (2)
- These Dupuy 2008Document203 pagesThese Dupuy 2008Jihen BoukadidaPas encore d'évaluation
- Rapport Devoir 2Document8 pagesRapport Devoir 2line caulfutyPas encore d'évaluation
- Document 11Document10 pagesDocument 11JamsePas encore d'évaluation
- Corrige Serie3 PDFDocument5 pagesCorrige Serie3 PDFMohamedDokse0% (1)
- Abs R19 16SDocument5 pagesAbs R19 16SHichamRabanePas encore d'évaluation