Académique Documents
Professionnel Documents
Culture Documents
Exercices Conductance Et Conductivite
Exercices Conductance Et Conductivite
Transféré par
Elmi Bileh RachidTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices Conductance Et Conductivite
Exercices Conductance Et Conductivite
Transféré par
Elmi Bileh RachidDroits d'auteur :
Formats disponibles
CONDUCTANCE ET CONDUCTIVITÉ D’UNE SOLUTION IONIQUE
Exercice n°1 : Influence de la géométrie de la cellule
On plonge totalement une cellule conductimétrique constituée de deux plaques parallèles (de surface S=1,0cm 2)
distantes de L=1,0cm dans une solution ionique. La tension appliquées entre les deux électrodes de la cellule est
U=1,00V et l’intensité électrique mesurée est I=12,0mA
1- Déterminer la résistance et la conductance de la portion de solution comprise entre les deux électrodes.
2- Déterminer la conductivité de la solution.
3- Quelle serait la valeur de la conductance si on immergeait à moitié les électrodes dans la même solution ?
4- Quelle serait la valeur de la conductance si on divisait par 2 la distance séparant les électrodes totalement
immergées dans cette même solution ?
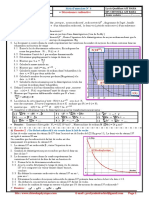
Exercice n°2 : Courbe d’étalonnage
On étalonne une cellule conductimétrique en mesurant la conductance de solutions de chlorure de sodium de diverses
concentrations à la température du laboratoire.
C (mmol.L-1) 2,00 4,00 6,00 8,00 10,0
G (µS) 25,0 50,2 75,6 101 126
1- Tracer la courbe d’étalonnage G=f(c). Que peut-on en conclure ? Déterminer l’équation de la courbe d’étalonnage.
2- On souhaite utiliser le résultat de l’étalonnage pour déterminer la concentration inconnue c 0 d’une solution S0 de
chlorure de sodium. Quelles conditions opératoires faut-il respecter ?
3- Ces conditions étant respectées, on mesure G=90,7µS. Déterminer la concentration molaire c0 de la solution. En
déduire sa concentration massique.
Données : M(Na)=23,0g.mol-1 ; M(Cl)=35,5g.mol-1.
Exercice n°3: Relation entre les conductivités ioniques de différentes solutions.
La conductivité d’une solution de (K++Cl-), de concentration c, est de 114,3µS.cm-1, mesurée à la température du
laboratoire. On a mesuré, la même température, les conductivités d’autres solutions à la même concentration ;
(Na+ + Cl-), (K+ + I-), (Na+ + I-).
On a trouvé : 96,2 µS.cm-1, 114,9 µS.cm-1, 95,7 µS.cm-1.
1- Attribuer à chaque solution sa conductivité. Justifier la réponse.
2- quelle relation a-t-on entre les conductivités des solutions suivantes:
(Na+ + Cl-), (K+ + I-), (Na+ + I-) et (K+ + Cl-)
3- La concentration de ces solutions est-elle de 0,8.10 -3 mol.L-1 ou de 8.10-3 mol.L-1 ? Justifier la réponse.
Données à 25°C, en mS.m2.mol-1 λ(Na+)=5,01 ; λ(I-)=7,70 ; λ(Cl-)=7,63 ; λ(K+)=7,35
Exercice n°4: Constante d’une cellule conductimétrique
Pour étalonner une cellule conductimétrique, on utilise une solution étalon de chlorure de potassium de concentration
c=1,00.10-2mol.L-1 à la température de 25°C. On mesure la tension aux bornes de la cellule et l’intensité du courant qui la traverse :
on trouve U=1,57V et I=1,82mA.
1- Exprimer puis calculer la conductance G en mS de la portion de solution comprise entre les électrodes.
2- Exprimer la conductimétrie σ de la solution en fonctions des conductivités molaires ioniques des ions présents et de leur
concentration. Calculer σ.
L
3- Calculer la constante de la cellule k= en unités SI.
S
4- Les plaques de la cellule sont séparés d’une distance L=2,0cm. Quelle est leur surface ?
Données : λ(K+)=7,35.10-3 S.m2.mol-1 ; λ(Cl-)=7,63.10-3 S.m2.mol-1
Exercice n°5 : Conductivité et dilution
La conductivité d’une solution de bromure de potassium est égale à σ=3,0.10-2S.m-1.
1- Ecrire l’équation de la dissolution du bromure de potassium dans l’eau.
2- Calculer la concentration molaire de la solution en mol.L-1.
3- On dilue 10 fois. Quelle sera alors la valeur de la conductivité de la solution diluée ?
Données : λ(K+)=7,35.10-3 S.m2.mol-1 ; λ(Br -)=7,81.10-3 S.m2.mol-1
Exercice n°6 : Mélange de deux solutions électrolytiques
On dispose d’un volume V1=100mL d’une solution aqueuse S1 de chlorure de potassium et d’un volume V2=50,0mL d’une solution
aqueuse S2 de chlorure de sodium. La concentration molaire de la solution S1 est égale à c1=1,5.10-3mol.L-1 et la concentration
molaire de la solution S2 est égale à c2=1,3.10-3mol.L-1.
1- Calculer les conductivités σ1 et σ2 de chacune de ces solutions.
On mélange ces deux solutions.
2- Calculer la concentration molaire de chaque ion dans le mélange.
3- Calculer la conductivité σ du mélange.
4- Quelle serait la valeur de la conductance mesurée à l’aide d’électrodes de surface S=1,0cm2, distantes de L=5,0mm ?
Données : λ(K+)=7,35.10-3 S.m2.mol-1 ; λ(Cl-)=7,63.10-3 S.m2.mol-1 ; λ(Na+)= 5,01.10-3 S.m2.mol-1
Exercice n°7 :Caractérisation d’une espèce ionique
Vous aimerez peut-être aussi
- Champ G Et eDocument89 pagesChamp G Et eValdes Kouassi100% (1)
- Acide Et Base - DosageDocument33 pagesAcide Et Base - Dosagemohamed saidi67% (3)
- Correction Série #15 PhysiqueDocument6 pagesCorrection Série #15 PhysiqueSiham Darif100% (4)
- Cours - Suivi TemporelDocument7 pagesCours - Suivi TemporelRedouane Reda100% (2)
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 pagesSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- Les Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Document2 pagesLes Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Faysal Douhdouh0% (2)
- Séries D'exercices N°1 Et 2 - Le Champ Magnétique Créé Par Un Courant Électrique - Dr. Karam OuharouDocument3 pagesSéries D'exercices N°1 Et 2 - Le Champ Magnétique Créé Par Un Courant Électrique - Dr. Karam Ouharouأكاديمية التأكدم - Taakdom Academy100% (4)
- Cours de 2bac BIOF de Semestre 1, ChrikiDocument105 pagesCours de 2bac BIOF de Semestre 1, ChrikiACHRAF DOUKARNE100% (1)
- Le+Dipôle+RL Cours FRDocument8 pagesLe+Dipôle+RL Cours FRالغزيزال الحسن EL GHZIZAL Hassane0% (1)
- Exercices Corrigés: Le Dipôle RLDocument4 pagesExercices Corrigés: Le Dipôle RLحميد خلفاوي83% (6)
- Les Ondes Mécaniques Progressives N1 - À Distance - Prof OthmaneDocument9 pagesLes Ondes Mécaniques Progressives N1 - À Distance - Prof Othmaneanass0% (1)
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Suivis SM Biof PDFDocument8 pagesSuivis SM Biof PDFEL Omrani Said100% (2)
- 7-Equilibre D'un Solide en Rotation Autour D'un Axe FixeDocument7 pages7-Equilibre D'un Solide en Rotation Autour D'un Axe FixeMed Elyoubi83% (6)
- Esetec Froid GEE Diapos 1A PhysiqueDocument219 pagesEsetec Froid GEE Diapos 1A Physiquekouame guillaume kouadioPas encore d'évaluation
- Devoir 1 Modele 3 Physique Chimie 2 Bac SM Semestre 1Document4 pagesDevoir 1 Modele 3 Physique Chimie 2 Bac SM Semestre 1Omar Erraji33% (3)
- Exercices 2 Les Lois de NewtonDocument1 pageExercices 2 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (5)
- Série D'exercices 1 - Les OndesDocument6 pagesSérie D'exercices 1 - Les OndesMohamed Elouakil100% (1)
- Cours Physique-Chimie 1bac BIOF .S1Document47 pagesCours Physique-Chimie 1bac BIOF .S1الغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Serie-Onde Mécanique ProgressiveDocument4 pagesSerie-Onde Mécanique ProgressiveBarhoumi MouradPas encore d'évaluation
- Devoir N 1SII 2021 Bac BiofDocument4 pagesDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Série 2 2 Bac SMDocument3 pagesSérie 2 2 Bac SMYns Frakchi92% (12)
- Série D'exercices N°14 - Physique La Diffraction - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°14 - Physique La Diffraction - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineAfef Afef0% (1)
- 11 - RFD - Rotation PoulieDocument2 pages11 - RFD - Rotation PoulieHousseini Dan Bouzoua100% (2)
- OndesDocument4 pagesOndesBelgasem AsselPas encore d'évaluation
- Série D'exercices Corrigés Dipole RL 2ème A Bac p.SBIRO Abdelkrim (WWW - Pc1.ma)Document15 pagesSérie D'exercices Corrigés Dipole RL 2ème A Bac p.SBIRO Abdelkrim (WWW - Pc1.ma)moustapha00100% (3)
- Dipole RL Exercices Non Corriges 4 2Document5 pagesDipole RL Exercices Non Corriges 4 2Marouane Zakir100% (1)
- Ds 1 Sem 1 Univup SC Math 2021 2022Document6 pagesDs 1 Sem 1 Univup SC Math 2021 2022khalid el yacoubi100% (1)
- Ondes-Exercices Prof - Hadjyne (WWW - Pc1.ma)Document4 pagesOndes-Exercices Prof - Hadjyne (WWW - Pc1.ma)Med Brini100% (1)
- Devoir Surveillé N°1 - Physique Et Chimie - 1BAC BIOF - Dr. Karam OuharouDocument3 pagesDevoir Surveillé N°1 - Physique Et Chimie - 1BAC BIOF - Dr. Karam Ouharouأكاديمية التأكدم - Taakdom Academy100% (1)
- 1bac SX-SM L'energie Electrique Cours ExercicesDocument12 pages1bac SX-SM L'energie Electrique Cours ExercicesAmine AlaoUii Alaoui50% (2)
- Série D'exercices 6, Dipôle RC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID PDFDocument9 pagesSérie D'exercices 6, Dipôle RC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID PDFFadwa KouhraPas encore d'évaluation
- Série de Préparation Suivi D'une Transformation Chimique PDFDocument4 pagesSérie de Préparation Suivi D'une Transformation Chimique PDFSaid Ha70% (10)
- Serie Onde Lumineuse PDFDocument2 pagesSerie Onde Lumineuse PDFAli Daoudi67% (3)
- Cours Chimie 1BACDocument43 pagesCours Chimie 1BACالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Devoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDocument8 pagesDevoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDadati Sou80% (5)
- Exercices 3 Dipôle RC Non CorrigeDocument7 pagesExercices 3 Dipôle RC Non CorrigeIsmail Aboutabit0% (1)
- Cours 5 Pr. Hicham Mahajar Pr. Youssef Tabit 2Document6 pagesCours 5 Pr. Hicham Mahajar Pr. Youssef Tabit 2الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Activité 1: Charge Et Décharge D'un Condensateur: ExploitationDocument5 pagesActivité 1: Charge Et Décharge D'un Condensateur: ExploitationFATIMA fatiii100% (2)
- Série 1 - Les Réactions D'oxydo-RéductionsDocument20 pagesSérie 1 - Les Réactions D'oxydo-RéductionsMed Amine Hattaki100% (3)
- Série de Révision (++corrigé) N°11 ..Spectres Atomiques PDFDocument7 pagesSérie de Révision (++corrigé) N°11 ..Spectres Atomiques PDFMoufida Zouaghi100% (2)
- Cours - Physique - Spectre Atomique - Bac Sciences Exp (2019-2020) MR Barhoumi MouradDocument14 pagesCours - Physique - Spectre Atomique - Bac Sciences Exp (2019-2020) MR Barhoumi MouradBassouma Khmas86% (7)
- 1er DS - 2bsmbiof-2018-2019Document3 pages1er DS - 2bsmbiof-2018-2019khalid71% (7)
- BIOF-Suivi Temporel D'une Transformation Et Vites 2018-ChajraouiDocument6 pagesBIOF-Suivi Temporel D'une Transformation Et Vites 2018-ChajraouiChajraouiAhmed50% (2)
- OMPPBIOFDocument3 pagesOMPPBIOFYassir Ksakass25% (4)
- Exercice 9 Suivi Temporel Dune Transformation ChimiqueDocument1 pageExercice 9 Suivi Temporel Dune Transformation ChimiqueCatuk Ella100% (2)
- Série D'exercices N°1 - Sciences Physiques Champ Électrique - L'oxydoréduction - 3ème Sciences Exp (2011-2012) MR Adam BoualiDocument2 pagesSérie D'exercices N°1 - Sciences Physiques Champ Électrique - L'oxydoréduction - 3ème Sciences Exp (2011-2012) MR Adam BoualiSou Yakoub100% (2)
- Contrôle 25Document3 pagesContrôle 25nabla199100% (1)
- Série D'exercices 14, Mouvements Plans, 2BAC BIOF, SM, SP Et SVT, PR JENKAL RACHIDDocument4 pagesSérie D'exercices 14, Mouvements Plans, 2BAC BIOF, SM, SP Et SVT, PR JENKAL RACHIDNajimou Alade Tidjani100% (4)
- Série D'exercice RLC ForcéDocument5 pagesSérie D'exercice RLC ForcéAdam Chabchoub100% (7)
- Examens de MécaniqueDocument18 pagesExamens de MécaniqueAicha DaouPas encore d'évaluation
- Devoir 1 Arsalan 2SM BIOF 2019 2020Document4 pagesDevoir 1 Arsalan 2SM BIOF 2019 2020khalid el yacoubi100% (5)
- Induction Magn PDFDocument5 pagesInduction Magn PDFd'ALMEIDA100% (1)
- C1Phy Ondes Mecaniques ProgressivesDocument2 pagesC1Phy Ondes Mecaniques Progressiveskarimzid100% (1)
- TP Esterification 2015Document2 pagesTP Esterification 2015Daghsni Said100% (8)
- Chap. 2 Ondes Mécaniques Progressives Périodiques - CopieDocument7 pagesChap. 2 Ondes Mécaniques Progressives Périodiques - Copiemohamed laghribPas encore d'évaluation
- Série Détermination de La Quantité de Matière Conductance PDFDocument3 pagesSérie Détermination de La Quantité de Matière Conductance PDFZiad_tiz100% (2)
- Ultrasons MétalDocument4 pagesUltrasons MétalAicha Daou100% (6)
- Serie N°1 Les Reactions D OxydoreductionDocument3 pagesSerie N°1 Les Reactions D OxydoreductionMahmoud Essahbi Sahbi Daghsni100% (1)
- Mesure de La ConductanceDocument1 pageMesure de La Conductancemarouane100% (1)
- 5 Exercice Mesure de La Conductance 2Document1 page5 Exercice Mesure de La Conductance 2younesebahsayinPas encore d'évaluation
- Chemie 1Document1 pageChemie 1Jose YoussefPas encore d'évaluation
- Cours & Exercices Mesure de Quantités de Matière Par ConductimétrieDocument6 pagesCours & Exercices Mesure de Quantités de Matière Par ConductimétrieAmine AlaoUii AlaouiPas encore d'évaluation
- Travaux Diriges de La Serie 1Document1 pageTravaux Diriges de La Serie 1alamranimalika7Pas encore d'évaluation
- S4 - Conductance Et Conductivité - 1BAC - IntDocument5 pagesS4 - Conductance Et Conductivité - 1BAC - Intchakourali67Pas encore d'évaluation
- Physique 1 Et 2-Fi12999646Document58 pagesPhysique 1 Et 2-Fi12999646الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Alcootest Et Oxydoreduction, Exercice de Chimie - 232424Document3 pagesAlcootest Et Oxydoreduction, Exercice de Chimie - 232424الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Travail Et Energie Cinetique Cours 2Document9 pagesTravail Et Energie Cinetique Cours 2Smove Oner100% (1)
- 2005 Antilles Spe Sujet Exo3 ModulationDocument2 pages2005 Antilles Spe Sujet Exo3 Modulationالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exos OMP CorrigesDocument6 pagesExos OMP Corrigesالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Mouvement Particule Chargée MagnétiqueDocument6 pagesMouvement Particule Chargée Magnétiqueالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 8 ChutesDocument1 page8 Chutesالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Devoir Surveillé de Physique NucléaireDocument2 pagesDevoir Surveillé de Physique Nucléaireالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- C6 La Pile ElectrochimiqueDocument7 pagesC6 La Pile ElectrochimiquePecorellaPas encore d'évaluation
- Devoir SurveilléDocument3 pagesDevoir Surveilléالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Serie 10 Lois de Newton FBDocument5 pagesSerie 10 Lois de Newton FBالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Correction de Devoir SurveilléDocument2 pagesCorrection de Devoir Surveilléالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercice Détermination de La Viscosité D'une Huile MoteurDocument3 pagesExercice Détermination de La Viscosité D'une Huile Moteurالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chapitre3-Exercice Cinematique Dynamique NewtonDocument8 pagesChapitre3-Exercice Cinematique Dynamique Newtonالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Question Discussion Réponse: LimiteDocument19 pagesQuestion Discussion Réponse: Limiteالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chapitre 11 Les Lois de NewtonDocument12 pagesChapitre 11 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Terminales S Devoir Surveillé de Physique Chimie N°1 2h 22 09 2015Document3 pagesTerminales S Devoir Surveillé de Physique Chimie N°1 2h 22 09 2015الغزيزال الحسن EL GHZIZAL Hassane100% (1)
- 2007 Reunion Exo2 Sujet Meca Trebuchet 5 5ptsDocument3 pages2007 Reunion Exo2 Sujet Meca Trebuchet 5 5ptsالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- 2006 11 NelleCaledonie Exo3 Correction RLC 4ptsDocument3 pages2006 11 NelleCaledonie Exo3 Correction RLC 4ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chapitre 4 S3Document11 pagesChapitre 4 S3HAMZA LAMSALAHPas encore d'évaluation
- Hydrochimie Qualité de EauxDocument29 pagesHydrochimie Qualité de EauxabderrahimnPas encore d'évaluation
- Rapport de TP ThermoDocument6 pagesRapport de TP ThermoHamza YahyaouiPas encore d'évaluation
- Equilibres Liquide - Vapeur (USTHB) (1) L3, Thermo Equilibres 2024 OKDocument48 pagesEquilibres Liquide - Vapeur (USTHB) (1) L3, Thermo Equilibres 2024 OKbrahkolmPas encore d'évaluation
- Mines Ponts MP 2012 Chimie CorrigeDocument5 pagesMines Ponts MP 2012 Chimie CorrigeMajda hajjiPas encore d'évaluation
- Colonnes À GarnissageDocument18 pagesColonnes À GarnissageMehdi BekhechiPas encore d'évaluation
- TD 5 Mipc 2020Document2 pagesTD 5 Mipc 2020HEBATONPas encore d'évaluation
- 2 Cours 1 C (Un Modèle de L'atome)Document4 pages2 Cours 1 C (Un Modèle de L'atome)Mehdi KHPas encore d'évaluation
- Vanille CorrigéDocument4 pagesVanille CorrigéMeriem SmadhiPas encore d'évaluation
- OxydoréductionDocument2 pagesOxydoréductionBalPas encore d'évaluation
- Méthodes de Prévention Et Lutte Contre La CorrosionDocument101 pagesMéthodes de Prévention Et Lutte Contre La CorrosionHatim GoldyPas encore d'évaluation
- 9 Dev Syn 1 Corr Bac Maths DevoiiratnetDocument87 pages9 Dev Syn 1 Corr Bac Maths DevoiiratnetwahibabenyahyaPas encore d'évaluation
- Pheno Transport PDFDocument53 pagesPheno Transport PDFLACMAGO TSOPKEING CEDRICPas encore d'évaluation
- Registre Global QcpsDocument55 pagesRegistre Global QcpsMak BZPas encore d'évaluation
- Fascicule Chimie ts2Document16 pagesFascicule Chimie ts2dembele9242Pas encore d'évaluation
- COURS 1 Diagramme de PhasesDocument7 pagesCOURS 1 Diagramme de Phasesslimane taleb bahmedPas encore d'évaluation
- Cours 1 GeochimieDocument24 pagesCours 1 GeochimieDjamel RihiaPas encore d'évaluation
- J Crci 2007 04 003Document8 pagesJ Crci 2007 04 003AMIR DHAOUADIPas encore d'évaluation
- Examens Avec Corrections de Physique Du SolideDocument27 pagesExamens Avec Corrections de Physique Du Solidedybala dybalaPas encore d'évaluation
- Mécanique Des Fluides Tome 1 Bases (Chapitres 1 À 7) (Laurent Jacquin)Document397 pagesMécanique Des Fluides Tome 1 Bases (Chapitres 1 À 7) (Laurent Jacquin)PENANTPas encore d'évaluation
- MP 11Document11 pagesMP 11Dji RzgPas encore d'évaluation
- Série 7, CorrectionDocument4 pagesSérie 7, Correctionhéma tologie100% (1)
- Grille Vierge CTADocument2 pagesGrille Vierge CTAayoubPas encore d'évaluation
- MemoireDocument60 pagesMemoireImen InesPas encore d'évaluation
- Activité 1 Cours ''La Respiration Chez Les Êtres Vivants''Document1 pageActivité 1 Cours ''La Respiration Chez Les Êtres Vivants''Salma GasmiPas encore d'évaluation
- Atome Et Molécule - PDF 9750Document2 pagesAtome Et Molécule - PDF 9750Issa GoudievPas encore d'évaluation
- Cour de Spectrosopie Infra RougeDocument75 pagesCour de Spectrosopie Infra RougeNabaoui Rachid50% (2)
- Exercices PC 2bac SP International FR 13 3Document16 pagesExercices PC 2bac SP International FR 13 3Jou Physique100% (2)