Académique Documents
Professionnel Documents
Culture Documents
Vanille Corrigé
Transféré par
Meriem SmadhiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Vanille Corrigé
Transféré par
Meriem SmadhiDroits d'auteur :
Formats disponibles
L’arôme de vanille - Corrigé
1. A propos de la molécule de vanilline.
1.1. Noms de deux des groupes caractéristiques.1pt Groupe hydroxyle
OH
O
Groupe carbonyle
O
1.2. Formule brute et formule semi-développée.0,5pt C8H8O3
2. Dosage spectrophotométrique de la vanilline contenue dans un extrait de vanille acheté
dans le commerce.
2.1. Protocole expérimental détaillé permettant de préparer la solution S4 à partir de la solution
S0.1,25pt
Au cours de la dilution, la quantité de matière prélevée en vanilline n reste constante :
- dans le prélèvement de solution mère S0 : n= C0 × V0p
- dans la solution diluée S4 : n= C4 × V 4
C4 × V 4 V4
Ainsi C0 × V0p=C4 × V4 puis V0p = et numériquement V0p =
C0 5
Pour préparer un volume V4 = 100 mL de solution S4, il faut donc prélever un volume V0p = 20 mL
de solution S0.
- A l’aide d’une pipette jaugée de 20 mL, munie d’une poire à pipeter, prélever 20,0 mL de
solution S0 préalablement versée dans un bécher.
- Introduire le prélèvement dans une fiole jaugée de 100 mL contenant un fond de solution
aqueuse d’hydroxyde de sodium. Homogénéiser.
- Compléter jusqu’au trait de jauge avec la solution aqueuse d’hydroxyde de sodium.
- Boucher et homogénéiser la solution.
2.2. Indication sur le schéma du nom de l’instrument de verrerie utilisée et de la position de la
vanilline en fin d’extraction.0,75pt
Voir feuille annexe.
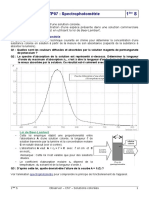
2.3. Le spectre UV-visible de l’ion phénolate est donné ci-dessous :
2.3.1. Domaine d’absorption de l’ion phénolate.0,5pt
Le spectre d’absorption de l’ion phénolate montre que ce dernier absorbe les
rayonnement dont les longueurs d’onde sont comprises entre 280 nm et 380 nm avec un
maximum d’absorption vers 350 nm.
Le domaine visible étant compris entre 400 nm et 800 nm, on en conclut que l’ion
phénolate n’absorbe pas dans le visible.
2.3.2. Couleur des solutions basiques de vanilline.0,5pt
La molécule de vanilline et l’ion phénolate ne possèdent que 4 liaisons conjuguées.
Les solutions basiques de vanilline sont donc incolores.
2.4.1. Tracer de la courbe d’étalonnage A = f(C). 1pt Voir feuille annexe.
2.4.2. Pourquoi la loi de Beer-Lambert s’énonce sous la forme A = k×C ?0,5pt
- La loi de Beer-Lambert précise que pour les solutions diluées, l’absorbance est
proportionnelle à la concentration. Mathématiquement, A = k×C.
- La représentation graphique A = f(C) montre une droite passant par l’origine du repère, ce
qui traduit que A est proportionnelle à C et A = k×C.
2.5. Détermination graphique de la concentration en vanilline de la solution à doser.0,5pt
Graphiquement, pour A = 0,88, on obtient C = 3,25×10-5 mol.L-1.
2.6. Détermination la concentration en g.L-1 de vanilline dans l’échantillon commercial.1pt
Soit Cm la concentration massique de la vanilline dans la solution de volume V = 250 mL obtenue
après traitement de V0 = 1,0 mL de vanille liquide du commerce de concentration massique Cm0.
C m ×V
On a alors Cm0 × V 0 = Cm ×V , d’où Cm0 =
V0
De plus, Cm = C×Mvanilline
C×M vanilline ×V
Ainsi Cm0 =
V0
-5
3,25×10 ×152×250 -1
Numériquement, Cm0 = =1,2 g. L
1
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- 2016 11 NelleCaledo Exo1 Sujet Vanille 9ptsDocument4 pages2016 11 NelleCaledo Exo1 Sujet Vanille 9ptsDana TRABELSIPas encore d'évaluation
- 2013 Asie Exo3 Sujet Vanille 5ptsDocument4 pages2013 Asie Exo3 Sujet Vanille 5ptsthefalseboy23Pas encore d'évaluation
- 2022 CentresEtrangers2 J2 ExoA Sujet VanilleConducti 5ptsDocument3 pages2022 CentresEtrangers2 J2 ExoA Sujet VanilleConducti 5ptsGENREPas encore d'évaluation
- 2016 11 NelleCaledo Exo1 Correction Vanille 9ptsDocument4 pages2016 11 NelleCaledo Exo1 Correction Vanille 9ptsDalia AmarniPas encore d'évaluation
- 1-SPE - Corrigé Évaluation N°1 - Beer-Lambert CorrigéDocument2 pages1-SPE - Corrigé Évaluation N°1 - Beer-Lambert CorrigéEugenie ToutounjiPas encore d'évaluation
- Fiche RevisionDocument4 pagesFiche Revisionmv9zrfr85xPas encore d'évaluation
- TAC TS td2 22 23Document2 pagesTAC TS td2 22 23elbakaliloubna11Pas encore d'évaluation
- UntitledDocument3 pagesUntitledmariePas encore d'évaluation
- DilutionDocument3 pagesDilutionSabah AmrPas encore d'évaluation
- Dm-Uv Ir RMNDocument9 pagesDm-Uv Ir RMNMeriem SmadhiPas encore d'évaluation
- TP3 Final-Dilution-Echelle - de - Teinte - KMnO4Document3 pagesTP3 Final-Dilution-Echelle - de - Teinte - KMnO4Francoise BERNARDPas encore d'évaluation
- Chimie TP9 ProfDocument2 pagesChimie TP9 ProfSafa MakhloufPas encore d'évaluation
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- CaféineDocument4 pagesCaféineNadia Ait AhmedPas encore d'évaluation
- Serie Acides Forts Et Bases FortesDocument2 pagesSerie Acides Forts Et Bases Fortesawa96213Pas encore d'évaluation
- Exercices Solutions Dilutionscor PDFDocument4 pagesExercices Solutions Dilutionscor PDFans1390Pas encore d'évaluation
- 2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsDocument4 pages2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsClémentine TakumiPas encore d'évaluation
- HCL tp3Document5 pagesHCL tp3Ouu SsaamaPas encore d'évaluation
- Wa0036Document5 pagesWa0036Abdo El MhatPas encore d'évaluation
- Objectif Bac2Document4 pagesObjectif Bac2Face2 BriochePas encore d'évaluation
- 201704071220521Document6 pages201704071220521paixdedieu90Pas encore d'évaluation
- Ds Destop CorrecDocument11 pagesDs Destop CorrecDenis BurettePas encore d'évaluation
- PDF Document 36804ECC8D0E 1Document2 pagesPDF Document 36804ECC8D0E 1Mariam HoyekPas encore d'évaluation
- Corrigé tp06Document3 pagesCorrigé tp06lmd2009100% (11)
- TP 3 PDFDocument3 pagesTP 3 PDFBouchra BkhtmPas encore d'évaluation
- Devoir 1 (2h)Document5 pagesDevoir 1 (2h)guigui farmeurPas encore d'évaluation
- 07 Titrage PH Vinaigre CorrectionDocument4 pages07 Titrage PH Vinaigre CorrectionSamantha Farah100% (1)
- TP Dakin Prepa (ML2011) PDFDocument3 pagesTP Dakin Prepa (ML2011) PDFMelania MelaniaPas encore d'évaluation
- DilutionDocument5 pagesDilutionyves marcèl rabePas encore d'évaluation
- 2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsDocument3 pages2015-Pondichery-Exo1-Correction-Vitamine C-9 Ptsanasdiouri2020Pas encore d'évaluation
- Vinaigre CondDocument2 pagesVinaigre CondجعدبندرهمPas encore d'évaluation
- AspirineDocument3 pagesAspirinemariem outahmiditPas encore d'évaluation
- Rappot 11 15Document5 pagesRappot 11 15Abdelghani MakkaouiPas encore d'évaluation
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArPas encore d'évaluation
- TD Master BiopharmacieDocument17 pagesTD Master BiopharmacieIbrahim KAMBAPas encore d'évaluation
- 07 Titrage PH Vinaigre CorrectionDocument4 pages07 Titrage PH Vinaigre CorrectionChartier Julien86% (7)
- TPDocument5 pagesTPمحمد ضياء الحقPas encore d'évaluation
- Ex Chap1 CorrectionDocument13 pagesEx Chap1 CorrectionFabrice hsuPas encore d'évaluation
- Coef Partage ExosDocument3 pagesCoef Partage ExosEF YoPas encore d'évaluation
- Compte Rendu TP 3 ÉlectrochimieDocument9 pagesCompte Rendu TP 3 ÉlectrochimieAbdessemed Shiraz NadaPas encore d'évaluation
- 2022 CtresEtrangers1 J2 Exo1 Sujet AcideFormique 10ptsDocument5 pages2022 CtresEtrangers1 J2 Exo1 Sujet AcideFormique 10ptsgrajzgrPas encore d'évaluation
- Fiches Exercices Titrages-2010Document3 pagesFiches Exercices Titrages-2010Daniel Parnor100% (1)
- 07 - Titrage PH VinaigreDocument3 pages07 - Titrage PH VinaigreChartier Julien50% (2)
- Solution Tp2 Coefficient de PartageDocument12 pagesSolution Tp2 Coefficient de PartageOmair0% (1)
- TP n5 Le Vin BlancDocument9 pagesTP n5 Le Vin BlancsumaleePas encore d'évaluation
- tp18 Dosage Phmetrique Aspirine PDFDocument3 pagestp18 Dosage Phmetrique Aspirine PDFČhîmïî Štā100% (1)
- TP Dosage Dakin CorrectionDocument3 pagesTP Dosage Dakin CorrectionŚà Ĺãh ĎķłPas encore d'évaluation
- (Mesure Du Diamètre D'un Atome) : TP N°2: Calculs D'incertitudesDocument5 pages(Mesure Du Diamètre D'un Atome) : TP N°2: Calculs D'incertitudessoufiane soufPas encore d'évaluation
- Fe2+ PDF IdentificationDocument9 pagesFe2+ PDF IdentificationAli BoutaharPas encore d'évaluation
- Rhaoui AbdoDocument9 pagesRhaoui AbdoAli BoutaharPas encore d'évaluation
- TP Adsorption Solide LiqDocument13 pagesTP Adsorption Solide LiqEmna LahmarPas encore d'évaluation
- Wahab Diop-CHIMIE 3e-Lsll PDFDocument16 pagesWahab Diop-CHIMIE 3e-Lsll PDFlhajji0% (1)
- Cours Complet ChimieDocument7 pagesCours Complet ChimieJacksonPas encore d'évaluation
- Savon TPDocument12 pagesSavon TPFatima Yahia75% (4)
- Examen SV FR Chimie 2010 1 PDFDocument4 pagesExamen SV FR Chimie 2010 1 PDFbettitPas encore d'évaluation
- CHAPITRE II Nomenclature Des Polymères 2Document18 pagesCHAPITRE II Nomenclature Des Polymères 2chouaib.y22100% (1)
- 1 HyogromètrieDocument6 pages1 HyogromètrieMeryem FaddalPas encore d'évaluation
- S 4-5 Propriétés MécaniquesDocument13 pagesS 4-5 Propriétés Mécaniquesnkpebe aliPas encore d'évaluation
- Risque ChimiqueDocument18 pagesRisque ChimiqueHakim YahiaouiPas encore d'évaluation
- STRUCTURE DES MATERIAUX - Cours 6Document33 pagesSTRUCTURE DES MATERIAUX - Cours 6Aug Nels Mathieu AnvouliPas encore d'évaluation
- Rapport de Stage Sur SnepDocument8 pagesRapport de Stage Sur SnepSaid YT100% (1)
- THESE - Rim - KARBOUJ 28 05 2008 V FinaleDocument293 pagesTHESE - Rim - KARBOUJ 28 05 2008 V FinaleLatrechePas encore d'évaluation
- Mélanie PHILIPPE PC Année 2018-2019Document43 pagesMélanie PHILIPPE PC Année 2018-2019Manal abidPas encore d'évaluation
- Chapitre 3-Réactions Diastéréosélectives (Substrats Chiraux)Document14 pagesChapitre 3-Réactions Diastéréosélectives (Substrats Chiraux)Mériem BradaiPas encore d'évaluation
- Saccharose Fructose Glucose R F Rence K-SUFRG Version 12-12Document18 pagesSaccharose Fructose Glucose R F Rence K-SUFRG Version 12-12BARMBAYE PENA GANGWONPas encore d'évaluation
- Corrige Yd2 ChimieDocument5 pagesCorrige Yd2 Chimieelmaliky.ibtissamPas encore d'évaluation
- Cours Chimie Organique Pour Physicien PDFDocument169 pagesCours Chimie Organique Pour Physicien PDFArsène KekpenaPas encore d'évaluation
- Fiche Technique Ads 80 FR 30Document1 pageFiche Technique Ads 80 FR 30salmane ouled elhoumPas encore d'évaluation
- 4 Eaux de Distribution - Traitements UnitairesDocument23 pages4 Eaux de Distribution - Traitements UnitairessalvadorPas encore d'évaluation
- Chapitre 6 Acides-BasesDocument50 pagesChapitre 6 Acides-BasesMo DicPas encore d'évaluation
- Fullerènes Et NanotubesDocument16 pagesFullerènes Et Nanotubesmouad.nuissePas encore d'évaluation
- A - Devoir de Préparation Au DS 3 - ÉnoncéDocument5 pagesA - Devoir de Préparation Au DS 3 - Énoncéhedidbz38Pas encore d'évaluation
- BELLEVILLEDocument20 pagesBELLEVILLEwalid OUNISPas encore d'évaluation
- NM 10.1.005Document133 pagesNM 10.1.005Oumaima AmalouPas encore d'évaluation
- T.4 - Deuxième Principe de La ThermodynamiqueDocument13 pagesT.4 - Deuxième Principe de La Thermodynamiqueaugustin.piraudPas encore d'évaluation
- Chapitre - 1-1 - Les Interactions Moléculaires Et Tensions Interfaciales 1 - 1 Structure de L'atomeDocument21 pagesChapitre - 1-1 - Les Interactions Moléculaires Et Tensions Interfaciales 1 - 1 Structure de L'atomeSalim ChoukchouPas encore d'évaluation
- Dosage IndirectDocument4 pagesDosage IndirectojairinePas encore d'évaluation
- Université Amar Tlidji LaghouatDocument5 pagesUniversité Amar Tlidji LaghouatDina Ben safiddinePas encore d'évaluation
- Cyto1an Mitochondrie2022aouatiDocument12 pagesCyto1an Mitochondrie2022aouatiAy ManPas encore d'évaluation
- Elevage de La Dinde de ChairDocument15 pagesElevage de La Dinde de ChairmoohiliesPas encore d'évaluation
- Nomenclature Des Alcanes - WikipédiaDocument6 pagesNomenclature Des Alcanes - WikipédialouangesiprienndoudiPas encore d'évaluation
- TD BioénergétiqueDocument14 pagesTD Bioénergétiquefawzi badi100% (2)
- Introduction Aux SP 4èmeDocument8 pagesIntroduction Aux SP 4èmeABIR AZBIRPas encore d'évaluation
- Consignes Méthodologiques Physiques de La 4ième MathDocument2 pagesConsignes Méthodologiques Physiques de La 4ième Mathtouati souadPas encore d'évaluation
- Chapitre 2 EnnobDocument25 pagesChapitre 2 EnnobKarim BchirPas encore d'évaluation
- Revue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteD'EverandRevue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteÉvaluation : 3 sur 5 étoiles3/5 (3)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Vous saurez tout sur le permis: Un livre rassurant pour les maudits du volantD'EverandVous saurez tout sur le permis: Un livre rassurant pour les maudits du volantPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- L'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaD'EverandL'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Méthode H: Kit de survie scolaire - Apprendre à retenirD'EverandMéthode H: Kit de survie scolaire - Apprendre à retenirPas encore d'évaluation
- Voitures de société et mobilité durable: Diagnostic et enjeuxD'EverandVoitures de société et mobilité durable: Diagnostic et enjeuxPas encore d'évaluation
- La Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeD'EverandLa Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Guide pratique comment maigrir sans régime et sans sport, perdre du poids rapidement et durablement Méthode simple et alimentation naturelle pour votre perte de poidsD'EverandGuide pratique comment maigrir sans régime et sans sport, perdre du poids rapidement et durablement Méthode simple et alimentation naturelle pour votre perte de poidsPas encore d'évaluation
- Qui parlera du loup ?: La Nature et le symbolisme maçonniqueD'EverandQui parlera du loup ?: La Nature et le symbolisme maçonniquePas encore d'évaluation
- Chromatographie: Les Grands Articles d'UniversalisD'EverandChromatographie: Les Grands Articles d'UniversalisPas encore d'évaluation
- Le CODE DE DIEU: Le secret de notre passé, la promesse de notre avenirD'EverandLe CODE DE DIEU: Le secret de notre passé, la promesse de notre avenirÉvaluation : 4 sur 5 étoiles4/5 (23)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation