Académique Documents
Professionnel Documents
Culture Documents
Série piles-2BAC-SM
Série piles-2BAC-SM
Transféré par
viper outdidTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Série piles-2BAC-SM
Série piles-2BAC-SM
Transféré par
viper outdidDroits d'auteur :
Formats disponibles
2BAC-SM les transformations spontanées dans les piles et production d’énergie Pr :M.
ergie Pr :M.MIARA 2BAC-SM les transformations spontanées dans les piles et production d’énergie Pr :M.MIARA
Exercice N°1 :
On réalise la pile Aluminium-Zinc en plongeant une plaque d’aluminium dans un bécher contenant un volume Exercice N°3 :
V=100mL d’une solution aqueuse de chlorure d’aluminium (Al 3+(aq) + 3Cl-(aq)) de concentration molaire initiale On étudie la pile plomb-fer qui fait intervenir les deux couples Ox/réd : Pb2+(aq)/Pb(s) et Fe2+(aq)/Fe(s).
C=[ Al3+ ]0=4,5.10-2mol/L et une plaque de zinc dans un autre bécher contenant un volume V=100mL d’une On la constitue de deux compartiments liés par un pont salin.
solution aqueuse de sulfate de zinc(Zn2+(aq)+SO4 2-(aq)) de concentration molaire initiale [Zn2+] =C . On relie les Le premier compartiment est constitué d’une lame de plomb plongé dans un volume V=100mL d’une solution
deux solutions par un pont salin constituant une solution gélifiée de chlorure d’ammonium (NH 4+(aq)+ CL-(aq) ) et aqueuse de nitrate de plombe (Pb 2+(aq)+2NO3-(aq)) de concentration molaire initiale [P + ]i=1mmol.L-1 . Le
on monte entre les pôles de la pile, un conducteur ohmique (D) ,un ampèremètre et un interrupteur k deuxième compartiment est constitué d’une lame de fer plongée dans un volume V=100mL d’une solution
+]
Données : aqueuse de chlorure de fer (II) (Fe 2+(aq)+2Cl-(aq)) de concentration [ -1
i=40mmol.L . la partie immergée de la
lame de fer dans la solution est en excès.
-La masse de la partie de la plaque d’aluminium immergée dans la solution de chlorured’aluminium, a l’instant
Données ;
de la fermeture du circuit, est m0=1,35g .
Le Faraday : 1F=9,65.104C.mol -1 ; Masse molaire de plomb : M(Pb)=207g.mol-1
-Les masses molaire : M(Al)=27g.mol -1 ; M(Zn)=65,4 g.mol-1 On monte en série avec la pile un conducteur ohmique (D), un ampèremètre (A) et un interrupteur K. A un
- 4
La constante de Faraday :1F=9,65.10 C/mol . instant de date t0=0, on ferme le circuit, l’ampèremètre indique alors le passage d’un courant électrique
La constante d’équilibre associée à la réaction est K=1090 à 25C d’intensité I0=2mA.
2Al(s)+ 3Zn 2+(aq) 2Al3+(aq) + 3Zn(s) Au cours du fonctionnement de la pile, la masse de la lame de plomb a augmenté de 1,8 mg après une durée de
On ferme l’interrupteur k à l’instant t0 =0 ; un courant fonctionnement t=t1-t0
d’intensité considérée constante : I=20mA circule dans le circuit . 1-Ecrire l’équation bilan lors du fonctionnement de la pile ?
1-Calculer le quotient de réaction Qri à l’état initial et en déduire 2-Faire un schéma annoté de la pile ?
3-Donner le schéma conventionnel de cette pile ?
le sens d’évolution spontanée du système chimique ?
4-Déterliner la variation de la concentration des ions Pb 2+(aq) et Fe2+(aq) au bout de la durée Dt.
2- Écrire les demi-équations des réactions se produisant aux électrodes ? 5-Déterminer à l’instant t1 le quotient de réaction Qr,t lors du fonctionnement de la pile.
3-Déduire la polarité de la pile ? 6-Déterminer la valeur de t 1 ?
4- Donner le schéma conventionnel de cette pile ? Exercice N°4 :
5-Représenter sur le montage expérimental le sens de déplacement les porteurs des charge et le sens On réalise la pile Cuivre – Aluminium en reliant deux demi- piles par un pont
conventionnelle du courant ? salin de chlorure d’ammonium .
6-Trouver, lorsque la pile fonctionne une durée ∆t=1h : La première demi- pile est constituée
6-1-La concentration des ions aluminium dans la solution de chlorure d’aluminium ? d’une lame de cuivre partiellement immergée
6-2-Calculer la variation de la masse Δm(Al) de l’électrode d’aluminium. dans une solution aqueuse de sulfate de
cuivre II (Cu 2+(aq) +SO42-(aq)) de concentration C0
6-3-Calculer la masse du dépôt de Zinc ? et de volume V = 50 mL .
Exercice N°2 : La deuxième demi-pile est constituée d’une
Considérons la pile cuivre-argent (Cu-Ag) constituée de : lame d’aluminium partiellement immergée
Un bécher contenant un volume V1=50mL de solution de nitrate d’argent (Ag+ + No3-) de dans une solution aqueuse de chlorure
concentration C1=0,1mol.L-1 . d’aluminium (Al 3+(aq) + 3Cl-(aq) ) de même
concentration C 0 et de même volume V
Un bécher contenant un volume V2=100mL de solution de nitrate de cuivre (Cu2++ 2No3-)de On branche entre les pôles de la pile un conducteur Ohmique (D),
concentration C2=0,05mol.L-1 . un ampèremètre et un
Une lame de cuivre de masse m1=1g plongée dans la solution de nitrate de cuivre . interrupteur K (figure1).
Une lame d’argent de masse m2=2g plongée dans la solution de nitrate d’argent . A l’instant t0=0 on ferme le circuit, un courant électrique
d’intensité constante I circule alors dans le circuit.
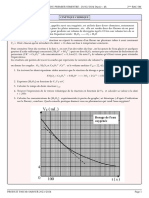
Un pont salin contenant une solution saturée de nitrate de potassium (K+ + NO3-). La courbe de la figure2 représente la variation de
Données : F=96500C/mol ; M(Cu)=63,5g/mol ; M(Ag)=108g/mol la concentration [Cu 2+] des ions cuivre II en fonction du temps .
La réaction associé à cette pile est : 2ag+(aq) + Cu(s) Données :
-La constante d’équilibre associée à cette réaction : K=2,2.1015 Le Faraday : 1F=96500C.mol -1 :
1-Déterminer le sens d’évolution spontané de cette transformation ?. Masse molaire d’aluminium : M(Al)=27g.mol -1
On donne K=10-20 La constante d’équilibre associé
2-Faire un schéma annoté de la pile ?
à l’équation de la réaction suivante :
3-Ecrire les deux demi-équations d’oxydo-réduction ayant lieu au niveau de chaque électrode ? 3Cu(s) + 2Al3+(aq) 3Cu2+(aq) + 2Al (s)
4-Donner le schéma conventionnel de cette pile ? 1-déterminer le sens d’évolution du système chimique.
5-Quel est le rôle du pont salin ? 2-Donner la représentation conventionnelle de la pile étudiée.
6-On laisse fonctionner le système pendant une durée suffisamment longue pour que la pilene débite plus de 3-Exprimer la concentration [Cu 2+]t à un instant t en
courant électrique. fonction de t , C0 , I , V et F.
6-1- Construire le tableau d’avancement de cette réaction .Trouver la valeur de X m ? 4-déduire la valeur de l’intensité Idu courant.
6-2-Sachant que la pile débite un courant d’intensité I=10mA, Calculer la durée de fonctionnement 5-La pile est entièrement usée à une date t c . Trouver l’expression de la variation Dm de la masse du lame
de cette pile Δtmax ? d’aluminium lorsque la pile est entièrement usée en fonction de F, I, Dt et M(Al). Calculer Dm
6-3- Quelle est la concentration finale des ions Cu 2+ ? Exercice N°5 :
Une pile cuivre-argent : | + ‖Ag+| débite un courant d’intensité I=50mA pendant Dt=2h30min de fonctionnement.
6-4-Calculer la variation de la masse Δm de chaque électrode ? 1-Rappeler l’équation bilan de la réaction d’oxydo-réduction ayant lieu pendant le fonctionnement spontané de cette pile.
2-Calculer la quantité d’électricité Q ayant traversé le circuit pendant la durée Dt.
3-Calculer la variation de la concentration des ions Cu 2+(aq) et Ag+(aq) au bout de cette durée.
4-Déduire la variation de la masse de chaque électrode.
On donne : M(Cu)=63,5g.mol-1 ; M(Ag)=108g.mol -1.
Vous aimerez peut-être aussi
- 2-Examens BAC Nucleaire PC FRDocument4 pages2-Examens BAC Nucleaire PC FRMouad Driouch SMIA-TD4100% (1)
- Le BenzéneDocument5 pagesLe BenzéneFatima BenPas encore d'évaluation
- Pharmacologie EndodontiqueDocument9 pagesPharmacologie EndodontiqueKamalo TrissePas encore d'évaluation
- Série Transformation Forcée CorrectionDocument8 pagesSérie Transformation Forcée CorrectionAmine AlaoUii AlaouiPas encore d'évaluation
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 pagesChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounPas encore d'évaluation
- 2010 AmNord Exo1 Correction Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Correction Eau 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Exercice 1 (8 Points) Conservation de L'énergie MécaniqueDocument7 pagesExercice 1 (8 Points) Conservation de L'énergie MécaniqueAli RammalPas encore d'évaluation
- 31RS11 PDFDocument8 pages31RS11 PDFMoufida ZouaghiPas encore d'évaluation
- Exam BlanchDocument8 pagesExam Blanchاستاذك في الفيزياءPas encore d'évaluation
- Bac Blanc 2 - 2024Document8 pagesBac Blanc 2 - 2024Rania El MountassarPas encore d'évaluation
- Equilibre chimique3PCDocument3 pagesEquilibre chimique3PCKhalid AwtmPas encore d'évaluation
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pages4 Exercice Suivi D'une Transformation Chimiquenabil echerrarPas encore d'évaluation
- Devoir de Contrôle N°1 2019 2020 (MR Jawher Ben Kahla)Document4 pagesDevoir de Contrôle N°1 2019 2020 (MR Jawher Ben Kahla)sonilola100% (1)
- DEVOIR Synthese1 Bac M 2013Document5 pagesDEVOIR Synthese1 Bac M 2013Yassine Riahi100% (1)
- C1Chim Transformations Lentes Rapides Exercices PDFDocument6 pagesC1Chim Transformations Lentes Rapides Exercices PDFAzizElheniPas encore d'évaluation
- Gsa 2bac 1819 Eb2 PCF PCDocument5 pagesGsa 2bac 1819 Eb2 PCF PCHAMADA1972Pas encore d'évaluation
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- Serie de Révision15 2015 PDFDocument3 pagesSerie de Révision15 2015 PDFAzizElheniPas encore d'évaluation
- Biof Exam Blanc 09-05-2020Document9 pagesBiof Exam Blanc 09-05-2020Hajar NassilaPas encore d'évaluation
- Bac Blanc N4 BiofDocument9 pagesBac Blanc N4 BiofAnas TalhiPas encore d'évaluation
- Exercice Suivi Temporelle ChimieDocument4 pagesExercice Suivi Temporelle ChimiePhobos ElfaPas encore d'évaluation
- Controle 19 (PR Y. EL FATIMY) Partie ChimieDocument2 pagesControle 19 (PR Y. EL FATIMY) Partie Chimiecheikhna lemrabettPas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- S Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFDocument3 pagesS Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFmaanane maananePas encore d'évaluation
- Série D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienDocument2 pagesSérie D'exercices - Sciences Physiques - Equilibre Chimique - Bac Technique (2017-2018) MR Gammoudi SoufienInass LayachPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebPas encore d'évaluation
- Examen National Physique Chimie Sciences Maths 2018 Normale Sujet PDFDocument8 pagesExamen National Physique Chimie Sciences Maths 2018 Normale Sujet PDFel ghazi benrrabhiPas encore d'évaluation
- Sciencesphysiqueg1 2018sujetDocument4 pagesSciencesphysiqueg1 2018sujetThamer SaiihiPas encore d'évaluation
- Série N1 - La Décroissance RadioactiveDocument8 pagesSérie N1 - La Décroissance RadioactiveAbderrahmane El Ouafy100% (1)
- Examen National Physique Chimie SPC 2011 Rattrapage SujetDocument7 pagesExamen National Physique Chimie SPC 2011 Rattrapage SujetALHIDAYA LibrairiePas encore d'évaluation
- Controle 1 - 5 S1 PC 1bac FRDocument3 pagesControle 1 - 5 S1 PC 1bac FRbrinimed06gmail.comPas encore d'évaluation
- HTTP WWW - Ressources-Stl - FR ST Terminale ExercicesphysiDocument7 pagesHTTP WWW - Ressources-Stl - FR ST Terminale ExercicesphysiMohamed Elouakil0% (1)
- Noyau Masse Energie PDFDocument4 pagesNoyau Masse Energie PDFHadjer Jojo100% (1)
- Cours Trans Rapides Et LentesDocument5 pagesCours Trans Rapides Et Lentesboustakatb100% (1)
- 2bac BiofDocument5 pages2bac Biofbelamlouh aminePas encore d'évaluation
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Document8 pagesControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- Classification Quantitative Dosage 1S1 AT RenfDocument5 pagesClassification Quantitative Dosage 1S1 AT RenfAmath ThionganePas encore d'évaluation
- Devoir de Synthese: FerchiouDocument4 pagesDevoir de Synthese: Ferchioufethi10% (1)
- Serie RLC ForceesDocument10 pagesSerie RLC ForceesMondher Dhahri0% (1)
- Bac - Blancn°1 - SM - 2024 - MR - SABOURDocument6 pagesBac - Blancn°1 - SM - 2024 - MR - SABOURsalmakouhail40Pas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Revision 2 BiofDocument1 pageRevision 2 Biofamine ghadouiPas encore d'évaluation
- Serie 1 Avancement D'une Reaction 2021Document6 pagesSerie 1 Avancement D'une Reaction 2021ja3bek ma9rouna0% (1)
- 4e DC2 20010 2011finaleDocument4 pages4e DC2 20010 2011finalefethi1100% (1)
- Bac Math Pysh Acide Base Serie 4Document1 pageBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- Tle DDocument3 pagesTle DDaimsPas encore d'évaluation
- Control 2 Officiel 3Document5 pagesControl 2 Officiel 3salma benmiledPas encore d'évaluation
- 201702061155324Document6 pages201702061155324Ali RammalPas encore d'évaluation
- 2BAcDS1 A.ChafikiDocument2 pages2BAcDS1 A.ChafikiHayat El JamaliPas encore d'évaluation
- Applications Suivi20.21Document3 pagesApplications Suivi20.21Phobos ElfaPas encore d'évaluation
- Chapitre-7 - Transformations Spontanés Dans Les PilesDocument7 pagesChapitre-7 - Transformations Spontanés Dans Les Pilesa houssPas encore d'évaluation
- Devoir de Synthèse N°3 - Physique - Bac Math (2009-2010) MR Sayadi TaoufikDocument3 pagesDevoir de Synthèse N°3 - Physique - Bac Math (2009-2010) MR Sayadi TaoufikMohamed SaidiPas encore d'évaluation
- Transfert Dans Un Circuit ÉlectriqueDocument1 pageTransfert Dans Un Circuit ÉlectriqueNAINIAAPas encore d'évaluation
- Dev Synthese N°14scDocument6 pagesDev Synthese N°14scSahbi Mabrouki Yamen0% (1)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Ds1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Document4 pagesDs1 s1 2smbf 2020-2021 s1 Type A P.izaran (WWW - Pc1.ma)Zaid ChPas encore d'évaluation
- DS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)Document4 pagesDS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)allach mohamedPas encore d'évaluation
- 4e DS2 2008 2009Document4 pages4e DS2 2008 2009Fethi FerchiouPas encore d'évaluation
- Série Ec - RFD PlateformeDocument2 pagesSérie Ec - RFD PlateformeBakari AnisPas encore d'évaluation
- Chute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof OthmaneDocument18 pagesChute Verticale - Série N1 - Soutien À Distance (2023-2024) - Prof Othmanemohamedelhafhouf2006Pas encore d'évaluation
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Document3 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Ibtihel BoughanmiPas encore d'évaluation
- Cours Proteine 1er MasterDocument31 pagesCours Proteine 1er MasterKenz L'AïdPas encore d'évaluation
- Ae1 Extraction CorrectionDocument2 pagesAe1 Extraction CorrectionAouini IbtihelPas encore d'évaluation
- Correction DS N°1 SpécialitéDocument2 pagesCorrection DS N°1 Spécialitédavid Bentouza100% (1)
- HédioneDocument3 pagesHédionemohamedtounsi2014Pas encore d'évaluation
- SM - 211002 SM - HO - 02 - 03 - ELUX - 1 - 1 - 211002 SM - HO - 02 - 03 - ELUX - FR PrideDocument28 pagesSM - 211002 SM - HO - 02 - 03 - ELUX - 1 - 1 - 211002 SM - HO - 02 - 03 - ELUX - FR PridealbertlamottehorecafPas encore d'évaluation
- Guide de Nettoyage Et Entretien Du VerreDocument9 pagesGuide de Nettoyage Et Entretien Du VerreChristian NunezPas encore d'évaluation
- MINOUGOU Abdoul Kaled RachidDocument86 pagesMINOUGOU Abdoul Kaled RachiddanielsinkotPas encore d'évaluation
- 1ère A - APC - Les AlcanesDocument5 pages1ère A - APC - Les AlcanesLAWSON NICOLASPas encore d'évaluation
- MDC II Chi Les BétonsDocument10 pagesMDC II Chi Les BétonsNabil SifiPas encore d'évaluation
- Rapport de StageDocument7 pagesRapport de Stageabdelghani benhamoudaPas encore d'évaluation
- Etude Pesticides Sur Abricotier BPADocument16 pagesEtude Pesticides Sur Abricotier BPAFATIMA-EZZAHRA AZLANIPas encore d'évaluation
- TP MM TesDocument32 pagesTP MM TesAtayi100% (1)
- Série 4 P2 2024 - CopieDocument1 pageSérie 4 P2 2024 - CopieMARIA SERRAJPas encore d'évaluation
- Chapitre I Pharmacocinetique 2023Document89 pagesChapitre I Pharmacocinetique 2023Abderahmane KmrPas encore d'évaluation
- Suite Chapitre IIDocument14 pagesSuite Chapitre IINoir VincentPas encore d'évaluation
- Vanne de DechargeDocument8 pagesVanne de DechargeSOFIANEPas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsĀbdï FïgõPas encore d'évaluation
- Degradation PolymèreDocument5 pagesDegradation PolymèreHB RIMPas encore d'évaluation
- La Reglementation AtexDocument20 pagesLa Reglementation AtexSoltani AliPas encore d'évaluation
- Correction TP2Document3 pagesCorrection TP2Pilote Yamadjako100% (1)
- GraphismeDocument5 pagesGraphismeabidi issam eddinePas encore d'évaluation
- Systèmes Hydrauliques L1 - GIM PDFDocument45 pagesSystèmes Hydrauliques L1 - GIM PDFRahma BoufarhPas encore d'évaluation
- Essai de Multiplication Et Culture de Champignons Pleurote À Échelle Du LaboratoireDocument70 pagesEssai de Multiplication Et Culture de Champignons Pleurote À Échelle Du LaboratoireAMINEPas encore d'évaluation
- Objectifs Du Stage de Pharmacie HospitaliereDocument5 pagesObjectifs Du Stage de Pharmacie HospitaliereLolo ButyPas encore d'évaluation
- Compte Rendu de TPDocument4 pagesCompte Rendu de TPManonPas encore d'évaluation
- U 1000 RVFVDocument4 pagesU 1000 RVFVBouity MavyPas encore d'évaluation
- 08 Synthese D Especes Chimiques OrganiquesDocument4 pages08 Synthese D Especes Chimiques OrganiquesDetective-Ayoub SamiePas encore d'évaluation
- Ben Aissa BadisDocument81 pagesBen Aissa BadisIbrahim SoroPas encore d'évaluation