Académique Documents
Professionnel Documents
Culture Documents
Eau - Oxygenee. .Copie 1
Transféré par
fatimazahraTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Eau - Oxygenee. .Copie 1
Transféré par
fatimazahraDroits d'auteur :
Formats disponibles
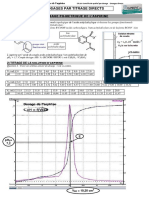
Thème : Solutions antiseptiques : L’eau oxygénée H2O2
L’eau oxygénée, antiseptique d’usage courant, est une solution de peroxyde d’hydrogène
qui se décompose très lentement à température ordinaire.
• Formule du peroxyde d’hydrogène : H2O2
Les demi-équations électroniques intervenant dans cette décomposition sont :
+
H2O2 + 2H + 2 e- = 2H2O demi-équation 1
H2O2 = O2 + 2 H+ + 2 e- demi-équation 2
• Couples oxydant / réducteur mis en jeu dans l’écriture des demi-équations :
1. H2O2 / H2O
2 O2 / H2O2
• Réaction de DISMUTATION
A partir des deux demi-équations précédentes, on écrit l’équation-bilan de LA RÉACTION
DE DISMUTATION de l’eau oxygénée :
2 H2O2 = 2 H2O + O2
4. Nom du gaz produit par la réaction de dismutation de l’eau oxygénée. Dioxygène O2
• Définition :
Le TITRE en volumes (T) d’une eau oxygénée est le volume (en litres) de dioxygène que
peut libérer 1 litre de cette solution, volume mesuré dans les conditions normales de
température et de pression (à 0°C et 1 bar).
Application : Lors de l’usage externe de l’eau oxygénée sur une peau lésée, on utilise une
solution d’eau oxygénée à 10 volumes. Le volume d’eau oxygénée à 10 volumes contenu
dans un flacon est V = 125 mL.
Déterminer le volume V(O2) de dioxygène que peut libérer la décomposition totale de cette
eau oxygénée.
Solution :
L’eau oxygénée a un TITRE (T) de 10 volumes. Donc 1 litre de cette solution peut libérer,
par décomposition totale, 10 L de dioxygène, volume mesuré (à 0°C et 1 bar)
Produit en croix : si 1L libère 10 L de O2
Alors 0,125 L libère : V02 tel que V02 = 10 . 0,125 = 1,25 L
• Relation entre le titre T d’une solution d’eau oxygénée et sa concentration C en
peroxyde d’hydrogène :
T = 11,2 x c
cette relation est propre aux solutions aqueuses de peroxyde d’hydrogène.
• leurs unités respectives. T en volumes (L) ; c en : mol/L
Application : a- Calculer alors la valeur de c pour l’eau oxygénée d’usage courant à
10 volumes. : T = 11,2 x c donne c = T / 11,2 c = 10.11,2 = 0,89 mol/L
b- Quelle quantité de matière n de peroxyde d’hydrogène est donc dissoute
dans le flacon d’eau oxygénée à 10 volumes de volume V = 125 mL ?
On cherche n, on connaît la relation c = n/ V soit n = c . V avec c en mol/L et v en L
calcul : n = 0,89 . 0,125 = 0,11 mol.
Vous aimerez peut-être aussi
- 14 TP Dilution Echelle de TeinteDocument6 pages14 TP Dilution Echelle de TeinteMATHS SCIENCESPas encore d'évaluation
- PDF JavelDocument3 pagesPDF JavelMahran BchatniaPas encore d'évaluation
- 2 Pol RefractoDocument4 pages2 Pol RefractoEssassi AmmarPas encore d'évaluation
- 2020 - Chapitre 2 - Propriétés Colligatives - Suite Et FinDocument15 pages2020 - Chapitre 2 - Propriétés Colligatives - Suite Et FinAmélie Charleene ViennotPas encore d'évaluation
- PS CMM b3 TP Dosage Du Diiode Dans La BetadineDocument7 pagesPS CMM b3 TP Dosage Du Diiode Dans La BetadinemranonimosPas encore d'évaluation
- Préparation de SolutionsDocument8 pagesPréparation de Solutionsbessama84Pas encore d'évaluation
- TP 4 InorganiqueDocument7 pagesTP 4 InorganiqueSellam AnisPas encore d'évaluation
- 2 Chapitre 1Document12 pages2 Chapitre 1salah a9aPas encore d'évaluation
- Methode de MohrDocument9 pagesMethode de MohrMoed MoedPas encore d'évaluation
- TD2 ChimieDocument3 pagesTD2 ChimieSAMIA AQNOUCHPas encore d'évaluation
- TD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. MaghchicheDocument4 pagesTD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. Maghchicheromaissa benchadiPas encore d'évaluation
- TP DissolutionDocument8 pagesTP DissolutionNadia amelPas encore d'évaluation
- TP C1. Bleu de Méthylène Dans Un Collyre: ObjectifDocument3 pagesTP C1. Bleu de Méthylène Dans Un Collyre: ObjectifRyan BoucettaPas encore d'évaluation
- Lec 15 Les PHDocument12 pagesLec 15 Les PHPierreEustachePas encore d'évaluation
- TP Chimie 1 (TP2)Document4 pagesTP Chimie 1 (TP2)mohredPas encore d'évaluation
- MANGANIMÉTRIEDocument2 pagesMANGANIMÉTRIEDiallo100% (1)
- Rapport Acide BaseDocument10 pagesRapport Acide BaseBouafia AbdelrahmanePas encore d'évaluation
- Refractometrie Et PolarimetrieDocument4 pagesRefractometrie Et PolarimetrieKpabou KpabouPas encore d'évaluation
- TS TPC13Document3 pagesTS TPC13Prince AbdooPas encore d'évaluation
- Dosage RedoxDocument13 pagesDosage RedoxLina BahazPas encore d'évaluation
- Syntheses de SaponificationDocument10 pagesSyntheses de SaponificationMoed MoedPas encore d'évaluation
- Gee L1gi Zenasni TPDocument65 pagesGee L1gi Zenasni TPSoumia SalhiPas encore d'évaluation
- Ga5 LST CA Fatima Zahra El YachiouiDocument4 pagesGa5 LST CA Fatima Zahra El YachiouiMer IemPas encore d'évaluation
- CCM CPG HPLCDocument29 pagesCCM CPG HPLCmouhkiariPas encore d'évaluation
- Polycopie TAB Cour Les SérieDocument112 pagesPolycopie TAB Cour Les SérieAmna TahriPas encore d'évaluation
- TB1TP Fiche 7 Polarimetrie PDFDocument3 pagesTB1TP Fiche 7 Polarimetrie PDFAmirou Baby MixicoPas encore d'évaluation
- Biochimie TPDocument11 pagesBiochimie TPdjeldjelli nawelPas encore d'évaluation
- Inbound 8182959602019210702Document6 pagesInbound 8182959602019210702makramPas encore d'évaluation
- ComplexometrieDocument4 pagesComplexometrieABDELALI SASSIOUIPas encore d'évaluation
- Biochimie MétaboliqueDocument225 pagesBiochimie MétaboliqueNicholPas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Extraction de La Caféine Par Méthode D'extraction Liquide-LiquideDocument6 pagesExtraction de La Caféine Par Méthode D'extraction Liquide-LiquideAbdealaziz BouhoreiraPas encore d'évaluation
- Cinétique 1Document21 pagesCinétique 1Closed WayPas encore d'évaluation
- Chapitre 3 Présentation Des Parois Fonctionnant Sous Pression InterneDocument12 pagesChapitre 3 Présentation Des Parois Fonctionnant Sous Pression Interneหำพดบ จตคสยลบPas encore d'évaluation
- TP Mesure Du PH de Solution (Elèves)Document2 pagesTP Mesure Du PH de Solution (Elèves)la physique selon le programme FrançaisPas encore d'évaluation
- 05 Oxydo-ReductionDocument3 pages05 Oxydo-ReductionSoleil AlgeriaPas encore d'évaluation
- TP Chimie 1 ChabaniDocument36 pagesTP Chimie 1 ChabaniloubnarymPas encore d'évaluation
- Dosage Du Mg.Document4 pagesDosage Du Mg.Noor Nait MerzougPas encore d'évaluation
- TP CHDocument22 pagesTP CHMadjid Ait MatenPas encore d'évaluation
- Chap6 DosageDocument4 pagesChap6 DosageThomas Libérato100% (1)
- TP L2 2022 BouraadaDocument9 pagesTP L2 2022 BouraadaHanae HanaPas encore d'évaluation
- DIFFUSIONDocument18 pagesDIFFUSIONsalimPas encore d'évaluation
- Correction DM PhysiqueDocument4 pagesCorrection DM PhysiqueClara RossoPas encore d'évaluation
- 61 CoursbeerlambertprofDocument6 pages61 CoursbeerlambertprofDanaPas encore d'évaluation
- TP sv5 Phya2 Foielave A16Document14 pagesTP sv5 Phya2 Foielave A16Kaoutar AbdoPas encore d'évaluation
- CHIMIE - COURS 1-Préparation de SolutionDocument12 pagesCHIMIE - COURS 1-Préparation de SolutionAmina BadaouiPas encore d'évaluation
- 1-Verreries: F4: Matériels de ChimieDocument14 pages1-Verreries: F4: Matériels de ChimieFd MtPas encore d'évaluation
- Dosage de Sel de MohrDocument3 pagesDosage de Sel de MohrPoké & YugiPas encore d'évaluation
- Correction TP Analyse Spectrale D'un SchtroumpfDocument3 pagesCorrection TP Analyse Spectrale D'un Schtroumpfmorgan100% (1)
- To ChimieDocument2 pagesTo Chimieazou korbaPas encore d'évaluation
- Fiche ExtractionDocument3 pagesFiche ExtractionMahrezPas encore d'évaluation
- Preparation Solution - Dilution-Tp CorrigeDocument4 pagesPreparation Solution - Dilution-Tp CorrigeAya YahiPas encore d'évaluation
- 1059 TP Doser Par ConductimetrieDocument3 pages1059 TP Doser Par ConductimetrieAli TrikiPas encore d'évaluation
- TP SulfonationDocument5 pagesTP Sulfonationiphone53131100% (1)
- TP Chimie Compte Rendu Preparation Dune SolutionDocument6 pagesTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiPas encore d'évaluation
- La Distillation FractionnéeDocument10 pagesLa Distillation FractionnéeMohamed Amine BouamranePas encore d'évaluation
- HS5 TP - Dosage - Du - Lait - FMBDocument5 pagesHS5 TP - Dosage - Du - Lait - FMBMohamed HamelPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- dm6 optionPSIcorrigeDocument7 pagesdm6 optionPSIcorrigeabderrahmane lalaouiPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- Cours Iup Me Echangeurthermique 2Document80 pagesCours Iup Me Echangeurthermique 2ridhajamel50% (2)
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- Valorisation Des Déchets Plastiques en Produits À Valeur ÉnergétiqueDocument8 pagesValorisation Des Déchets Plastiques en Produits À Valeur ÉnergétiquefatimazahraPas encore d'évaluation
- Cours Iup Me Echangeurthermique 2Document80 pagesCours Iup Me Echangeurthermique 2ridhajamel50% (2)
- PDFDocument134 pagesPDFMohandRahimPas encore d'évaluation
- Mémoire 2017 MAUP12Document58 pagesMémoire 2017 MAUP12fatimazahraPas encore d'évaluation
- Mémoire 2017 MAUP12Document58 pagesMémoire 2017 MAUP12fatimazahraPas encore d'évaluation
- F201a PDFDocument29 pagesF201a PDFfatimazahraPas encore d'évaluation
- Mémoire 2017 MAUP12Document58 pagesMémoire 2017 MAUP12fatimazahraPas encore d'évaluation
- Transfert de Masse Et de Chaleur - TD - 2007Document1 pageTransfert de Masse Et de Chaleur - TD - 2007fatimazahraPas encore d'évaluation
- Mémoire 2017 MAUP12Document58 pagesMémoire 2017 MAUP12fatimazahraPas encore d'évaluation
- Preparation Du SavonDocument7 pagesPreparation Du SavonKaffelPas encore d'évaluation
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéefatimazahraPas encore d'évaluation
- Rapport P6 2019 29Document69 pagesRapport P6 2019 29fatimazahraPas encore d'évaluation
- NAT-1reG D8ChimieSavon PDFDocument10 pagesNAT-1reG D8ChimieSavon PDFfatimazahraPas encore d'évaluation
- Exercices - Correction - Travail - Energie PDFDocument12 pagesExercices - Correction - Travail - Energie PDFfatimazahraPas encore d'évaluation
- F201a PDFDocument29 pagesF201a PDFfatimazahraPas encore d'évaluation
- F201a PDFDocument29 pagesF201a PDFfatimazahraPas encore d'évaluation
- RapportDocument12 pagesRapportfatimazahraPas encore d'évaluation
- Rapport P6 2019 29Document69 pagesRapport P6 2019 29fatimazahraPas encore d'évaluation
- F201a PDFDocument29 pagesF201a PDFfatimazahraPas encore d'évaluation
- TP - Principe de Mesure de La CMC PDFDocument4 pagesTP - Principe de Mesure de La CMC PDFfatimazahra0% (1)