Académique Documents
Professionnel Documents
Culture Documents
Suivi Par Pression 1
Transféré par
yasserofficiel20060 évaluation0% ont trouvé ce document utile (0 vote)
14 vues2 pagesTitre original
suivi-par-pression-1
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
14 vues2 pagesSuivi Par Pression 1
Transféré par
yasserofficiel2006Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
2B.S.M.O.
F/M EXERCICES SUR LE SUIVI DES REACTION CHIMIQUES
EXERCICE1
Dans un flacon de volume V0 1, 0 L , on introduit à la date t=0
-un volume V1 50mL d'une solution aqueuse du dibrome Br2( aq ) de concentration C1 2, 4.102 mol.L1
-un volume V2 50mL d'une solution d’acide méthanoïque HCOOH(aq) de concentration
C2 3.102 mol.L1 .
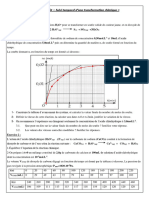
Le flacon est bouché , un manomètre mesure la pression
du gaz contenu dans le flacon.
La température est maintenue constante 304 K.
A intervalles de temps réguliers, on relève la pression
indiquée par le manomètre on obtient la courbe ci-contre.
On donne R 8,314 J .k 1.mol 1 , :
La réaction chimique peut être modélisée par l'équation
suivante : HCOOH(aq) + Br2(aq) CO2(g) + 2H(aq)
+ -
+ 2Br(aq)
1-montrer que la réaction étudiée est une réaction
d’oxydo reduction en déterminant les couples ox/red .
2-dresser le tableau d’avancement de la réaction.
3-rappeler l’équation d’état des gaz parfaits en indiquant les unités dans le système international
4-montrer que la pression dans le flacon à un instant t est donnée par P ax b en déterminant
les expressions de a et b .
dP
5-exprimer la vitesse volumique de la réaction en fonction de R , T , V0 , V1 , V2 et .
dt
6-calculer la valeur de la vitesse volumique aux instants t1 0s et t2 200s .
P0 Pmax
7-montrer que P(t1/ 2 ) . Déduire graphiquement le temps de demi-réaction.
2
EXERCICE4
Le monoxyde de carbone CO forme avec
le fer un composé de formule Fe(CO)5 ,
appelé pentacarbonylfer
A 200°C ,dans l’obscurité ,le pentacarbonylfer
gazeux subit une dissociation lente et totale
d’équation : Fe(CO)5 ( g ) Fe(s) 5CO( g )
On enferme une quantité n 0 2,06mmol de
pentacarbonylfer dans un volume invariable
V 250mL , préalablement vidé puis on porte
la température à 200°C.Soit P0 la pression
initiale à cette température.
On enregistre la pression totale P dans l’enceinte en fonction du temps et l’on obtient la courbe
à côté qui représente l’evolution de P / P0 en fonction de temps. Donnée : R 8.314 JK 1mol 1
1-calculer P0 la pression initiale.
2-Faire un tableau d’avancement .Exprimer la quantité totale de matière gazeuse en fonction de
x(t) et de n0 .
P 4x
3-En utilisant la relation des gaz parfaits montrer que 1 . calculer Pmax la pression à
P n
0 0
l’état final
d (P / P )
4- Etablir l’expression de la vitesse volumique de la réaction en fonction de 0 .
dt
5- déterminer la valeur de la vitesse volumique à la date t=20min.
6-comment varie la vitesse de la réaction au cours du temps, justifier
7-déterminer t1/2 graphiquement en justifiant la méthode utilisée.
EXERCICE3
Données : -température du laboratoire au moment de l’expérience : 25°C soit T = 298 K
-pression atmosphérique : Patm = 1,020.105 Pa -constante des gaz parfaits : R = 8,31 SI
-1
-masses molaires atomiques, en g.mol : M(C) = 12 ; M(H) = 1 ; M(O) = 16 ; M(Ca) = 40
Dans un ballon, on réalise la réaction entre le carbonate de calcium CaCO 3(s) et l’acide
chlorhydrique (H3O+(aq) + Cl–(aq)). Le dioxyde de carbone formé est recueilli par déplacement
d’eau, dans une éprouvette graduée.
on verse dans le ballon, un volume VS = 100 mL d’acide chlorhydrique à 0,1 mol.L-1. A la date t
= 0 s, et on introduit rapidement dans le ballon 2,0 g de carbonate de calcium CaCO 3(s) en
déclenche un chronomètre. On relève les valeurs du volume V CO2 de dioxyde de carbone dégagé
en fonction du temps (voir la courbe ). La pression du gaz est égale à la pression atmosphérique.
La réaction chimique étudiée peut être modélisée par l’équation :
2
CaCO3( s ) 2H3Oaq CO2( g ) Caaq 3H 2 0(l )
1- Déterminer les quantités de matière initiale de
chacun des réactifs.
2-Dresser le tableau d’avancement de la réaction.
En déduire la valeur xmax de l’avancement
maximum. Quel est le réactif limitant ?
3-Exprimer l’avancement x de la réaction à une
date t en fonction de VCO2, T, Patm et R.
4- Calculer le volume maximum de gaz susceptible
d’être recueilli dans les conditions de l’expérience.
5- Donner l’expression de la vitesse volumique de réaction
en fonction de VCO2, T, Patm et R et VS . calculer sa valeur à l’instant t 0s .
6-Déterminer graphiquement la valeur de t1/2
Vous aimerez peut-être aussi
- 4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDFDocument30 pages4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDFChaima IchaouiPas encore d'évaluation
- Thermodynamique TD, Tests, Exam CorrigeeDocument55 pagesThermodynamique TD, Tests, Exam CorrigeeAwatif BePas encore d'évaluation
- Devoir de Controle 1 Bac Math 21-22 (Copie Finale)Document5 pagesDevoir de Controle 1 Bac Math 21-22 (Copie Finale)Lotfi Bouchareb100% (1)
- CorrosionDocument86 pagesCorrosionmaria100% (6)
- Controle 1 Bac SC 2019 MR Nabil AbdmoulehDocument6 pagesControle 1 Bac SC 2019 MR Nabil AbdmoulehMouhamed Ali SahbaniPas encore d'évaluation
- Soutien Pcsi 3 Vitesse Et Loi de VitesseDocument5 pagesSoutien Pcsi 3 Vitesse Et Loi de VitesseHarakat ElhoucinePas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- ThermoDocument3 pagesThermoOumixa BenPas encore d'évaluation
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- D4.13.Ch4.machine Frigorifique bts94 PDFDocument3 pagesD4.13.Ch4.machine Frigorifique bts94 PDFBrahimloPas encore d'évaluation
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- dc2 Pilote Tunis 2009Document4 pagesdc2 Pilote Tunis 2009lolocheePas encore d'évaluation
- Extherm1 20089Document28 pagesExtherm1 20089Joshua JordanPas encore d'évaluation
- Biof Exo CH Cinetique Chimique 14-06-2020Document2 pagesBiof Exo CH Cinetique Chimique 14-06-2020hamzawydadi906Pas encore d'évaluation
- Equilibre ChimiqueDocument2 pagesEquilibre ChimiqueBoussetta ZouhaierPas encore d'évaluation
- Suivi Temporel N2-À Distance-Prof OthmaneDocument12 pagesSuivi Temporel N2-À Distance-Prof Othmaneanass100% (1)
- °smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Document23 pages°smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Ayoub OuangliPas encore d'évaluation
- TD 1 ThermoDocument2 pagesTD 1 Thermomoney makerPas encore d'évaluation
- Ds 6Document5 pagesDs 6Henri BessesPas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Série de Révision N°1Document5 pagesSérie de Révision N°1BaccariPas encore d'évaluation
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- TD Thermo1Document10 pagesTD Thermo1Ayoub Tesla OuakaniPas encore d'évaluation
- Examen1 Thermodynamique 2 SMP3 FSSMDocument6 pagesExamen1 Thermodynamique 2 SMP3 FSSMBambe KodjarePas encore d'évaluation
- Dev Synthese N°14scDocument6 pagesDev Synthese N°14scSahbi Mabrouki Yamen0% (1)
- Serie 1 de TDDocument3 pagesSerie 1 de TDbouraiou nabilaPas encore d'évaluation
- Series Thermodynamique 2011 Zradba Avec CorrectionDocument26 pagesSeries Thermodynamique 2011 Zradba Avec CorrectionTaha Blr100% (1)
- TD2 ThermoDocument2 pagesTD2 Thermoamany brPas encore d'évaluation
- PDF Sujet Chimie Abcpst06Document8 pagesPDF Sujet Chimie Abcpst06Jeremy ForoiPas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- DMDocument3 pagesDMMarwane DevPas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- Annales, Le Retour !Document20 pagesAnnales, Le Retour !realofigor11Pas encore d'évaluation
- Devoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Math (2012-2013) MR Boussaid Ali PDFDocument7 pagesDevoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Math (2012-2013) MR Boussaid Ali PDFBarhoumi Mourad100% (4)
- Exercice en Thermodynamique Moteur ThermiqueDocument3 pagesExercice en Thermodynamique Moteur ThermiqueKesse JosephPas encore d'évaluation
- DC N - 1 SC - Exp PDFDocument6 pagesDC N - 1 SC - Exp PDFMohamed SaidiPas encore d'évaluation
- Chap13 Bilans Energie 1er Ppe TDDocument4 pagesChap13 Bilans Energie 1er Ppe TDdhoubzainabPas encore d'évaluation
- Serie 2Document2 pagesSerie 2Yassine EL FAKHAOUIPas encore d'évaluation
- Série N°06: 2NH (G) + 5/2O (G) 2NO (G) + 3H O (G)Document5 pagesSérie N°06: 2NH (G) + 5/2O (G) 2NO (G) + 3H O (G)slbclqrkPas encore d'évaluation
- Exercices Premier Et Deuxieme PrincipeDocument4 pagesExercices Premier Et Deuxieme PrincipeTaoufikAghrisPas encore d'évaluation
- Sujets D Examens de Thermodynamique Avec SolutionsDocument22 pagesSujets D Examens de Thermodynamique Avec Solutionsilyasarmy70% (33)
- dc1 4emeScExp Sadiki 12-13-1Document4 pagesdc1 4emeScExp Sadiki 12-13-1ben zayed ali100% (1)
- TD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Document11 pagesTD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Chai MaePas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- Devoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Kallel Chiheb PDFDocument10 pagesDevoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Kallel Chiheb PDFAzizElheniPas encore d'évaluation
- Série N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Document4 pagesSérie N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Hiba JendoubiPas encore d'évaluation
- Série N°1 Cinétique-ThermodynamiqueDocument4 pagesSérie N°1 Cinétique-ThermodynamiquecamelaPas encore d'évaluation
- BlancI PC BiofDocument7 pagesBlancI PC BiofwfwgPas encore d'évaluation
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 pagesExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixPas encore d'évaluation
- Devoir Physique 3 BacetplusDocument7 pagesDevoir Physique 3 BacetplusMed BriniPas encore d'évaluation
- Série de Préparation Suivi D'une Transformation Chimique PDFDocument4 pagesSérie de Préparation Suivi D'une Transformation Chimique PDFSaid Ha70% (10)
- Serie2+3+solutions Elt 2023 1 5Document5 pagesSerie2+3+solutions Elt 2023 1 5Amna Selsabil MokriPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de MasseimedPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de Masseimed100% (1)
- TD Serie 1 PDFDocument4 pagesTD Serie 1 PDFmohamed saadiPas encore d'évaluation
- QCMPLUS ExempleDocument3 pagesQCMPLUS ExempleQCMPas encore d'évaluation
- Memoire Boissons SucreesDocument41 pagesMemoire Boissons SucreesFa TenePas encore d'évaluation
- Risques, Revues de Projet, Réunions, Équipe Et Communication (PDFDrive)Document98 pagesRisques, Revues de Projet, Réunions, Équipe Et Communication (PDFDrive)Allaoua BelkacemPas encore d'évaluation
- Fiche Technique Formation Exigences de La Norme ISO 9001Document2 pagesFiche Technique Formation Exigences de La Norme ISO 9001Riadh TaktakPas encore d'évaluation
- Epreuve 2 Trim1 3ème M3 LMA Décembre 2020Document2 pagesEpreuve 2 Trim1 3ème M3 LMA Décembre 2020BAMALJoseph FirminPas encore d'évaluation
- Cours de Drague - Le Coach de Drague Répond À Alexandre PDFDocument10 pagesCours de Drague - Le Coach de Drague Répond À Alexandre PDFGregory WavreskiPas encore d'évaluation
- Bingo BlablaDocument5 pagesBingo BlablaSebastián Carrasco MendozaPas encore d'évaluation
- La PorositeDocument9 pagesLa Porositeعبد العزيز مروىPas encore d'évaluation
- Analyse Du Liquide Cephalo RachidienDocument7 pagesAnalyse Du Liquide Cephalo RachidienFranck Touko El Maravilloso50% (2)
- Annexe AT PDFDocument1 pageAnnexe AT PDFjoverPas encore d'évaluation
- Bible Medecine Interne Gros-1Document422 pagesBible Medecine Interne Gros-1mbusaPas encore d'évaluation
- Questions Relais Demi - Finale Al Ilm 2019Document3 pagesQuestions Relais Demi - Finale Al Ilm 2019OuwaysPas encore d'évaluation
- Cancer de L'Endometre: Haddad SamuelDocument42 pagesCancer de L'Endometre: Haddad SamuelPhy RdaousPas encore d'évaluation
- Compte Rendu Visite ChantierDocument11 pagesCompte Rendu Visite ChantierYahia Bob100% (1)
- Tourte de Canard Et Foie Gras Par Paul BocuseDocument3 pagesTourte de Canard Et Foie Gras Par Paul BocuseLebasPas encore d'évaluation
- Filtre Eau Tamis Permo Flash DN 20 DN 50Document2 pagesFiltre Eau Tamis Permo Flash DN 20 DN 50Riad SaidPas encore d'évaluation
- Laura CottardDocument13 pagesLaura CottardisabelpugaPas encore d'évaluation
- CommunicationcriseDocument14 pagesCommunicationcriseSara MasmarPas encore d'évaluation
- Environnement FRDocument16 pagesEnvironnement FRCamille AquilonPas encore d'évaluation
- Consignes Daccueil ERASMUSDocument4 pagesConsignes Daccueil ERASMUSVictoria VictoriaPas encore d'évaluation
- Cour de Chimie Minérale-1Document87 pagesCour de Chimie Minérale-1drissaboly55Pas encore d'évaluation
- RNIS (Reseau Numerique A Integrat de ServiceDocument16 pagesRNIS (Reseau Numerique A Integrat de ServicebanoPas encore d'évaluation
- La Personnalité Du Cyrano de Rostand Vue Par L'analyse Des Logiques Subjectives (A.L.S.)Document11 pagesLa Personnalité Du Cyrano de Rostand Vue Par L'analyse Des Logiques Subjectives (A.L.S.)Jean-Jacques PintoPas encore d'évaluation
- Ebook Joyce Meyer 12 Meilleures Pensees Du Jour Sur Dieu PDFDocument16 pagesEbook Joyce Meyer 12 Meilleures Pensees Du Jour Sur Dieu PDFJoel KialaPas encore d'évaluation
- M-Cuisine Rice Cooker Care UseDocument2 pagesM-Cuisine Rice Cooker Care UseAnna TermiziPas encore d'évaluation
- Quizz LéonardDocument3 pagesQuizz LéonardMarius IonescuPas encore d'évaluation
- Siemens Marquet Manuel de L'utilisateurDocument38 pagesSiemens Marquet Manuel de L'utilisateurclaraPas encore d'évaluation
- Le Système Damon Niveau 1 - DR F Chavalier - Sam 18 - Dim 19 Juin 2022 ParisDocument2 pagesLe Système Damon Niveau 1 - DR F Chavalier - Sam 18 - Dim 19 Juin 2022 Paristbatouaziza15007Pas encore d'évaluation