Académique Documents
Professionnel Documents
Culture Documents
Biof Exo CH Cinetique Chimique 14-06-2020
Transféré par
hamzawydadi9060 évaluation0% ont trouvé ce document utile (0 vote)
23 vues2 pagesTitre original
BIOF EXO CH CINETIQUE CHIMIQUE 14-06-2020
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
23 vues2 pagesBiof Exo CH Cinetique Chimique 14-06-2020
Transféré par
hamzawydadi906Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
ELOUARDE ABDELHAKIM Ж COURS DU JOUR /2BAC PC BIOF
1/2
EXERCICE DE CINETIQUE CHIMIQUE
Dans un ballon, on réalise la réaction entre le carbonate de calcium CaCO3( s ) et
l’acide chlorhydrique ( H 3 Oaq Cl aq ) . Le dioxyde de carbone formé est recueilli par
déplacement d’eau, dans une éprouvette graduée.
Un élève verse dans le ballon, un volume VS 100 ml d’acide chlorhydrique
( H 3 Oaq Claq ) de concentration C 10 1 mol .l 1 .
A la date t = 0 s, il introduit rapidement dans le ballon m o 2,0 g de carbonate de
calcium CaCO3( s ) tandis qu’un camarade déclenche un chronomètre.
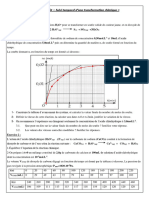
Les élèves relèvent les valeurs du volume V ( CO2 ) de dioxyde de carbone dégagé en
fonction du temps et reportent les résultats sur le graphe suivant :
La pression du gaz CO2 reste constante au cours de cette expérience
P( CO2 ) 1,032.10 5 Pa .
La réaction chimique étudiée est totale et peut être modélisée par l’équation :
2
CaCO3( s ) 2H 3 O( aq )
CO2( g ) Ca( aq ) 3H 2 O( l )
Données :
température du laboratoire au moment de l’expérience : 25°C soit T = 298 K
ELOUARDE ABDELHAKIM Ж COURS DU JOUR /2BAC PC BIOF
2/2
loi des gaz parfaits : P .V n.R.T
1
M ( CaCO3 ) 100 g.mol , M ( CO2 ) 44 g.mol 1 et la constante des gaz parfaits
R 8,314J .K 1 .mol 1
1) 1-1) Calculer la densité par rapport à l’air du gaz dioxyde de carbone CO2 .
1-2) Quelles sont les méthodes physiques utilisées pour suivre l’évolution de cette
réaction chimique ?
2) Déterminer les quantités de matière initiales de chaque réactif.
3) Dresser le tableau d’avancement de la réaction et déduire le réactif limitant en
calculant la valeur xmax de l’avancement maximum.
4) Exprimer l’avancement x de la réaction à une date t en fonction de R ,T ,
P( CO2 ) et V ( CO2 ) .
5) Calculer le volume V ( CO2 ) f de gaz susceptible d’être recueilli dans les conditions
de l’expérience à l’état final .
6) Donner l’expression de la vitesse volumique de réaction en fonction de : P , R,T ,
dV ( CO2 )
et du volume VS de solution.
dt
7-1) Calculer la vitesse volumique à l’instant t 0 .
7-2) Comment varie la vitesse volumique au cours du temps ? Justifier à l’aide du
graphe.
7-3) Définir le temps de demi réaction t 1 / 2 et déterminer graphiquement sa valeur .
8) La réaction précédente peut être suivie en mesurant la conductivité de la
solution en fonction du temps.
8-1) Faire l’inventaire des ions présents dans la solution. Quel est l’ion spectateur
dont la concentration ne varie pas ?
8-2) On observe expérimentalement une diminution de la conductivité. Justifier sans
calcul ce résultat connaissant les valeurs des conductivités molaires des ions à 25°C :
H 3O 35.10 3 S .m².mol 1 ; Ca 2 12.10 3 S .m².mol 1 ; Cl 7 ,5.10 3 S .m².mol 1
8-3) Calculer la conductivité o de la solution à l’instant de date t = 0 s.
8-4) Montrer que la conductivité est reliée à l’avancement x par la relation :
o – A.x . Calculer A et f la conductivité finale de la solution .
o f
8-5) Montrer que : ( t t 1 / 2 ) 1 / 2 .
2
a) Montrer que l’expression de la vitesse volumique de réaction est sous la
d
forme : V ( t ) K
dt
Vous aimerez peut-être aussi
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- 2004 Liban Sujet Exo1 Chimie SpeleologieDocument3 pages2004 Liban Sujet Exo1 Chimie SpeleologieEL Omrani SaidPas encore d'évaluation
- DST 4-2Document16 pagesDST 4-2Naouma ChahdPas encore d'évaluation
- Sujet TS Attaque de La CraieDocument4 pagesSujet TS Attaque de La Craieالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- TD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Document11 pagesTD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Chai MaePas encore d'évaluation
- Série Sur Suivi 2 Bac PC - 2022Document4 pagesSérie Sur Suivi 2 Bac PC - 2022Alaoui AminePas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- FDS - TD Cinétique Chimique - 2013Document6 pagesFDS - TD Cinétique Chimique - 2013Lenz Daniel Jean Paul100% (1)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 pagesExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixPas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Controle 1 Bac SC 2019 MR Nabil AbdmoulehDocument6 pagesControle 1 Bac SC 2019 MR Nabil AbdmoulehMouhamed Ali SahbaniPas encore d'évaluation
- 4e-DC1-2010-201 FinaleDocument3 pages4e-DC1-2010-201 FinaleFethi FerchiouPas encore d'évaluation
- 2004 Liban Sujet Exo1 Chimie SpeleologieDocument3 pages2004 Liban Sujet Exo1 Chimie SpeleologieHassan DibPas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- Exercices CINETIQUE L2-2016-2017Document4 pagesExercices CINETIQUE L2-2016-2017Fati Fleur100% (5)
- Chimie Et Spéléologie - CPF0809 Bicarbonate PDFDocument5 pagesChimie Et Spéléologie - CPF0809 Bicarbonate PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Cine Tique 2Document22 pagesCine Tique 2momos55Pas encore d'évaluation
- Suivi Par Pression 1Document2 pagesSuivi Par Pression 1yasserofficiel2006Pas encore d'évaluation
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- ExamenDocument3 pagesExamenIheb DassiPas encore d'évaluation
- Série 2 2 Bac SMDocument3 pagesSérie 2 2 Bac SMYns Frakchi92% (12)
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Serie Cinetique Chimique 2015-2016Document4 pagesSerie Cinetique Chimique 2015-2016Daghsni Said25% (4)
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Spe Physique Chimie 2021 Zero 1 Sujet OfficielDocument11 pagesSpe Physique Chimie 2021 Zero 1 Sujet OfficielChahid OUAAZIZIPas encore d'évaluation
- Cinétique Chimique Exercices 01.TextMarkDocument4 pagesCinétique Chimique Exercices 01.TextMarkAbedPas encore d'évaluation
- Suivi Temporel N2-À Distance-Prof OthmaneDocument12 pagesSuivi Temporel N2-À Distance-Prof Othmaneanass100% (1)
- TD Cin & Cat SMC S5 .Document32 pagesTD Cin & Cat SMC S5 .Chai Mae100% (3)
- Corrige GEIPI Physique-Chimie 2003Document13 pagesCorrige GEIPI Physique-Chimie 2003ogmios_94Pas encore d'évaluation
- Poly TD Dynamique 2018-19Document13 pagesPoly TD Dynamique 2018-19kasoolPas encore d'évaluation
- DS2 Oct08Document6 pagesDS2 Oct08la physique selon le programme FrançaisPas encore d'évaluation
- Olympiade-Chimie Maroc 2016 Serie 4Document4 pagesOlympiade-Chimie Maroc 2016 Serie 4mrPas encore d'évaluation
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- TD1 023 024Document7 pagesTD1 023 024ilyesfares49Pas encore d'évaluation
- Serie Cinetique Chimique 2015 2016 PDFDocument4 pagesSerie Cinetique Chimique 2015 2016 PDFjbeliee jbeliPas encore d'évaluation
- Cinetique-chimique-Exercices 01 CompressedDocument4 pagesCinetique-chimique-Exercices 01 Compressedelmadani boutayebPas encore d'évaluation
- PDF Sujet Chimie Abcpst06Document8 pagesPDF Sujet Chimie Abcpst06Jeremy ForoiPas encore d'évaluation
- Examen 2er Semestre Mai 2017version Finale Enone Et CorrigeeDocument8 pagesExamen 2er Semestre Mai 2017version Finale Enone Et CorrigeeAziz JridiPas encore d'évaluation
- Série N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Document4 pagesSérie N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Hiba JendoubiPas encore d'évaluation
- Chimie Et Spéléologie - CPF0809Document5 pagesChimie Et Spéléologie - CPF0809Phobos ElfaPas encore d'évaluation
- 2009 Reunion Exo2 Sujet PH Datation 7ptsDocument4 pages2009 Reunion Exo2 Sujet PH Datation 7ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Serie C1 PDFDocument4 pagesSerie C1 PDFMofid PC100% (3)
- Chimie TD 3 Cinétique Chimique PDFDocument4 pagesChimie TD 3 Cinétique Chimique PDFOussama El BouadiPas encore d'évaluation
- Chimie Et SpéléologieDocument5 pagesChimie Et SpéléologieقببقصPas encore d'évaluation
- Qui MicaDocument8 pagesQui Micatamylemor2002Pas encore d'évaluation
- Série D'exercices N°1 - Chimie - Cinetique Chimique - Bac Sciences Exp (2018-2019) MR Daghsni SahbiDocument4 pagesSérie D'exercices N°1 - Chimie - Cinetique Chimique - Bac Sciences Exp (2018-2019) MR Daghsni SahbiMaryam MaryamPas encore d'évaluation
- Examen de Cin Et Cat Avec Correction Session Normale 2018-2019Document6 pagesExamen de Cin Et Cat Avec Correction Session Normale 2018-2019Chai Mae100% (1)
- Serie de TD N°123 L2 Raff 22 23Document5 pagesSerie de TD N°123 L2 Raff 22 23Clash of Clans Bilal DzPas encore d'évaluation
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- DS 7 815 2021-2022 34Document5 pagesDS 7 815 2021-2022 34Armel Marc KouchoewanouPas encore d'évaluation
- Kinetics - CinetiqueDocument8 pagesKinetics - CinetiqueRalphNkdPas encore d'évaluation
- Chimie TD 3 Cinétique ChimiqueDocument4 pagesChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- TD Chimie 3em 1Document8 pagesTD Chimie 3em 1LAWSON NICOLASPas encore d'évaluation
- 1 Cours Partie La Matière 1ère Année SecondaireDocument30 pages1 Cours Partie La Matière 1ère Année SecondaireMehdi KHPas encore d'évaluation
- Situation D'apprentissage: Leçon 07: Le Courant ElectriqueDocument68 pagesSituation D'apprentissage: Leçon 07: Le Courant Electriquekoffi bossro-toudiPas encore d'évaluation
- COURS DE Chimie Générale 2022-2023 - FINAL - ActualiséDocument93 pagesCOURS DE Chimie Générale 2022-2023 - FINAL - ActualisékabwekemsPas encore d'évaluation
- Gأ©nie des Matأ©riaux 2011-2012 (IOMP)Document75 pagesGأ©nie des Matأ©riaux 2011-2012 (IOMP)آنت ليPas encore d'évaluation
- 1ER PC CHAP 04 ExercicesDocument66 pages1ER PC CHAP 04 Exerciceskady cdPas encore d'évaluation
- DessalementDocument12 pagesDessalementchahrazedPas encore d'évaluation
- 12b-Fascicule PC Seconde S IA PG-CDC Février 2020 (VF)Document120 pages12b-Fascicule PC Seconde S IA PG-CDC Février 2020 (VF)Nana Diakité88% (17)
- Corrigé de Ce Sujet de Brevet 2019Document3 pagesCorrigé de Ce Sujet de Brevet 2019KillerMaxPas encore d'évaluation
- COURS APC de Chimie 2nde CDocument62 pagesCOURS APC de Chimie 2nde CKessyden TatsaPas encore d'évaluation
- Semi Conducteur Intranet Polytech Paris Sud PDFDocument92 pagesSemi Conducteur Intranet Polytech Paris Sud PDFDominiquePas encore d'évaluation
- 6129e587d3b41solutions Aqueuses Notion de PH Chimie Terminale DDocument6 pages6129e587d3b41solutions Aqueuses Notion de PH Chimie Terminale DJoliette KplokaPas encore d'évaluation
- Reactions ComplexationDocument2 pagesReactions ComplexationRitaj-Rayane KarimPas encore d'évaluation
- Bac PCDocument56 pagesBac PCOumar Traoré100% (2)
- CONDUCTIVITEDocument6 pagesCONDUCTIVITEFadli SmaïnPas encore d'évaluation
- Les Complexes Version FinaleDocument44 pagesLes Complexes Version Finalemamecheikhgaye5Pas encore d'évaluation
- Exos Sur Lelectrolyse Du NaClDocument3 pagesExos Sur Lelectrolyse Du NaClNB100% (1)
- Devoir 5 SM Biof Arsalan PDFDocument3 pagesDevoir 5 SM Biof Arsalan PDFMed BriniPas encore d'évaluation
- Eléctrophorèse Capillaire APPLICATIONSDocument15 pagesEléctrophorèse Capillaire APPLICATIONSsalim100% (1)
- Exercices ConductivitéDocument15 pagesExercices ConductivitéHajar YantourPas encore d'évaluation
- Série 3 3eme Prof - Elhabib (WWW - Pc1.ma)Document3 pagesSérie 3 3eme Prof - Elhabib (WWW - Pc1.ma)younes damePas encore d'évaluation
- Extraction Des EnzymesDocument28 pagesExtraction Des EnzymesBerenger MabéléPas encore d'évaluation
- Epreuve Chimie 1 Preparation Au CNC 2021Document7 pagesEpreuve Chimie 1 Preparation Au CNC 2021Meriem El AbzazePas encore d'évaluation
- Evaluation N°5 Chimie 2nd CDocument2 pagesEvaluation N°5 Chimie 2nd CAPPOLON Le NackyPas encore d'évaluation
- Evaluation Diagnostique TCS-SIBMDocument4 pagesEvaluation Diagnostique TCS-SIBMZakari YaePas encore d'évaluation
- CH IV RevetementsDocument19 pagesCH IV RevetementsWalid Ben AmirPas encore d'évaluation
- PCT 4è-2Document1 pagePCT 4è-2bitenouwe samuelPas encore d'évaluation
- Chapitre IIIDocument4 pagesChapitre IIISERGIOPas encore d'évaluation
- Es Theme Matiere CristallographieDocument17 pagesEs Theme Matiere Cristallographiesiyeon9242Pas encore d'évaluation
- Cours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFDocument103 pagesCours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFNour El Houda100% (1)