Académique Documents
Professionnel Documents
Culture Documents
Serie de TD N°123 L2 Raff 22 23
Transféré par
Clash of Clans Bilal DzTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Serie de TD N°123 L2 Raff 22 23
Transféré par
Clash of Clans Bilal DzDroits d'auteur :
Formats disponibles
Université des Sciences & de la Technologie d’Oran ‘’Med Boudiaf ‘’-USTOMB
Faculté de Chimie-Département de Génie Chimique
L2-(Industries Pétrochimiques)-2022/2023
Cinétique Chimique : Série de TD N°1
Exercice N°1 : Laquelle de ces deux réactions est susceptible de s’effectuer le plus
lentement ? Expliquez votre réponse.
1. Ca + 2 HCl CaCl2 + H2
2. CaCO3 + 2 HCl CaCl2 + H2O + CO2
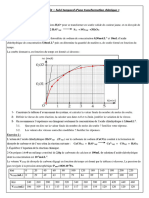
Exercice N°2: On étudie la cinétique de la décomposition d'un hypochlorite :
2 ClO-(aq) 2 Cl-(aq) + O2(g).
On mesure le volume de O2 dégagé au cours du temps à 25 °C et on le met en graphique.
a) Quelle est la durée en minute de cette réaction?
b) Parmi les 3 graphiques ci-dessous, quel est celui qui traduit l'évolution de la vitesse de la
réaction au cours du temps ? (Justifiez votre choix)
Exercice N°3: Soit la réaction d'oxydation de l'ammoniac :
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g).
Sachant qu'à l'instant t, NH3 disparaît à la vitesse de 0,2 mol/L.s, calculez :
La vitesse de la réaction globale, la vitesse de disparition de O2 et les vitesses d’apparition de
NO et H2O au même instant.
Exercice N° 4 : On dissout 34,2g de saccharose dans de l'eau afin d'obtenir 100 mL de
solution, et on déclenche le chronomètre. Quel que soit l'instant choisi comme origine des
temps, on constate que, si N est la quantité de saccharose présent à cet instant, il faut attendre
200 min pour que la quantité de saccharose restant en solution soit égale à N/2 (dans les
conditions de l'expérience). La réaction de dissolution du saccharose dans l'eau est:
C12H22O11 (saccharose) + H2O C6H12O6 (glucose) + C6H12O6 (fructose)
1. Tracez la courbe donnant la concentration du glucose formé en fonction du temps de
t=0 à t=1200 min.
2. Et déduire la vitesse de disparition du saccharose au temps t=300 min.
TD Cinétique Chimique (Mme Zradni)
Université des Sciences & de la Technologie d’Oran ‘’Med Boudiaf ‘’-USTOMB
Faculté de Chimie-Département de Génie Chimique
L2-(Industries Pétrochimiques)-2022/2023
Cinétique Chimique : Suite de la Série de TD N°1
Exercice N°5 :
Soit la transformation suivante : Ester + base → Sel + alcool. On dose la base restante en
solution, et on trouve ceci :
Temps (S) 0 150 300 450 600 750
[Base] mole/l 10-2 7.710-3 6.2510-3 5.2510-3 4.5510-3 410-3
1°) Tracez la courbe donnant [Base] en fonction du (Temps)
2°) Déterminez la vitesse moyenne entre les instants t=150 s et t= 450 s
3°) Calculez la vitesse instantanée à t=600 s.
Exercice N°6 :
Le peroxyde d'hydrogène liquide (H2O2) se décompose en eau et en dioxygène en
présence de FeCl3 (catalyseur) selon la réaction suivante : 2H2O2(l) 2 H2O(l) + O2(g). Dans un
récipient, on introduit le peroxyde et le catalyseur et on mesure au cours du temps le volume
de O2 dégagé.
Temps en minutes 0 2 4 6 10 15 20 25
n de O2 (10-5 mol) 0 2 4 6 20 30 40 48
Conc de H2O2 (10-4 mol/L) 40 39.6 39.2 38.8 34 32 30.4
a) Calculez la vitesse moyenne de formation de O2 entre 4 et 10 minutes.
b) Calculez la concentration de H2O2 à l'instant t = 10 min
c) Tracez le graphe d'évolution de la concentration de H2O2 en fonction du temps.
d) Déterminez graphiquement le temps au bout duquel le 1/8 de H2O2 a été décomposé.
TD Cinétique Chimique (Mme Zradni)
Université des Sciences & de la Technologie d’Oran ‘’Med Boudiaf ‘’-USTOMB
Faculté de Chimie-Département de Génie Chimique
L2-(Industries Pétrochimiques)-2022/2023
Cinétique Chimique : Série de TD N°2
Exercice N°1 :
La décomposition de l'eau oxygénée H2O2 est catalysée par les ions iodures I- et le
mécanisme de cette réaction en solution est:
H2O2 + I- H2O+ IO- (réaction très lente)
OI- + H2O2 H2O + I- + O2 (réaction rapide)
1°) Ecrire l'équation-bilan de cette réaction.
2°) Exprimer la vitesse de cette réaction.
3°) Que peut-on dire des ions IO-.
Exercice N°2 :
Voici le mécanisme d’une réaction catalytique :
1ère étape, rapide : 2Cu2+(aq)+ 2I-(aq) 2Cu+(aq)+ I2(g)
2ème étape, lente : Cu+(aq)+ S2O82-(aq) CuSO4+(aq)+ SO42-(aq)
3ème étape, moyenne : Cu+(aq)+ CuSO4+(aq) 2Cu2+(aq)+ SO42-(aq)
a) Quelle est la réaction globale (bilan) de ce mécanisme ?
b) Quelle substance joue le rôle de catalyseur ? Expliquez votre réponse.
c) Quelle est l’étape déterminante de ce mécanisme ? Expliquez votre réponse.
Exercice N°3 :
Soit la réaction : CH3I + C2H5ONa CH3OC2H5 + NaI. Elle est d’ordre global ‘’2’’ et
K étant sa constante de vitesse. On a établi les résultats expérimentaux suivants : (R = 8,31
J.K-1.mol-1)
T (°C) 0 6 12 18 24 30
K (mol-1.L.s-1) 5,60.10-5 11,8.10-5 24,5.10-5 48,8.10-5 100.10-5 208.10-5
a) En déduire l’énergie d’activation de cette réaction ainsi que son facteur de
fréquence.
Exercice N°4 :
a) La constante de vitesse de la réaction 2 N2O5(g) →4 NO2(g) + O2(g) double quand on
passe de 22,50°C à 27,47°C. Déterminer l’énergie d’activation de la réaction.
b) Une réaction a une énergie d'activation de 70 kJ. Quelle est la valeur du rapport des
vitesses à 40°C et 60°C?
TD Cinétique Chimique (Mme Zradni)
Université des Sciences & de la Technologie d’Oran ‘’Med Boudiaf ‘’-USTOMB
Faculté de Chimie-Département de Génie Chimique
L2-(Industries Pétrochimiques)-2022/2023
Cinétique Chimique : Série de TD N°3
Exercice N°1:
On considère la réaction : C6H5N2Cl→C6H5Cl + N2 à 48 °C. On observe que la
moitié du réactif s’est décomposé en 16.4 min, quelle que soit la concentration initiale en
réactif.
a) Quel est l’ordre de cette réaction ?
b) Quelle est la valeur de sa constante de vitesse ? Au bout de combien de temps la
concentration du réactif est-elle réduite à 30 % ?
Exercice N°2 :
A) Dans une première expérience on réalise dans les conditions appropriées, une étude
cinétique de la réaction (1) suivante (solvant H2O ; T = 298 K) :
(1) CrO2+2(aq) Cr+2(aq) + O2(aq)
La réaction a pour constante de vitesse k1 = 2,5.10-4s-1. A l’instant t1 = 103 s la concentration
en ions CrO2+2 est : [CrO2+2]t1 = 1,5.10-4mol.L-1.
1) Quel est l’ordre de cette réaction ? Justifiez !
2) Calculez la concentration initiale en CrO2+2 ?
3) Déterminez le temps de demi-réaction (t1/2) en secondes, pour la réaction (1).
B) Dans une deuxième expérience on réalise l’étude cinétique de la réaction (2) suivante
(solvant H2O ; T = 298 K) :
(2) Cr+2(aq) + O2(aq) CrO2+2(aq)
Les conditions initiales sont : [Cr+2]0 = [O2]0= 1,5.10-4mol.L-1.
La réaction, a pour constante de vitesse k2 = 1,6.108 mol-1.L. s-.1
Déterminez l’ordre global de la réaction (2) en justifiant, ainsi que son temps de
demi-réaction (t1/2) en secondes.
Exercice N°3:
Soit la réaction : NOCl (g) → NO (g) + ½ Cl2 (g)
Temps(s) 0 20 40 60 90 120 240
[NOCl] (mol/L) 0.500 0.175 0.106 0.076 0.054 0.041 0.022
TD Cinétique Chimique (Mme Zradni)
Université des Sciences & de la Technologie d’Oran ‘’Med Boudiaf ‘’-USTOMB
Faculté de Chimie-Département de Génie Chimique
L2-(Industries Pétrochimiques)-2022/2023
1) Trouvez l’ordre de cette réaction.
2) Donnez la valeur numérique de la constante de vitesse à l’aide des données ci-dessus
3) Calculez le temps de demi-réaction.
Exercice N°4:
La réaction CH3Br + OH- CH3OH + Br –, suit une loi de vitesse de la
forme : v = k [CH3Br] [OH-] avec une constante de vitesse k = 2,810-4L. mol-1.s-1 à 25°C.
Quelle est sa vitesse initiale et quelle proportion de CH3Br a-t-elle été consommée
après 1 heure de réaction, dans chacun des cas suivants :
a) [CH3Br] = [OH-] = 8.10-2 mol.L-1
b) [CH3Br] = [OH-] = 2 mol.L-1
c) [CH3Br] = 8.10-2 mol.L-1 ; [OH-] = 2 mol.L-1
Exercice N°5:
Soit la réaction suivante :
CH3COOC2H5 + NaOH CH3COO-, Na+ + C2H5OH
On trouve expérimentalement qu’elle est du second ordre avec une constante de vitesse
k = 0,12 L/mole.s. La [Ester]0 = [Soude]0 = 0,02M. Quelle est sa vitesse initiale et quel
pourcentage de ces réactifs sera transformé au bout de 15 minutes.
TD Cinétique Chimique (Mme Zradni)
Vous aimerez peut-être aussi
- Poly TD Dynamique 2018-19Document13 pagesPoly TD Dynamique 2018-19kasoolPas encore d'évaluation
- TD Cin & Cat SMC S5 .Document32 pagesTD Cin & Cat SMC S5 .Chai Mae100% (3)
- TD Cinetique ChimiqueDocument3 pagesTD Cinetique ChimiqueSimplice Assemien100% (3)
- PDFDocument1 pagePDFabderrachid bouzinePas encore d'évaluation
- Cinétique Chimique Exercices 01.TextMarkDocument4 pagesCinétique Chimique Exercices 01.TextMarkAbedPas encore d'évaluation
- Cinetique-chimique-Exercices 01 CompressedDocument4 pagesCinetique-chimique-Exercices 01 Compressedelmadani boutayebPas encore d'évaluation
- Exercices CINETIQUE L2-2016-2017Document4 pagesExercices CINETIQUE L2-2016-2017Fati Fleur100% (5)
- TD Thermodynamique Et Chimie Des Solutions Salamani ADocument6 pagesTD Thermodynamique Et Chimie Des Solutions Salamani Asalma koudriPas encore d'évaluation
- S Rie D Exercices Corrig S Cin TiqueDocument6 pagesS Rie D Exercices Corrig S Cin Tiqueanie KheliliPas encore d'évaluation
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- 2024 - Devoir 2 - Cinétique ChimiqueDocument3 pages2024 - Devoir 2 - Cinétique Chimiqueredbubbllee.nPas encore d'évaluation
- Srie Dexos Cintique L3-GPDocument6 pagesSrie Dexos Cintique L3-GPFatima YahiaPas encore d'évaluation
- Exercices - Série 01avec Correction (Réacteurgp)Document2 pagesExercices - Série 01avec Correction (Réacteurgp)Cherif LaifaPas encore d'évaluation
- LST-PCM - TD Cinétique Chimique - Série 1 - 2024 - 231029 - 120209Document2 pagesLST-PCM - TD Cinétique Chimique - Série 1 - 2024 - 231029 - 120209redbubbllee.nPas encore d'évaluation
- TD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Document11 pagesTD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Chai MaePas encore d'évaluation
- TD4+Solution Thermodynamique Et Cinétique ChimiqueDocument8 pagesTD4+Solution Thermodynamique Et Cinétique ChimiqueAmira MiraPas encore d'évaluation
- Série Corrigé CinétiqueDocument8 pagesSérie Corrigé Cinétiquejakobslimani02Pas encore d'évaluation
- TD HLCH420 Cinétique Chimique 16-17Document4 pagesTD HLCH420 Cinétique Chimique 16-17y_aitabdellahPas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- Exercice Corrigé CinétiqueDocument13 pagesExercice Corrigé Cinétiquejakobslimani02Pas encore d'évaluation
- 6 TDPCSIcinetique 2015Document8 pages6 TDPCSIcinetique 2015Nguissaly SonkoPas encore d'évaluation
- FDS - TD Cinétique Chimique - 2013Document6 pagesFDS - TD Cinétique Chimique - 2013Lenz Daniel Jean Paul100% (1)
- UAA6 - Cinétique - Corrigé Des ExercicesDocument6 pagesUAA6 - Cinétique - Corrigé Des ExercicesThomas CocoPas encore d'évaluation
- Fiche de TD N°1 CinétiqueDocument3 pagesFiche de TD N°1 CinétiqueÑar ĎjesPas encore d'évaluation
- TD N°1) Chimie Phy 2023Document2 pagesTD N°1) Chimie Phy 2023riyan raisPas encore d'évaluation
- Série 1 Cinétique 2020 2021Document4 pagesSérie 1 Cinétique 2020 2021Li Na0% (1)
- TDcinét Chim.17-18Document3 pagesTDcinét Chim.17-18Joseph AmondPas encore d'évaluation
- TD - Cpgo - 2023-2024 - Cinetique ChimiqueDocument4 pagesTD - Cpgo - 2023-2024 - Cinetique Chimiquedieudonnepooda71Pas encore d'évaluation
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- M28 Cinétique TD1Document2 pagesM28 Cinétique TD1Hassan DriouachPas encore d'évaluation
- Travaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesDocument3 pagesTravaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesAbderrahman IGHNIHPas encore d'évaluation
- Fiche CinétiqueDocument5 pagesFiche Cinétiquekamanomarcien6Pas encore d'évaluation
- Examen de Cin Et Cat Avec Correction Session Normale 2018-2019Document6 pagesExamen de Cin Et Cat Avec Correction Session Normale 2018-2019Chai Mae100% (1)
- Fiche TD N01Document2 pagesFiche TD N01amiira bouzouadaPas encore d'évaluation
- Série 3 de Cinétique 2022 2023Document4 pagesSérie 3 de Cinétique 2022 2023My ProofPas encore d'évaluation
- Série 2Document2 pagesSérie 2Farouk OmarPas encore d'évaluation
- TD 2Document3 pagesTD 2Simo ELyamani100% (2)
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- QCM ContrôletexteDocument2 pagesQCM ContrôletextealexandroPas encore d'évaluation
- Planning ORAUX BIOTECH 1 17 DEC 2021Document15 pagesPlanning ORAUX BIOTECH 1 17 DEC 2021Sébastien UrienPas encore d'évaluation
- Fiche de TD N°2 PDFDocument15 pagesFiche de TD N°2 PDFPaola DjeugaPas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- TD Cinetiqueserie n07Document2 pagesTD Cinetiqueserie n07YASSINE AZNAGPas encore d'évaluation
- Examens Cinétique ChimiqueDocument10 pagesExamens Cinétique Chimiquemohamed jibou100% (1)
- Serie1 Corrigé CinetiqueDocument7 pagesSerie1 Corrigé Cinetiquemohammed laadili100% (2)
- Cinétique Chimique Exercices - 06Document2 pagesCinétique Chimique Exercices - 06neval chenchouniPas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- Cinétique Chimique TD Corrigé 05Document8 pagesCinétique Chimique TD Corrigé 05elie mij kisalePas encore d'évaluation
- Cin PBDocument8 pagesCin PBYoussef FarjallahPas encore d'évaluation
- TP Cinétique 2: Saponification Détermination de L'ordre D'une Réaction Par ConductimétrieDocument2 pagesTP Cinétique 2: Saponification Détermination de L'ordre D'une Réaction Par ConductimétrieSara LammariPas encore d'évaluation
- TD2 Correction PDFDocument8 pagesTD2 Correction PDFKhadija LakhdiriPas encore d'évaluation
- Corrige GEIPI Physique-Chimie 2003Document13 pagesCorrige GEIPI Physique-Chimie 2003ogmios_94Pas encore d'évaluation
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- TDT4 MecanismesDocument8 pagesTDT4 Mecanismesadil.salami1993Pas encore d'évaluation
- Chimie 2Document2 pagesChimie 2tcheva jokhanan TiambiPas encore d'évaluation
- Electrochimie GP Ef 2017correctionDocument4 pagesElectrochimie GP Ef 2017correctionAbdelatif100% (2)
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Exo Cinetique Corrige AmmadoucheDocument82 pagesExo Cinetique Corrige AmmadouchetalebPas encore d'évaluation
- Contre Rendue CMCDocument7 pagesContre Rendue CMCClash of Clans Bilal DzPas encore d'évaluation
- Mémoire CompletDocument78 pagesMémoire CompletClash of Clans Bilal DzPas encore d'évaluation
- Contre Rendue CMCDocument7 pagesContre Rendue CMCClash of Clans Bilal DzPas encore d'évaluation
- Fiche TD 02 Thermodynamique Des EquilibresDocument4 pagesFiche TD 02 Thermodynamique Des Equilibresbouchrabell734Pas encore d'évaluation
- Refracto AbbeDocument6 pagesRefracto AbbeClash of Clans Bilal DzPas encore d'évaluation
- Fiche TD2Document2 pagesFiche TD2Clash of Clans Bilal DzPas encore d'évaluation
- Fiche TD 2 MPCA 2023 2024Document4 pagesFiche TD 2 MPCA 2023 2024Clash of Clans Bilal DzPas encore d'évaluation
- Fiche 3 MNDocument1 pageFiche 3 MNClash of Clans Bilal DzPas encore d'évaluation
- Fiche de TD N°2 D'électrochimie 2023-2024Document1 pageFiche de TD N°2 D'électrochimie 2023-2024Clash of Clans Bilal DzPas encore d'évaluation
- Fiche TD 2 Thermo - L2GP 2023Document2 pagesFiche TD 2 Thermo - L2GP 2023Clash of Clans Bilal DzPas encore d'évaluation
- TD3 - CH Solut - 22Document2 pagesTD3 - CH Solut - 22Clash of Clans Bilal DzPas encore d'évaluation
- TD N°3 Thermo L2-GP Modifiée 2023Document2 pagesTD N°3 Thermo L2-GP Modifiée 2023Clash of Clans Bilal DzPas encore d'évaluation
- TD mn2Document1 pageTD mn2Clash of Clans Bilal DzPas encore d'évaluation
- Techniques de Com Suite Cours 3 BBDocument5 pagesTechniques de Com Suite Cours 3 BBClash of Clans Bilal DzPas encore d'évaluation
- Les Verbes DopinionDocument2 pagesLes Verbes DopinionMa GOuPas encore d'évaluation
- Correction Conductivite Des SolutionsDocument4 pagesCorrection Conductivite Des SolutionsClash of Clans Bilal DzPas encore d'évaluation
- Pommade A L'oxyde de ZincDocument2 pagesPommade A L'oxyde de ZincDabi YannPas encore d'évaluation
- 18chi3e E2Document4 pages18chi3e E2Fouad MihoubPas encore d'évaluation
- Coours D'hydralique ESMGDocument17 pagesCoours D'hydralique ESMGGedehon KOUADIOPas encore d'évaluation
- Chimie PharmaceutiqueDocument65 pagesChimie PharmaceutiqueLoïc GarveyPas encore d'évaluation
- Transformateur de PuissanceDocument25 pagesTransformateur de PuissanceSidiPas encore d'évaluation
- HABITAT 3 Guide Equipt Segpa 2 MAJDocument8 pagesHABITAT 3 Guide Equipt Segpa 2 MAJedysonePas encore d'évaluation
- Cat Electronic Technician 2017B v1.0 État: Paramètre ValeurDocument2 pagesCat Electronic Technician 2017B v1.0 État: Paramètre ValeursemahPas encore d'évaluation
- Installations de PlomberieDocument20 pagesInstallations de PlomberieMaLuciole100% (1)
- SALMIM - MERBAHS.AMIRY.1 Céréales PDFDocument87 pagesSALMIM - MERBAHS.AMIRY.1 Céréales PDFVaio SonyPas encore d'évaluation
- 4eme Séance Les Glucides Structre Et Propriétés 2020-2021 - Copie - CopieDocument14 pages4eme Séance Les Glucides Structre Et Propriétés 2020-2021 - Copie - Copiewassi laPas encore d'évaluation
- La MatiereDocument6 pagesLa MatiereZaza ZozoPas encore d'évaluation
- TP Chimie S1Document58 pagesTP Chimie S1François Adolphe50% (2)
- Laisson Chimiques SMPC S2Document37 pagesLaisson Chimiques SMPC S2Saidi AbdelghaniPas encore d'évaluation
- Chapitre 10 Structure Et Polarité d' Une MoléculeDocument2 pagesChapitre 10 Structure Et Polarité d' Une MoléculeElouan Berthome LavignottePas encore d'évaluation
- Chap 3 2020Document24 pagesChap 3 2020JakePas encore d'évaluation
- Liste Des Analyses D'eau PiscineDocument3 pagesListe Des Analyses D'eau PiscinemouradPas encore d'évaluation
- Technique de Maintenance Des Postes THTDocument95 pagesTechnique de Maintenance Des Postes THTKamel NaitPas encore d'évaluation
- Project Microbiologie IreDocument22 pagesProject Microbiologie IreDaniela Gologan100% (2)
- Proprietes Des MateriauxDocument14 pagesProprietes Des Materiauxlamia temmouchePas encore d'évaluation
- Lme 604Document87 pagesLme 604Seraphin BibaPas encore d'évaluation
- 05 Lubrification SNRDocument14 pages05 Lubrification SNRAnonymous LfeGI2hM100% (1)
- Les EmpreintesDocument56 pagesLes EmpreintesLina Ray Ben100% (7)
- 1 PBDocument30 pages1 PBfreshmendocsPas encore d'évaluation
- TP Génie de ProcedésDocument22 pagesTP Génie de ProcedéskaltoumPas encore d'évaluation
- Chapitre 01 Securite EnvironnementDocument7 pagesChapitre 01 Securite EnvironnementMAYA OURABAHPas encore d'évaluation
- Odie TFCDocument12 pagesOdie TFCOdie NangoziaPas encore d'évaluation
- MP FP END 0024 UT Travaux Dirigés 2009 PDFDocument39 pagesMP FP END 0024 UT Travaux Dirigés 2009 PDFgueridiPas encore d'évaluation
- Ecologie, Agronomie Et TerritoiresDocument11 pagesEcologie, Agronomie Et TerritoiresLe MondePas encore d'évaluation
- 1S TP N 17 Separation D Un Melange Eau AlcoolDocument3 pages1S TP N 17 Separation D Un Melange Eau Alcoolsaber mimiPas encore d'évaluation
- CXS C04fDocument3 pagesCXS C04fمولاي أمحمد عكرميPas encore d'évaluation