Académique Documents
Professionnel Documents
Culture Documents
PH R Sum
Transféré par
3freefire 3gameTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
PH R Sum
Transféré par
3freefire 3gameDroits d'auteur :
Formats disponibles
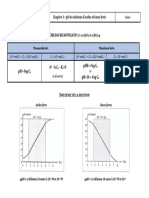
PH DES SOLUTIONS ACIDES/B ASIQUES:
Si C >= 10-6 : pH= -Log( Ca ) Si Ka/Ca <= 10-2 : pH= ½( pKa - Log Ca )
ACIDE FORT ACIDE FAIBLE Si 10-2 < Ka/Ca < 10 : pH= -Log( [-Ka + (Ka2 +4KeCa)1/2]/2 )
Si C < 10-6 : pH= -Log( [Ca + (Ca² + 4Ke)1/2]/2 ) Si Ka/Ca > 10 : pH= -Log( [Ca + ( Ca² + 4Ke)1/2]/2 )
Si C >= 10-6 : pH= Log( Cb ) + 14 Si Kb/Cb <= 10-2 : pH= ½( 14 + pKa + Log Cb )
BASE FORTE BASE FAIBLE Si 10-2 < Kb/Cb < 10 : pH= -Log( [Ke + (Ke2 +4 Ka KeCb)1/2]/ (2Cb) )
Si C < 10-6 : pH= -Log( [ -Cb + (Cb² + 4Ke)1/2]/2 ) Si Kb/Cb > 10 : pH= -Log( [-Cb + ( Cb² + 4Ke)1/2]/2 )
Mélange des acides forts : On le considère comme un acide fort unique (avec CTotal= Ci )
Mélange d’un acide fort et d’un acide faible (càd= C1>=10-6) : pH de celui le fort= -Log( C1 )
MELANGE Des ACIDES : Mélange des acides faibles : pH de l’acide qui l’emporte
Cas particulier : Si Ka1/C1 <= 10-2 et Ka2/C2 <= 10-2 ( [OH-]<<[H3O+] ) : pH= - ½Log( Ka1C1 + Ka2C2 )
Mélange d’un acide faible et Sa base conjuguée (Sol. TAMPON): pH=pKa + Log( Cb/Ca )
ph des solutions salines:
Sel = Acide + Base {qui ont le Même nombre de moles en équivalence}
Sel d’acide fort + Base forte : pH =7
Sel d’acide fort + Base faible : pH= pH d’un acide faible
Sel d’acide faible + Base forte : pH= pH d’une base faible
Sel d’acide faible + Base faible : pH= ½(pka1 + pKa2) = pH des Ampholytes !
Vous aimerez peut-être aussi
- PH Des Solutions de Mélange ConstantineDocument8 pagesPH Des Solutions de Mélange ConstantinendihiraorganisationPas encore d'évaluation
- Série 3: Acides Et BasesDocument30 pagesSérie 3: Acides Et BaseschakiircherfPas encore d'évaluation
- Examen Et Corrigé Du Rattrapage 2018Document4 pagesExamen Et Corrigé Du Rattrapage 2018Dope DaddyPas encore d'évaluation
- Corrigé Série 2Document8 pagesCorrigé Série 2Chk YahyaPas encore d'évaluation
- PDF H3 Corrections ED Acides Bases Sept 2021Document69 pagesPDF H3 Corrections ED Acides Bases Sept 2021Nesrine BenyahiaPas encore d'évaluation
- Exo TDDocument8 pagesExo TDBassirou YacoubaPas encore d'évaluation
- Correction Contrôle ChimieSol (2018 2019)Document8 pagesCorrection Contrôle ChimieSol (2018 2019)Mohamed ChadghanPas encore d'évaluation
- C71 - TP 2 Chimie Minerale Reactions de Complexation: RougeDocument7 pagesC71 - TP 2 Chimie Minerale Reactions de Complexation: RougeMarck CadiilPas encore d'évaluation
- CS Ensa 2020-21Document103 pagesCS Ensa 2020-213freefire 3gamePas encore d'évaluation
- Fiche PHDocument1 pageFiche PHTarek BousfihaPas encore d'évaluation
- PH Des Mélanges D'electrolytes de Meme NatureDocument10 pagesPH Des Mélanges D'electrolytes de Meme NatureSan OrsànPas encore d'évaluation
- Sujet Dexamen Chimie Analytique Et Corrige 2013-2014Document4 pagesSujet Dexamen Chimie Analytique Et Corrige 2013-2014elhidhab2014100% (2)
- Exercices N 5 Et 6Document7 pagesExercices N 5 Et 6ahlemmPas encore d'évaluation
- 14 Corrigé Série 1Document8 pages14 Corrigé Série 1Snaptube 2022Pas encore d'évaluation
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Correction PH 1Document4 pagesCorrection PH 1mnasri.wassoPas encore d'évaluation
- Acide BaseDocument10 pagesAcide BaseAmeni Slimen100% (1)
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 pagesE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Pas encore d'évaluation
- TD2 ChimieDocument3 pagesTD2 ChimieSAMIA AQNOUCHPas encore d'évaluation
- Corrigé Série 2Document7 pagesCorrigé Série 2Doudou SamiPas encore d'évaluation
- 08 Exercice RDM Torsion Simple ArbreDocument4 pages08 Exercice RDM Torsion Simple ArbreAbderrahim SaifiPas encore d'évaluation
- PH ExoDocument35 pagesPH ExoHicham Oublal100% (1)
- Corrigés Des Exo Acides Bases de La Série Dexercice Chimie II 2020 2021Document4 pagesCorrigés Des Exo Acides Bases de La Série Dexercice Chimie II 2020 2021Nesrine KaddouriPas encore d'évaluation
- TAT Équilibre Acido-BasiqueDocument17 pagesTAT Équilibre Acido-Basiquedrakox.fortnitePas encore d'évaluation
- Devoir5 CorrectionDocument8 pagesDevoir5 CorrectionAmen RouissiPas encore d'évaluation
- 15 Corrigé Série 2Document7 pages15 Corrigé Série 2Snaptube 2022Pas encore d'évaluation
- C5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFDocument4 pagesC5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFAzizElheniPas encore d'évaluation
- Travaux Dirigés BIO 141 N°1Document2 pagesTravaux Dirigés BIO 141 N°1Berthe Aristide Ngue Nkongo100% (3)
- Chimie Des Solutions Examens Corriges 3Document7 pagesChimie Des Solutions Examens Corriges 3N'teundjeu Pascal100% (2)
- Chapitre 2 PH Des Solutions Acides BasesDocument26 pagesChapitre 2 PH Des Solutions Acides BasesRottina RossyPas encore d'évaluation
- Equilibres Acido-BasiqueDocument43 pagesEquilibres Acido-BasiqueRiani YosriPas encore d'évaluation
- C SERIE C8. Dosage Acide Base IDocument3 pagesC SERIE C8. Dosage Acide Base IEya MtibaaPas encore d'évaluation
- 2009 Antilles Exo3 Correction EauDistillee PH 4ptsDocument2 pages2009 Antilles Exo3 Correction EauDistillee PH 4ptsHassan El BarakaPas encore d'évaluation
- Chim SolDocument4 pagesChim SolÆm Inē100% (2)
- Dosage TPCoca 0910Document3 pagesDosage TPCoca 0910Mohamed LoukilPas encore d'évaluation
- Acide Base FicheDocument2 pagesAcide Base FicheAnis LekhalPas encore d'évaluation
- Faculté Pluridisciplinaire de Nador SVIDocument4 pagesFaculté Pluridisciplinaire de Nador SVIZakaria AsbaiPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Chap 5 - PRÉCIPITATIONSDocument7 pagesChap 5 - PRÉCIPITATIONSZakariae BennacerPas encore d'évaluation
- Traveaux Dirigés 2Document6 pagesTraveaux Dirigés 2Aymen BaccouchePas encore d'évaluation
- B Equilibres Précipitation Solubilité PowerDocument30 pagesB Equilibres Précipitation Solubilité PowerRecardo0% (1)
- Cor DS24 M2020 FinieDocument5 pagesCor DS24 M2020 Finieelyes othmaniPas encore d'évaluation
- Module Complément de Formation en Chimie Réactions Acido BasiquesDocument29 pagesModule Complément de Formation en Chimie Réactions Acido BasiquesyounesPas encore d'évaluation
- Resumé-Chimie Des SolutionsDocument6 pagesResumé-Chimie Des Solutionsfzsaci26Pas encore d'évaluation
- Corrigé de La Série N°2 - Équilibres Acido-BasiquesDocument7 pagesCorrigé de La Série N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- TD3 Chimie Generale +CORRIGE 2016-2017Document6 pagesTD3 Chimie Generale +CORRIGE 2016-2017Awatif BePas encore d'évaluation
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 pagesCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauPas encore d'évaluation
- Sol 1Document7 pagesSol 1Ouijdane TabtiPas encore d'évaluation
- Acide BaseDocument2 pagesAcide Basefiras ajinaPas encore d'évaluation
- Chapitre 4 - PH Af Et BF - CoursDocument2 pagesChapitre 4 - PH Af Et BF - CoursGODANI PhilippePas encore d'évaluation
- Chapitre 3 - PH AF Et BF - CoursDocument1 pageChapitre 3 - PH AF Et BF - CoursGODANI PhilippePas encore d'évaluation
- Dosage de Acide LactiqueDocument3 pagesDosage de Acide Lactiqueالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Correction Des Exercices Du Chapitre 7: Exercice N° 12 P 143Document2 pagesCorrection Des Exercices Du Chapitre 7: Exercice N° 12 P 143aaraychePas encore d'évaluation
- AciditeDocument9 pagesAciditejranluPas encore d'évaluation
- PBMExamsvcCorrDocument50 pagesPBMExamsvcCorr3freefire 3gamePas encore d'évaluation
- Chapitre 2Document13 pagesChapitre 23freefire 3gamePas encore d'évaluation
- Chapitre 1Document5 pagesChapitre 13freefire 3gamePas encore d'évaluation
- TD1 - EnoncéDocument2 pagesTD1 - Enoncé3freefire 3gamePas encore d'évaluation
- Cours Fonctions Plusieurs Variables DifférentiabilitéDocument54 pagesCours Fonctions Plusieurs Variables Différentiabilité3freefire 3gamePas encore d'évaluation
- Chapitre 1Document25 pagesChapitre 13freefire 3gamePas encore d'évaluation
- TD - TP 1Document1 pageTD - TP 13freefire 3gamePas encore d'évaluation
- Chap 3Document10 pagesChap 33freefire 3gamePas encore d'évaluation
- TP0CDocument2 pagesTP0C3freefire 3gamePas encore d'évaluation
- UntitledDocument9 pagesUntitled3freefire 3gamePas encore d'évaluation
- Chap4 - Partie 1Document16 pagesChap4 - Partie 13freefire 3gamePas encore d'évaluation