Académique Documents
Professionnel Documents
Culture Documents
Chapitre 3 - PH AF Et BF - Cours
Transféré par
GODANI Philippe0 évaluation0% ont trouvé ce document utile (0 vote)
0 vues1 pageTitre original
Chapitre 3_pH AF et BF_Cours
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
0 vues1 pageChapitre 3 - PH AF Et BF - Cours
Transféré par
GODANI PhilippeDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
R1.
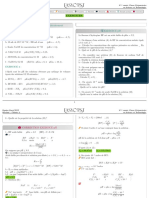
02 : Equilibres en solution aqueuse Chapitre 3 : pH de solutions d’acides et bases forts Cours
TABLEAU RECAPITULATIF (On note [H3O+]=h et [HO-]=)
Monoacide fort Monobase forte
10-6 moℓ.L-1 < Ca < 5.10-2 moℓ.L-1 Ca < 10-6 moℓ.L-1 10-6 moℓ.L-1 < Cb < 5.10-2 moℓ.L-1 Cb < 10-6 moℓ.L-1
h2 – h.Ca – Ke=0 pOH=-ℓog Cb 2 – .Cb – Ke=0
pH=-ℓog Ca ou
(à démontrer) pH=14 + ℓog Cb (à démontrer)
INFLUENCE DE LA DILUTION
Acides forts Bases fortes
pH=1 si dilution 10 entre 5.10-2 M et 10-6 M pH=-1 si dilution 10 entre 5.10-2 M et 10-6
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- 14 Corrigé Série 1Document8 pages14 Corrigé Série 1Snaptube 2022Pas encore d'évaluation
- Série Dexercices Corrigés N°2Document7 pagesSérie Dexercices Corrigés N°2chada100% (1)
- Transformations Associés A Des Reactions Acido Basiques en Solution AqueusesDocument8 pagesTransformations Associés A Des Reactions Acido Basiques en Solution AqueusesJosé Ahanda NguiniPas encore d'évaluation
- TD 9 AB I CorrecDocument4 pagesTD 9 AB I CorrecSoukainaBenBoualamPas encore d'évaluation
- TAT Équilibre Acido-BasiqueDocument17 pagesTAT Équilibre Acido-Basiquedrakox.fortnitePas encore d'évaluation
- Les PH Des Solutions Aqueuses PDFDocument4 pagesLes PH Des Solutions Aqueuses PDFAzizElheniPas encore d'évaluation
- Chapitre 2 PH Des Solutions Acides BasesDocument26 pagesChapitre 2 PH Des Solutions Acides BasesRottina RossyPas encore d'évaluation
- Chapitre 5 PH Des Solutions AqueusesDocument16 pagesChapitre 5 PH Des Solutions AqueusesSyryne DridiPas encore d'évaluation
- CH Gene Cours Chimie en SolutionDocument41 pagesCH Gene Cours Chimie en SolutionAlhassane BahPas encore d'évaluation
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 pagesCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauPas encore d'évaluation
- B Equilibres Précipitation Solubilité PowerDocument30 pagesB Equilibres Précipitation Solubilité PowerRecardo0% (1)
- AciditeDocument9 pagesAciditejranluPas encore d'évaluation
- Ptsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-BasiquesDocument2 pagesPtsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-Basiquesnoamassin78Pas encore d'évaluation
- Série 2 PH (1) - 2021-07-20T143107.674Document30 pagesSérie 2 PH (1) - 2021-07-20T143107.674Abdel OihabPas encore d'évaluation
- Exo TDDocument8 pagesExo TDBassirou YacoubaPas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Exercice Chimie 3Document8 pagesExercice Chimie 3Idris HammouchePas encore d'évaluation
- Faculté Pluridisciplinaire de Nador SVIDocument4 pagesFaculté Pluridisciplinaire de Nador SVIZakaria AsbaiPas encore d'évaluation
- Chap I-3 CSDocument11 pagesChap I-3 CSSimo MaroPas encore d'évaluation
- Methodes de Calcul de PH Des Solutions AqueusesDocument6 pagesMethodes de Calcul de PH Des Solutions AqueusesabalotouadjeiPas encore d'évaluation
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Devoir5 CorrectionDocument8 pagesDevoir5 CorrectionAmen RouissiPas encore d'évaluation
- Cours III Acides - Bases-A. BENAMARDocument60 pagesCours III Acides - Bases-A. BENAMARMed Seghir YounesPas encore d'évaluation
- Chimie Des Solutions AqueusesDocument29 pagesChimie Des Solutions AqueusesJean-Loïc BauchetPas encore d'évaluation
- PDF H3 Corrections ED Acides Bases Sept 2021Document69 pagesPDF H3 Corrections ED Acides Bases Sept 2021Nesrine BenyahiaPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Bac Blanc (Chimie) GSFADocument3 pagesBac Blanc (Chimie) GSFAahmed amilPas encore d'évaluation
- Fichier Produit 2232Document48 pagesFichier Produit 2232FlorinaPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- CS Ensa 2020-21Document103 pagesCS Ensa 2020-213freefire 3gamePas encore d'évaluation
- Série 3: Acides Et BasesDocument30 pagesSérie 3: Acides Et BaseschakiircherfPas encore d'évaluation
- Chapitre 5B Complété Force Des Acides Et Des BasesDocument5 pagesChapitre 5B Complété Force Des Acides Et Des Basesairfann67Pas encore d'évaluation
- TD2 ChimieDocument3 pagesTD2 ChimieSAMIA AQNOUCHPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- Présentation Cours N°6Document13 pagesPrésentation Cours N°6inessPas encore d'évaluation
- ch13 Reaction Chimique Echange ProtonDocument5 pagesch13 Reaction Chimique Echange ProtonSophie RosiPas encore d'évaluation
- 2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Document32 pages2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Malak elPas encore d'évaluation
- Acide BaseDocument14 pagesAcide Baseالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 1-Acides Et Bases PDFDocument2 pages1-Acides Et Bases PDFPAKOU atoyodi lucPas encore d'évaluation
- Reactions Acide-BaseDocument8 pagesReactions Acide-BaseMahmoud GazzahPas encore d'évaluation
- Résumé 2 Chimie Des SolutionsDocument2 pagesRésumé 2 Chimie Des SolutionsLoubna El JehouariPas encore d'évaluation
- Chimie Générale4 PDFDocument50 pagesChimie Générale4 PDFTOUREPas encore d'évaluation
- Corrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1Document7 pagesCorrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1charki zakariaPas encore d'évaluation
- Les Solutions Aqueuses IoniquesDocument18 pagesLes Solutions Aqueuses IoniquesMétatron GamesPas encore d'évaluation
- Correction Exercice Type Bac Dosage Acide BaseDocument3 pagesCorrection Exercice Type Bac Dosage Acide BaseColinePas encore d'évaluation
- Force Des Acides Et BasesDocument4 pagesForce Des Acides Et Basestjmhfkdkd5Pas encore d'évaluation
- Cor DS24 M2020 FinieDocument5 pagesCor DS24 M2020 Finieelyes othmaniPas encore d'évaluation
- C SERIE C8. Dosage Acide Base IDocument3 pagesC SERIE C8. Dosage Acide Base IEya MtibaaPas encore d'évaluation
- Calcul Du PH D'une Solution AqueuseDocument5 pagesCalcul Du PH D'une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- Resumé-Chimie Des SolutionsDocument6 pagesResumé-Chimie Des Solutionsfzsaci26Pas encore d'évaluation
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- A Equilibres Acide Base Power PDFDocument57 pagesA Equilibres Acide Base Power PDFmenin noorPas encore d'évaluation
- 5-Transformations Acide-Base Solution AqueuseDocument4 pages5-Transformations Acide-Base Solution AqueusesdoulajPas encore d'évaluation
- Cours Dosage Acide Base 3Document8 pagesCours Dosage Acide Base 3Boussetta ZouhaierPas encore d'évaluation
- Equilibres Acido-BasiqueDocument43 pagesEquilibres Acido-BasiqueRiani YosriPas encore d'évaluation
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation