Académique Documents
Professionnel Documents
Culture Documents
2018 Rat Exam
Transféré par
douchnaima09Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2018 Rat Exam
Transféré par
douchnaima09Droits d'auteur :
Formats disponibles
Nom : |_|_|_|_|_|_|_|_|_|_|_| N° Examen : |_|_|_|_|
Prénom : |_|_|_|_|_|_|_|_|_|_| CNE : |_|_|-|_|_|_|_|_|_|_|_|
Filière : SMC6 – Module : C H . D E S C R I P T I V E II & C H . D E C O O R D I N A T I O N
Session : R AT T R A P A G E – Date : 11 J U I N 2018 – Durée : 2H00
Chimie descriptive
# TITANE VARIETE
Le Titane existe sous deux variétés allotropiques,
Ti(α) et Ti(β). La variété Ti() stable au-dessus
de 882 °C cristallise dans le réseau C.C. :
▪ Calculer la masse volumique du titane Ti(.
……………………………………………………
……………………………………………………
…………………………………………………… ▪ Calculer son G°(3) et en déduire sa constante
d’équilibre K à 900 K.
▪ Commenter ce dernier résultat et justifier l’utili-
sation du titane dans l’aéronautique par exemple. ……………………………………………………
…………………………………………………… ……………………………………………………
…………………………………………………… ……………………………………………………
Données ▪ Conclusion ?
M(Ti)= 47,90 g/mol ; R(Ti)= 1,44 Å ; ……………………………………………………
(acier)= 7,8 g/cm3 Données : G°(1)= - 384,7 +0,069 T (kJ/mol) ;
# PROCEDE HUNTER
Données Na(l) NaCl(l) Cl2(g)
On étudie la réduction de TiCl4(g) à 900 K en H° kJ/mol 2,64 -385,92 0
traçant le diagramme d'Ellingham relatif aux
chlorures : S° J/K/mol 58,29 95,06 223,0
▪ Ecrire les réactions de chloration des couples
# BICHROMATE
TiCl4 / Ti (1) et NaCl (l) / Na (l) (2) pour une mole de
Cl2 : Le bichromate de potassium K2Cr2O7 est un so-
lide rouge soluble dans l'eau. Un oxydant fort en
(1) → …………………………………………….
solution et à l'état solide.
(2) → …………………………………………….
▪ Dessiner sa forme ……………………………...
▪ Déterminer l’équation G°=f(T) de la réaction (2) Géométrique : ……………………………...
……………………………...
H°(2)= ………………………………………….
▪ Donner sa réaction acido-basique (passage du
S°(2)= ………………………………………….
chromate au bichromate)
G°(2)= …………………………………………. ……………………………………………………
▪ Tracer sur la figure ci-contre les droites G°(1) ▪ Ecrire la demi-réaction d’oxydo-réduction du
et G°(2) entre 800 et 1000 K. couple (Cr2O72-/Cr3+)
▪ Déduire du diagramme, en le justifiant, l'équa- ……………………………………………………
tion (3) de la réaction qui se produira entre ces ré-
actifs dans l’intervalle [800 ; 1000 K]. # CORROSION DU FER
…………………………………………………… ▪ Donner la structure, le nombre de motif et le
…………………………………………………… degré d’oxydation du fer pour les oxydes :
Ch. Descriptive & de Coordination 1/3
Fe1-xO, Fe3O4 et -Fe2O3. ……………………………………………………
Structure Nb. motifs d.o. ……………………………………………………
Fe1-xO
Fe3O4
-Fe2O3
▪ Indiquer et délimiter, par des traits continus
(—), dans le diagramme E-pH ci-dessous, les do-
maines de corrosion, d’immunité et de passivité
du fer (diagramme de Pourbaix).
▪ Quels sont les produits obtenus dans le haut-
fourneau ?
……………………………………………………
▪ Le procédé Martin permet d’obtenir l’acier à
partir de la fonte. Quel est le principe de ce pro-
cédé ? Quel est le taux du carbone dans l’acier ?
# METALLURGIE DU FER ……………………………………………………
▪ Dans la nature, les minerais de fer exploitables ……………………………………………………
sont essentiellement des oxydes et des sulfures. ……………………………………………………
Citer 4 minerais de fer :
▪ Quelle est la composition de l’acier inox 18/8 ?
……………………………………………………
……………………………………………………
……………………………………………………
▪ Quelles sont les matières premières utilisées # FERRITE DE ZINC ZnFe2O4
pour la production de la fonte dans le haut-four- Paramètre de la maille
neau ?
▪ Calculer le paramètre a de la maille de ZnFe2O4
…………………………………………………… à partir de la raie relative au plan réticulaire (311).
…………………………………………………… d (311)=……………………………………………..
▪ Equilibrer les réactions de réduction suivantes a (Å)=…………………………………………….
pour une mole de CO :
Fe2O3 / Fe3O4 : ………………………………….....
Fe3O4 / FeO : ……………………………………… ZnFe
FeO / Fe : ……………………………………….....
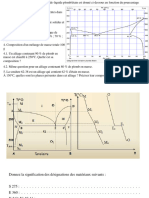
# DIAGRAMME DE CHAUDRON
La superposition du diagramme de Boudouard
(- - -) et de Chaudron (––) en PCO/PT = f(T) per-
met de lire le résultat global de la réduction des
oxydes de fer en présence du carbone et de ses
oxydes (voir figure).
▪ La réduction de FeO en Fe est-elle possible à
1000 K ? Justifier votre réponse.
Ch. Descriptive II & de Coordination 2/3
Dosage des ions ferriques - Dessiner si elles existent les isomères géomé-
triques ou optiques :
Dans une fiole de 250 cm3 on attaque 500 mg du
spinelle par l’acide HCl. La solution contient des Isomères Géométriques
ions Fe3+ et Zn2+. ……………………………………………………
▪ Pourquoi nous avons ajusté le pH à 2,5 lors du ……………………………………………………
dosage des ions Fe3+ ?
……………………………………………………
……………………………………………………
……………………………………………………
……………………………………………………
Isomères optiques
▪ Après dosage d’un échantillon de 10 cm3 de la
solution, on trouve n(Fe3+)= 1,65.10-4 mol. Cal- ……………………………………………………
culer la masse du fer dans la fiole de 250 cm3 : ……………………………………………………
…………………………………………………… ……………………………………………………
…………………………………………………… ……………………………………………………
▪ En déduire le % massique du fer : Q3- En utilisant la théorie du champ cristallin et
…………………………………………………… en justifiant votre réponse, situer l’énergie de
dédoublement o des orbitales d par rapport à
Données : MFe= 55,85 g/mol ; = 1,54 Å
l’énergie d’appariement des électrons de va-
lence de l’ion métallique du composé d) diama-
gnétique.
……………………………………………………
Chimie de coordination ……………………………………………………
……………………………………………………
……………………………………………………
I- Soient les noms des ions complexes ou des Donnée : Z(Co)= 27
composés de coordination suivants :
a) Oxotétrafluoro chromate (III) de potassium ;
II- Pour les ions complexes de Co3+ ci-dessous :
b) Ion hydroxopentaaquo aluminium (III) ;
Q4- Calculer λabs et en déduire la couleur obser-
c) Ion pentacyanocarbonyl ferrate (II) ; vée pour ces ions.
d) Bromure de chloronitrobis(éthylènediamine)
cobalt (III). o abs
Complexe Couleur
(cm-1) (nm)
Q1- Ecrire les formules des ions complexes ou [Co(CN)6]3- 34 129
des composés de coordination ci-dessus.
[Co(NH3)6]3+ 26 315
a) …………………… ; b) ……………………
[Co(NH3)5(SCN)]2+ 21 277
c) ……….…………... ; d) ……………………
[Co(H2O)6]3+ 18 518
Q2- Quelles sont parmi cette liste les isoméries [Co(NH3)4Cl2]+ 14 706
possibles du composé d) ?
Isomérie de liaison Q5- Classer les différents ligands constituants
ces ions complexes, des ligands à champ faible
Isomérie d’hydratation
aux ligands à champ fort.
Isomérie d’ionisation
……………………………………………………
Isomérie de coordination
……………………………………………………
Ch. Descriptive & de Coordination 3/3
Données : Q8- Calculer la valeur de Δo (en cm-1) pour
[Cu(H2O)6]2+ :
Violet Bleu Vert Jaune Orange Rouge
……………………………………………………
380 430 490 560 580 620
(nm) à 430 à 490 à 560 à 580 à 620 à 800 ……………………………………………………
……………………………………………………
III- Les composés CuCr2O4 et CuFe2O4 cristalli- ……………………………………………………
sent tous les deux dans la structure spinelle. Q9- En déduire la valeur de la longueur d’onde
Q6- A quel type de spinelle (SD / SI) appartient en nm, relative au maximum d’absorption de cet
chacun de ces deux oxydes ? ion complexe :
……………………………………………………
> CuCr2O4 : ……………………………………...
……………………………………………………
……………………………………………………
La substitution de H2O par NH3 dans [Cu(H2O)6]2+
……………………………………………………
conduit aux complexes suivants :
……………………………………………………
[Cu(H2O)6-n(NH3)n]2+ :
……………………………………………………
Q10- Quelle est la valeur maximale de n ?
……………………………………………………
……………………………………………………
……………………………………………………
Q11- La valeur calculée de à la question Q8 per-
> CuFe2O4 : ……………………………………... met-elle de rendre compte de la couleur de l’ion
…………………………………………………… complexe [Cu(H2O)6]2+ ?
…………………………………………………… ……………………………………………………
…………………………………………………… ……………………………………………………
…………………………………………………… ……………………………………………………
…………………………………………………… Q12- Lorsque n augmente, on observe un change-
ment de couleur. Donner le sens de variation de :
……………………………………………………
……………………………………………………
Données : Z(Cr) = 24 ; Z(Fe) = 26 ; Z(Cu) = 29
Quelle est la couleur de l’ion complexe lorsque n
prend la valeur maximale ?
IV- L’ion métallique Mn2+ possède la même va-
leur pour l’enthalpie d’hydratation expérimen- ……………………………………………………
tale et calculée. Alors que pour l’ion Cu2+, ces va- ……………………………………………………
leurs sont différentes : ΔH°hyd Exp(Cu2+)= -718 et
ΔH°hyd Cal(Cu2+) = -690 kcal/mol. Q13- Le spectre d’adsorption de tous les ions
[Cu(H2O)6-n(NH3)n]2+ présente une seule bande
Q7- Expliquer pourquoi on observe cette diffé- d’absorption large dans le spectre visible car :
rence entre ces deux ions.
Toutes les autres transitions sont interdites.
> Mn2+ :………………………………………….
Il n’y a qu’une seule transition (t2g)6 (eg)3 →
…………………………………………………… (t2g)5 (eg)4 possible.
…………………………………………………… o (énergie de stabilité) < o (énergie d’appa-
…………………………………………………… riement)
> Cu2+ :…………………………………………. Le champ des ligands (NH3) est supérieur à ce-
lui de (H2O).
……………………………………………………
…………………………………………………… Données : Z(Mn) = 25 ; Z(Cu) = 29
…………………………………………………… Conversion : 1 kcal/mol ≈ 350 cm-1
Ch. Descriptive II & de Coordination 4/3
Vous aimerez peut-être aussi
- Cours Materiaux MetalliquesDocument100 pagesCours Materiaux MetalliquesDjelloul Rezini100% (1)
- Acier Inoxydable DUPLEX PDFDocument2 pagesAcier Inoxydable DUPLEX PDFjosaadPas encore d'évaluation
- 2021 NRDocument4 pages2021 NRdouchnaima09Pas encore d'évaluation
- 2017 Rat ExamDocument3 pages2017 Rat Examdouchnaima09Pas encore d'évaluation
- 2019 Rat ExamDocument4 pages2019 Rat Examdouchnaima09Pas encore d'évaluation
- 2017 NR ExamDocument3 pages2017 NR Examdouchnaima09Pas encore d'évaluation
- 2019 NRDocument4 pages2019 NRdouchnaima09Pas encore d'évaluation
- Ds 2010Document3 pagesDs 2010ESSOME ESSOME OLIVIER STEPHANEPas encore d'évaluation
- Diagrammedelligham Ecc81lecc80veDocument10 pagesDiagrammedelligham Ecc81lecc80veHeba ZerroukPas encore d'évaluation
- Exam PCDocument2 pagesExam PCirgui saidPas encore d'évaluation
- T3 ElèveDocument8 pagesT3 ElèveTHE K1NGPas encore d'évaluation
- Série D'oxydoreduction 1er Bac SC BiofDocument2 pagesSérie D'oxydoreduction 1er Bac SC Biofbenmaleksamir84Pas encore d'évaluation
- DM Oxydo - Réduction BTS Bât Version PDFDocument1 pageDM Oxydo - Réduction BTS Bât Version PDFdelobelPas encore d'évaluation
- ExercicesDocument9 pagesExercicesybenguennyPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2021-2022) MR Fethi JellitiDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2021-2022) MR Fethi JellitichihebPas encore d'évaluation
- Devoir de Contrôle N2 Sciences Physiques 1ère AS 2010 2011 Mme Liala 1Document2 pagesDevoir de Contrôle N2 Sciences Physiques 1ère AS 2010 2011 Mme Liala 1Assel BelgacemPas encore d'évaluation
- Oxydo DossierDocument6 pagesOxydo DossierjeanPas encore d'évaluation
- SMC S3 Ratt 2021Document7 pagesSMC S3 Ratt 2021Abdelhakim BailalPas encore d'évaluation
- SMC s3 Ratt 2017Document8 pagesSMC s3 Ratt 2017Abdelhakim BailalPas encore d'évaluation
- Chemistry - Paper - 2 - HL - French 1Document24 pagesChemistry - Paper - 2 - HL - French 1zicheng wangPas encore d'évaluation
- CC Sur HC Ok - 094340Document4 pagesCC Sur HC Ok - 094340DieuhouPas encore d'évaluation
- Évaluation À Domicile N°2 3AC 2023 2024Document2 pagesÉvaluation À Domicile N°2 3AC 2023 2024mohamedlehardouz157Pas encore d'évaluation
- Chemistry - Paper - 2 - SL - French 3Document16 pagesChemistry - Paper - 2 - SL - French 3zicheng wangPas encore d'évaluation
- Devoir 3 Modele 2 Physique Chimie 3ac Semestre 1Document2 pagesDevoir 3 Modele 2 Physique Chimie 3ac Semestre 1bouthaina taziPas encore d'évaluation
- Devoir de Contrôle 1AS Lycée Pilote by Galaï Abdelhamid Avec Correction PDFDocument5 pagesDevoir de Contrôle 1AS Lycée Pilote by Galaï Abdelhamid Avec Correction PDFTarek BouallegPas encore d'évaluation
- Controle 1 - 25 S1Document2 pagesControle 1 - 25 S1moulay driss100% (1)
- Devoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Document8 pagesDevoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Boubaker ChaabaniPas encore d'évaluation
- 3PCActi Ion TEST 2021 2Document4 pages3PCActi Ion TEST 2021 2Ilan FullBusterPas encore d'évaluation
- Chimie:: L.S. A.T Ksar Gafsa A. S: 2010-2011 Classe: 1S Date: 18/04/2011Document2 pagesChimie:: L.S. A.T Ksar Gafsa A. S: 2010-2011 Classe: 1S Date: 18/04/2011aliPas encore d'évaluation
- Exercice Designiation Des MateriauxDocument1 pageExercice Designiation Des MateriauxSami Khemiri100% (1)
- Controle 2 - 1 S2 PC 1bac FRDocument3 pagesControle 2 - 1 S2 PC 1bac FRAlae AnouarPas encore d'évaluation
- 01 Controle #3 Semestre 2Document6 pages01 Controle #3 Semestre 2JOKER YTPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques - 1ère AS (2021-2022) MR ZAOUAM ABDELHAMID-1Document3 pagesDevoir de Synthèse N°2 - Sciences Physiques - 1ère AS (2021-2022) MR ZAOUAM ABDELHAMID-1firas marsawiPas encore d'évaluation
- Énonce Session Normale Descriptive & Diagramme de Phases 2022-2023Document4 pagesÉnonce Session Normale Descriptive & Diagramme de Phases 2022-2023Ali AtbirPas encore d'évaluation
- Dev Synt2 1ereDocument3 pagesDev Synt2 1ereSahbi Mabrouki YamenPas encore d'évaluation
- Devoir Physique 1 Éme AnnéeDocument5 pagesDevoir Physique 1 Éme Annéedali.info.servicePas encore d'évaluation
- Cnc-Chimie-Mp-19999 DOSAGEDocument5 pagesCnc-Chimie-Mp-19999 DOSAGEAz-eddine KaibaPas encore d'évaluation
- Controle 3 - 1 S2 TC 19 - 20Document4 pagesControle 3 - 1 S2 TC 19 - 20Chaoui YoussefPas encore d'évaluation
- Examen 2014 PDFDocument6 pagesExamen 2014 PDFزهير مزريقيPas encore d'évaluation
- 1 TD 1 Désignation Des MatériauxDocument5 pages1 TD 1 Désignation Des MatériauxnahimPas encore d'évaluation
- 04 QCM Designation Des Materiaux Ferreux PDFDocument3 pages04 QCM Designation Des Materiaux Ferreux PDF97c59gzcy6Pas encore d'évaluation
- EMD - Travail Personnel Corrosion L3 - GP - 2020 - COVID 19Document2 pagesEMD - Travail Personnel Corrosion L3 - GP - 2020 - COVID 19LARDJOUN ElhabibPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2010-2011) Mme Liala 2 PDFDocument4 pagesDevoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2010-2011) Mme Liala 2 PDFNadhir SakouhiPas encore d'évaluation
- Examen Normalisé 2023 - V.ADocument3 pagesExamen Normalisé 2023 - V.Anetflix2p099Pas encore d'évaluation
- 2016 RatDocument3 pages2016 Ratdouchnaima09Pas encore d'évaluation
- SMPC S2 Exam 2016Document4 pagesSMPC S2 Exam 2016Abdelhakim BailalPas encore d'évaluation
- Seq1 4èDocument3 pagesSeq1 4èMineur NdieulaPas encore d'évaluation
- Devoir PC 3college International FR s1 25Document2 pagesDevoir PC 3college International FR s1 25Toni KrossPas encore d'évaluation
- Controle 3 S1 3APIC Mod11 (WWW - Pc1.ma)Document2 pagesControle 3 S1 3APIC Mod11 (WWW - Pc1.ma)46yxqzh4qpPas encore d'évaluation
- Pages Extraites de Examens Corriges Sciences Des MateriauxDocument4 pagesPages Extraites de Examens Corriges Sciences Des MateriauxChokri AtefPas encore d'évaluation
- Centre D Exellence 3 Ac PC PDFDocument2 pagesCentre D Exellence 3 Ac PC PDFazeddinehajjami52Pas encore d'évaluation
- Devoir 1 Modele 9 Physique Chimie 3ac Semestre 1Document2 pagesDevoir 1 Modele 9 Physique Chimie 3ac Semestre 1imad azhariPas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- Devoir de Synthèse N 2: Ministère de L'éducationDocument3 pagesDevoir de Synthèse N 2: Ministère de L'éducationLotfi HmdPas encore d'évaluation
- Calcul Des RoulementDocument12 pagesCalcul Des Roulementyousseftrimech4871Pas encore d'évaluation
- Examens de Chimie de Coordination PDFDocument17 pagesExamens de Chimie de Coordination PDFPower Smox70% (10)
- EVALUATION N1 2023 PCT 3eme-1Document2 pagesEVALUATION N1 2023 PCT 3eme-1salahoud-dine soulayePas encore d'évaluation
- Preparation Synthese 2 2emeDocument6 pagesPreparation Synthese 2 2emeMATOUMBA PAULINPas encore d'évaluation
- Technologie de l’acier: Les Grands Articles d'UniversalisD'EverandTechnologie de l’acier: Les Grands Articles d'UniversalisPas encore d'évaluation
- L' Empire du sacre québécois: Étude sémiolinguistique d'un intensif populaireD'EverandL' Empire du sacre québécois: Étude sémiolinguistique d'un intensif populairePas encore d'évaluation
- Les 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointD'EverandLes 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointÉvaluation : 5 sur 5 étoiles5/5 (1)
- 2016 RatDocument3 pages2016 Ratdouchnaima09Pas encore d'évaluation
- 2016 Rat CRTDocument3 pages2016 Rat CRTdouchnaima09Pas encore d'évaluation
- 2016 NRDocument4 pages2016 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat ExamDocument3 pages2015 Rat Examdouchnaima09Pas encore d'évaluation
- 2015 NRDocument4 pages2015 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat CRTDocument3 pages2015 Rat CRTdouchnaima09Pas encore d'évaluation
- 2as Electrolyte 03 21Document4 pages2as Electrolyte 03 21Abid ElyesPas encore d'évaluation
- ED1 - Thermo Cinetique Atome - 2023 - 2024Document5 pagesED1 - Thermo Cinetique Atome - 2023 - 2024mouhammadhichamPas encore d'évaluation
- Classification Periodique Des Elements 221121 142651Document3 pagesClassification Periodique Des Elements 221121 142651r.c.s ramzichePas encore d'évaluation
- 8759 E4 U43 Bts Crci 2017 Sujet PDFDocument25 pages8759 E4 U43 Bts Crci 2017 Sujet PDFGuy OmangPas encore d'évaluation
- Tableau Periodique ImprimableDocument1 pageTableau Periodique ImprimableghzialePas encore d'évaluation
- Tableau Periodique en 32 Colonnes-2 PagesDocument2 pagesTableau Periodique en 32 Colonnes-2 PagesMANDAGHA NGOUNDZIPas encore d'évaluation
- Feuilletage SciencesDocument14 pagesFeuilletage SciencesAbdoullah OuedraogoPas encore d'évaluation
- Cabl en Acier IdfDocument9 pagesCabl en Acier IdfRachid SmailiPas encore d'évaluation
- D Systemes de Mise A La TerreDocument115 pagesD Systemes de Mise A La TerreElectricité & Instrumentation Gassi TouilPas encore d'évaluation
- Alchimie: de Cuivre À L'orDocument3 pagesAlchimie: de Cuivre À L'orPC Guinea STEAMPas encore d'évaluation
- Tableau Periodique-Noir Et BlancDocument1 pageTableau Periodique-Noir Et BlancdominiquemetPas encore d'évaluation
- Le Zinc ChimiqueDocument2 pagesLe Zinc ChimiqueKeniel EldorPas encore d'évaluation
- 1spe Chap 7 TP Reactions D Oxydoreduction 1Document3 pages1spe Chap 7 TP Reactions D Oxydoreduction 1ZAKARIA EL KHABBABIPas encore d'évaluation
- 3 - 01 - Oligocyclique X5CrNiMo17 12 2Document3 pages3 - 01 - Oligocyclique X5CrNiMo17 12 2bagueneau YOUTUBEPas encore d'évaluation
- Mines Chiffres 2020 PDFDocument14 pagesMines Chiffres 2020 PDFALEXIA MARTEL-DESJARDINSPas encore d'évaluation
- Chapitre - 08 - Identification Des Ions Bilan + ExercicesDocument3 pagesChapitre - 08 - Identification Des Ions Bilan + ExercicesAgnaou MohamedPas encore d'évaluation
- Les Normes AméricainesDocument7 pagesLes Normes AméricainesSid BouhaPas encore d'évaluation
- 9782100725823Document1 page9782100725823anass100% (1)
- Chap 3. Biomatériaux MétalliquesDocument8 pagesChap 3. Biomatériaux MétalliquesAbdou DjelamaPas encore d'évaluation
- LES ELEMENTS CHIMIQUES - Propriétés - Point D'ébullitionDocument2 pagesLES ELEMENTS CHIMIQUES - Propriétés - Point D'ébullitionAmel TrabelsiPas encore d'évaluation
- Energie-Calcul PréhauffageDocument6 pagesEnergie-Calcul Préhauffagemed chabanePas encore d'évaluation
- Dilatation ThermiqueDocument4 pagesDilatation ThermiqueMetidja BilalPas encore d'évaluation
- OMS - NormesQualité A - Eaux-IrrigationDocument2 pagesOMS - NormesQualité A - Eaux-Irrigationabdessadakabdessadak2000Pas encore d'évaluation
- Chapitre5.3-Metaux Dapport Flamme161566 PDFDocument25 pagesChapitre5.3-Metaux Dapport Flamme161566 PDFHassanSobohPas encore d'évaluation
- ZincDocument17 pagesZincmohamedouffaPas encore d'évaluation
- Hasco FutobetetDocument4 pagesHasco FutobetetIstvan NagyPas encore d'évaluation
- Serie 3Document2 pagesSerie 3YouSsra A's0% (1)
- Rapport Des Thematiques 018 - 2024Document2 pagesRapport Des Thematiques 018 - 2024delikiy183Pas encore d'évaluation