Académique Documents
Professionnel Documents
Culture Documents
2021 NR
Transféré par
douchnaima09Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2021 NR
Transféré par
douchnaima09Droits d'auteur :
Formats disponibles
Nom : |_|_|_|_|_|_|_|_|_|_|_|_| N° Examen : |_|_|_|_|
Prénom : |_|_|_|_|_|_|_|_|_|_|_| CNE : |_|_|-|_|_|_|_|_|_|_|_|
Filière : SMC6 – Module : C H . D ESCRI PTI VE II & C H . DE C O O RDI NAT IO N
Session : NORMALE – Date : 21 J UI N 2021 – Durée : 1 H 30
(2) …………………………………………………………….
Chimie descriptive II (0H45)
…………………………………………………………………
Eléments de transition • En déduire l’oxyde obtenu après la réduction de
→ Tableau périodique l’ilménite FeTiO3 à 1 600 K ? Justifier.
• Quelles sont les propositions correctes ? …………………………………………………………………
⬜ quand la période ➚ l‘abondance de l‘élément ➚. …………………………………………………………………
⬜ le fer est l’élément le plus abondant des élé-
→ Structure de TiO2 rutile
ments de transition.
⬜ les éléments de transition se trouvent toujours • nombre motifs par maille :
sous forme d’oxydes. …………………………….......
⬜ leur électronégativité est faible. ………………………………….
→ Propriétés • coordinance des ions :
• Quelles sont les propositions incorrectes ? ………………………………….
⬜ potentiel redox E°(M2+/M) > 0 (en général). ………………………………….
⬜ les éléments du bloc d peuvent avoir jusqu’à 6
degrés d’oxydation différents. → Purification du Ti
⬜ leur moment de spin est : M = √4S(S + 1). La méthode Van Arkel est basée sur la décomposi-
tion thermique d’un composé du métal à purifier.
⬜ leur degrés d’oxydation sont ≥ 0.
• Citer les conditions nécessaires pour appliquer
cette méthode à un métal donné :
Titane
…………………………………………………………………
→ Préparation de TiO2 …………………………………………………………………
1. Décrire les quatre étapes nécessaires pour
• Écrire la réaction de décomposition au contact
préparer l’oxyde TiO2 hydraté à partir de FeTiO3 :
du filament de tungstène et indiquer le % de la
+ (H2SO4/110°C) → …………………………………….. pureté obtenue.
+ (filtration) → …………………………………………… …………………………………………………………………
+ (évaporation) → ………………………………………. …………………………………………………………………
+ (ébullition / excès H2O) → ………………………….
2. FeTiO3 peut être considéré comme l’association Chrome
(FeO ; TiO2). Leurs réactions de réduction sont :
FeO(s) + C(s) ⇄ Fe(s) + CO(g) (1) → Propriétés acido-basiques :
TiO2(s) + 2C(s) ⇄ Ti(s) + 2CO(g) (2) • Cr2O3 hydraté : …………………………………………
• Donner l’expression des constantes K(1) et K(2) : …………………………………………………………………
………………………………………………………………… • Cr2O3 anhydre : ……………………………………......
• A 1 600 K, si PCO (éq(1)) = 1,5×103 et PCO (éq(2)) = …………………………………………………………………
4,95×10-3 bar, calculer alors G°(1) et G°(2) : → Réduction de Cr2O3 par l’hydrogène
(1) ……………………………………………………………. • Écrire l’équation de réduction de Cr2O3 par H2 :
………………………………………………………………… …………………………………………………………………
L’enthalpie et l’entropie de cette réaction à 1300 K • Quelles sont parmi les demi-branches notées
sont : ∆H°= 414 kJ.mol-1 ; ∆S°= 141 J.K-1.mol-1 (a, b, c, d), celles qui sont instables ? justifier.
• Calculer ∆G° de la réaction à 1 300 K et inter- …………………………………………………………………
préter son signe :
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
Quelle est alors la réaction (3) d’oxydation à en-
• Calculer la température d’inversion à partir de visager dans ce domaine d’instabilité ?
laquelle la réaction devient possible :
…………………………………………………………………
…………………………………………………………………
• Déduire l’équation de la droite G°(3)=f(T) à
…………………………………………………………………
partir des G° des réactions (1) et (2) :
• La constante de la réduction de Cr 2O3 par
…………………………………………………………………
l’aluminium est K1300=1,6×1019. Comparer et
conclure : • Calculer G°(3) à T=500 K :
………………………………………………………………… …………………………………………………………………
…………………………………………………………………
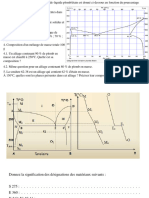
• Tracer, en ligne continue, les branches stables
de G°(1), G°(2) et G°(3) et compléter le dia-
Fer gramme en indiquant les différents domaines de
→ Corrosion du fer stabilité du carbone et de ses oxydes.
• Donner la structure, le nombre de motifs et le
degré d’oxydation du fer pour les oxydes ci-dessous : Données ∆G°(1) = -221 – 179×10-3 T
(kJ.mol-1) ∆G°(2) = -566 + 174×10-3 T
Oxyde Structure Nb motifs d.o.
-Fe2O3 → Métallurgie du fer
Fe3O4
• Dans la nature, les minerais de fer exploitables
FeO sont essentiellement des oxydes et des sulfures.
Citer 4 minerais de fer :
→ Diagramme d’Ellingham du carbone …………………………………………………………………
En métallurgie, les oxydes du fer, sont réduits
• Equilibrer les réactions de réduction suivantes
par CO. Ci-dessous le diagramme d’Ellingham du
pour une mole de CO :
carbone et ses oxydes sur lequel sont représen-
tées (en pointillées) les droites G°(1) du couple Fe2O3 / Fe3O4 : ……………………………………………
CO(g)/C(s) et G°(2) du couple CO2(g)/CO(g).
Fe3O4 / FeO : ………………………………………………
FeO / Fe : …………………………………………………..
• Écrire les réactions d’oxydation relatives aux
couples (1) et (2) ramenées à une mole d’oxygène :
…………………………………………………………………
…………………………………………………………………
Chimie de coordination (0H45) c) ……………………………………………………………..
…………………………………………………………………
I. On considère les noms des composés de coor-
…………………………………………………………………
dination suivants :
a) hexacyano ferrate (II) de potassium b. Calculer le moment magnétique des com-
b) hexacyano ferrate (III) de fer et de potassium plexes a), b) et c) en considérant que les ions de
fer ont une configuration bas spin.
c) tris(hexacyano ferrate (II)) de fer
a) ……………………………………………………………..
1. Donner les différentes formules (en précisant
…………………………………………………………………
le degré d’oxydation du fer) pour les complexes :
a) …………………………………………………………….. …………………………………………………………………
b) ……………………………………………………………. b) ……………………………………………………………..
Pour le complexe c), il y a 3 formules possibles : …………………………………………………………………
c1, c2 et c3, sachant que le fer est à l’état d’ion …………………………………………………………………
Fe2+ et / ou Fe3+.
c1) ……………………………………………………………
c1) ……………………………………………………………
…………………………………………………………………
c2) ……………………………………………………………
…………………………………………………………………
c3) ……………………………………………………………
…………………………………………………………………
2. En appliquant la théorie de la liaison de va- …………………………………………………………………
lence, préciser l’état d’hybridation du fer dans
ces complexes. …………………………………………………………………
a) …………………………………………………………….. c2) ……………………………………………………………
………………………………………………………………… …………………………………………………………………
………………………………………………………………… …………………………………………………………………
b) …………………………………………………………….. c3) ……………………………………………………………
………………………………………………………………… …………………………………………………………………
………………………………………………………………… …………………………………………………………………
c) …………………………………………………………….. …………………………………………………………………
………………………………………………………………… …………………………………………………………………
………………………………………………………………… …………………………………………………………………
c. En supposant que la constante de Curie du
3. En appliquant la théorie du champ cristallin :
composé de coordination c) est égale à C = 0,75
a. Calculer le moment magnétique des ions déduire les degrés d’oxydation qui existent dans
complexes des complexes a), b) et c). ce complexe et écrire la formule de ce dernier.
a) ……………………………………………………………..
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
b) ……………………………………………………………..
…………………………………………………………………
…………………………………………………………………
………………………………………………………………… On donne : Z(Fe) = 26
II. Soit l’ion complexe suivant : III. Soit l’ion complexe [Ni(H2O)6]2+, on substi-
[Co(NH3)3(NS)3]2+ tue toutes les molécules H2O par :
1. Représenter les différents types d’isomérie - les ions CN-, on obtient l’ion complexe A.
que peut avoir cet ion en supposant que les deux
- les ions F-, on obtient l’ion complexe B.
ligands sont monodentate :
1. En utilisant la théorie du champ cristallin,
………………………………………………………………… discuter la stabilité des ions complexes A et B et
………………………………………………………………… donner leurs formules :
………………………………………………………………… A : ……………………………………………………………
………………………………………………………………… …………………………………………………………………
En appliquant la théorie du champ cristallin et …………………………………………………………………
sachant que l’énergie d’appariement (de …………………………………………………………………
couplage) =28 000 cm-1 pour les électrons de
l’ion Co2+ et que Dq=2 500 cm-1. B : ……………………………………………………………
2. Donner la répartition des électrons sur les …………………………………………………………………
orbitales d du cobalt : …………………………………………………………………
………………………………………………………………… 2. Le spectre d’absorption du composé A pré-
………………………………………………………………… sente une bande d’absorption :
………………………………………………………………… a. Quelle est l’origine de cette bande ?
…………………………………………………………………
3. Le spectre d’absorption de cet ion complexe
présente une seule bande d’absorption, …………………………………………………………………
expliquer l’origine de cette bande.
b. Calculer (Å) du maximum d’absorption, sa-
………………………………………………………………… chant que la valeur de Dq=3200 cm-1:
………………………………………………………………… …………………………………………………………………
4. On substitue toutes les NH3 par des ions CN-, …………………………………………………………………
on obtient l’ion complexe A qui est différent par
On donne : Z(Ni) = 28
sa couleur et sa géométrie du complexe de départ.
a. Donner la formule de l’ion complexe A :
…………………………………………………………………
b. Expliquer pourquoi on a ce changement de
couleur et donner le sens de variation de
…………………………………………………………………
…………………………………………………………………
c. Expliquer pourquoi on a un changement de la
géométrie de l’ion complexe A :
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
On donne : Z(Co) = 27
Vous aimerez peut-être aussi
- 2017 Rat ExamDocument3 pages2017 Rat Examdouchnaima09Pas encore d'évaluation
- 2019 Rat ExamDocument4 pages2019 Rat Examdouchnaima09Pas encore d'évaluation
- 2017 NR ExamDocument3 pages2017 NR Examdouchnaima09Pas encore d'évaluation
- 2018 Rat ExamDocument4 pages2018 Rat Examdouchnaima09Pas encore d'évaluation
- 2019 NRDocument4 pages2019 NRdouchnaima09Pas encore d'évaluation
- T3 ElèveDocument8 pagesT3 ElèveTHE K1NGPas encore d'évaluation
- Ds 2010Document3 pagesDs 2010ESSOME ESSOME OLIVIER STEPHANEPas encore d'évaluation
- DM Oxydo - Réduction BTS Bât Version PDFDocument1 pageDM Oxydo - Réduction BTS Bât Version PDFdelobelPas encore d'évaluation
- Diagrammedelligham Ecc81lecc80veDocument10 pagesDiagrammedelligham Ecc81lecc80veHeba ZerroukPas encore d'évaluation
- Exam PCDocument2 pagesExam PCirgui saidPas encore d'évaluation
- Chapitre - 08 - Identification Des Ions Bilan + ExercicesDocument2 pagesChapitre - 08 - Identification Des Ions Bilan + ExercicesAgnaou MohamedPas encore d'évaluation
- Exam HamzaDocument2 pagesExam Hamzakasnaoui23Pas encore d'évaluation
- 3AC-Série Prépa #7 - OctobDocument3 pages3AC-Série Prépa #7 - Octobak.anas.emailPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2021-2022) MR Fethi JellitiDocument2 pagesDevoir de Contrôle N°2 - Sciences Physiques - 1ère AS (2021-2022) MR Fethi JellitichihebPas encore d'évaluation
- ExercicesDocument9 pagesExercicesybenguennyPas encore d'évaluation
- Oxydo DossierDocument6 pagesOxydo DossierjeanPas encore d'évaluation
- Exercice Designiation Des MateriauxDocument1 pageExercice Designiation Des MateriauxSami Khemiri100% (1)
- Structure de La Matiere A Echelle MacroscopiqueDocument1 pageStructure de La Matiere A Echelle Macroscopiquemhaouek100% (1)
- Controle 1 - 25 S1Document2 pagesControle 1 - 25 S1moulay driss100% (1)
- Classification - Electrochimique 3scDocument2 pagesClassification - Electrochimique 3scRiadh MarouaniPas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- SMC S3 Ratt 2021Document7 pagesSMC S3 Ratt 2021Abdelhakim BailalPas encore d'évaluation
- Matériaux Amorphe Ou Cristallisés - ExercicesDocument3 pagesMatériaux Amorphe Ou Cristallisés - ExercicesphysikcollegePas encore d'évaluation
- Iaisaouiyan Pdfrevision3emeDocument10 pagesIaisaouiyan Pdfrevision3emeozzyofallPas encore d'évaluation
- Devoir Physique 1 Éme AnnéeDocument5 pagesDevoir Physique 1 Éme Annéedali.info.servicePas encore d'évaluation
- S1 EXO 3 3APIC (WWW - Pc1.ma)Document5 pagesS1 EXO 3 3APIC (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- 1 TD 1 Désignation Des MatériauxDocument5 pages1 TD 1 Désignation Des MatériauxnahimPas encore d'évaluation
- Devoir de Contrôle N2 Sciences Physiques 1ère AS 2010 2011 Mme Liala 1Document2 pagesDevoir de Contrôle N2 Sciences Physiques 1ère AS 2010 2011 Mme Liala 1Assel BelgacemPas encore d'évaluation
- TP 15 1s9 Notion de Reaction ChimiqueDocument2 pagesTP 15 1s9 Notion de Reaction ChimiquesaanounPas encore d'évaluation
- Devoir 1 Modele 9 Physique Chimie 3ac Semestre 1Document2 pagesDevoir 1 Modele 9 Physique Chimie 3ac Semestre 1imad azhariPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques - 1ère AS (2013-2014) MR Mesrati AliDocument2 pagesDevoir de Synthèse N°2 - Sciences Physiques - 1ère AS (2013-2014) MR Mesrati AliimedPas encore d'évaluation
- 2STM Eleve T1 PDFDocument59 pages2STM Eleve T1 PDFHanane TounsiPas encore d'évaluation
- Devoir 3 Modele 2 Physique Chimie 3ac Semestre 1Document2 pagesDevoir 3 Modele 2 Physique Chimie 3ac Semestre 1bouthaina taziPas encore d'évaluation
- Chapitre 08 IdentificationDocument2 pagesChapitre 08 IdentificationAgnaou MohamedPas encore d'évaluation
- Examens de Chimie de Coordination PDFDocument17 pagesExamens de Chimie de Coordination PDFPower Smox70% (10)
- Controle 1 - 11 S1 3AC InterDocument2 pagesControle 1 - 11 S1 3AC InteryounesPas encore d'évaluation
- Controle 3 S1 3APIC Mod11 (WWW - Pc1.ma)Document2 pagesControle 3 S1 3APIC Mod11 (WWW - Pc1.ma)46yxqzh4qpPas encore d'évaluation
- Série D'oxydoreduction 1er Bac SC BiofDocument2 pagesSérie D'oxydoreduction 1er Bac SC Biofbenmaleksamir84Pas encore d'évaluation
- Devoir PC 3college International FR s1 25Document2 pagesDevoir PC 3college International FR s1 25Toni KrossPas encore d'évaluation
- SMPC S2 Exam 2016Document4 pagesSMPC S2 Exam 2016Abdelhakim BailalPas encore d'évaluation
- Ds IPDocument2 pagesDs IPAb DouPas encore d'évaluation
- 1spe Chap 7 TP Reactions D Oxydoreduction 1Document3 pages1spe Chap 7 TP Reactions D Oxydoreduction 1ZAKARIA EL KHABBABIPas encore d'évaluation
- Examne Locale 1 - Janvier 2023Document2 pagesExamne Locale 1 - Janvier 2023Home erriahiPas encore d'évaluation
- 05 Controle #3 Semestre 1Document2 pages05 Controle #3 Semestre 1hoissinekhadija59Pas encore d'évaluation
- Controle 2 - 2 S1 3AC InterDocument3 pagesControle 2 - 2 S1 3AC InterAssia AchhabePas encore d'évaluation
- Chapitre - 08 - Identification Des Ions Prof - Boujnane (WWW - Pc1.ma)Document3 pagesChapitre - 08 - Identification Des Ions Prof - Boujnane (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- Les HalogènesDocument35 pagesLes HalogènesKrim Issam Eddine100% (4)
- Devoir de Contrôle N°3 - Sciences Physiques - 1ère AS (2010-2011) MR Adam Bouali 2Document3 pagesDevoir de Contrôle N°3 - Sciences Physiques - 1ère AS (2010-2011) MR Adam Bouali 2Mariem MouPas encore d'évaluation
- Examen Normalisé 2023 - V.ADocument3 pagesExamen Normalisé 2023 - V.Anetflix2p099Pas encore d'évaluation
- Chp3 Th1 3e Transf Chim O2 Doc Eleve 21 22Document5 pagesChp3 Th1 3e Transf Chim O2 Doc Eleve 21 22Kenzo ScipionPas encore d'évaluation
- Examen Local 8 Physique Chimie 3ac Sujet 1Document3 pagesExamen Local 8 Physique Chimie 3ac Sujet 1Hbn S'hra100% (1)
- SMC s3 Ratt 2017Document8 pagesSMC s3 Ratt 2017Abdelhakim BailalPas encore d'évaluation
- Dev Synt2 1ereDocument3 pagesDev Synt2 1ereSahbi Mabrouki YamenPas encore d'évaluation
- 04 QCM Designation Des Materiaux Ferreux PDFDocument3 pages04 QCM Designation Des Materiaux Ferreux PDF97c59gzcy6Pas encore d'évaluation
- Devoir de Synthèse N°3 - Physique - 1ère AS (2009-2010) MR Daassi Dellali Mlle HammamiDocument2 pagesDevoir de Synthèse N°3 - Physique - 1ère AS (2009-2010) MR Daassi Dellali Mlle HammamiKadri FawziPas encore d'évaluation
- Réactions D'oxydoréductionDocument15 pagesRéactions D'oxydoréductionAya PubgPas encore d'évaluation
- SAJIB5 - 1703373836101 - Série D'exercices 5 Test D'identificationDocument4 pagesSAJIB5 - 1703373836101 - Série D'exercices 5 Test D'identificationwijdanellyryyPas encore d'évaluation
- Technologie de l’acier: Les Grands Articles d'UniversalisD'EverandTechnologie de l’acier: Les Grands Articles d'UniversalisPas encore d'évaluation
- Les 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointD'EverandLes 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointÉvaluation : 5 sur 5 étoiles5/5 (1)
- 2016 RatDocument3 pages2016 Ratdouchnaima09Pas encore d'évaluation
- 2016 Rat CRTDocument3 pages2016 Rat CRTdouchnaima09Pas encore d'évaluation
- 2016 NRDocument4 pages2016 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat ExamDocument3 pages2015 Rat Examdouchnaima09Pas encore d'évaluation
- 2015 NRDocument4 pages2015 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat CRTDocument3 pages2015 Rat CRTdouchnaima09Pas encore d'évaluation
- Le Labfab de Rennes 2012-2013: DiaporamaDocument14 pagesLe Labfab de Rennes 2012-2013: DiaporamalabfabfrPas encore d'évaluation
- Symfony2 Un Tutoriel Pour Debuter Avec Le Framework Symfony2Document200 pagesSymfony2 Un Tutoriel Pour Debuter Avec Le Framework Symfony2Bryan Fury JimmyPas encore d'évaluation
- Antennes - Techniques PDFDocument47 pagesAntennes - Techniques PDFMANERERPas encore d'évaluation
- Spe645 Annexe2 22-1 1063862Document20 pagesSpe645 Annexe2 22-1 1063862tpolenorPas encore d'évaluation
- Achar2Bases de Calcul de lEC3Document19 pagesAchar2Bases de Calcul de lEC3Omar OmarPas encore d'évaluation
- Gestion Budgétaire: Contrôle BudgetaireDocument25 pagesGestion Budgétaire: Contrôle BudgetaireKhansaa HaroudPas encore d'évaluation
- Bibliographie Stress Au Travail 2017-10-27Document15 pagesBibliographie Stress Au Travail 2017-10-27mael bikoroPas encore d'évaluation
- La Mise en Forme PFE-1Document3 pagesLa Mise en Forme PFE-1pfePas encore d'évaluation
- التمدد الحضري و الحراك التنقلي في النطاق الحضري لمدينة سطيفDocument11 pagesالتمدد الحضري و الحراك التنقلي في النطاق الحضري لمدينة سطيفhoulahilaPas encore d'évaluation
- Physique-du-globe-et-meteorologie-Alphonse Berget-1904 PDFDocument379 pagesPhysique-du-globe-et-meteorologie-Alphonse Berget-1904 PDFAnonymous 4MLEo9TVQPas encore d'évaluation
- 1990 - Jeammaud A. - La Règle de Droit Comme Modèle PDFDocument18 pages1990 - Jeammaud A. - La Règle de Droit Comme Modèle PDFGuyMoquette100% (1)
- Personal SkillsDocument11 pagesPersonal SkillsAgathe GrenonPas encore d'évaluation
- SwingDocument33 pagesSwingKarim KarimPas encore d'évaluation
- Chapitre1 Méthodes Et Moyens de Lutte Et Lutte IntégréeDocument6 pagesChapitre1 Méthodes Et Moyens de Lutte Et Lutte Intégréemayline pyramidePas encore d'évaluation
- Rapport de Stage Complete Sur La Gestion Des Opérations de CréditDocument44 pagesRapport de Stage Complete Sur La Gestion Des Opérations de Créditrogerkom.profsPas encore d'évaluation
- Les Mille Visages de L IndianOceanieDocument110 pagesLes Mille Visages de L IndianOceanieAli Abbas100% (1)
- Rouleaux PACK - VRACDocument54 pagesRouleaux PACK - VRACZaarad ZakariaPas encore d'évaluation
- Présentation Leader 2Document14 pagesPrésentation Leader 2Rosine PergamentPas encore d'évaluation
- Achat Et AaproDocument33 pagesAchat Et AaproOualid BelbrikPas encore d'évaluation
- Energie EolienneDocument51 pagesEnergie Eoliennedalila AMMARPas encore d'évaluation
- ReclamationDocument1 pageReclamationBoukidi AminePas encore d'évaluation
- 3sc ds1Document44 pages3sc ds1wala.ayhemPas encore d'évaluation
- DT2022-18 Document Travail Grille de DensiteDocument26 pagesDT2022-18 Document Travail Grille de Densitefrederic amadonPas encore d'évaluation
- Sup de Cours Education Et InstructionDocument7 pagesSup de Cours Education Et InstructionRolfo FlrPas encore d'évaluation
- Processeur M MoireDocument66 pagesProcesseur M Moiresayedyoussef390Pas encore d'évaluation
- Les Exercices de La Methode SilvaDocument11 pagesLes Exercices de La Methode Silvaعرفان باهر100% (8)
- Schema-Cablage-Renault-4 Modeles-1964-1966Document2 pagesSchema-Cablage-Renault-4 Modeles-1964-1966John Baker Silva MoncaleanoPas encore d'évaluation
- Achouri Amira NouhaDocument135 pagesAchouri Amira NouhaEmmanuel AvegnonPas encore d'évaluation
- Consignes Leadership-Seance 1 - DefinitionDocument1 pageConsignes Leadership-Seance 1 - DefinitionAmadou BarryPas encore d'évaluation
- Traité de Psychopathologie de L'adulte - Narcissisme Et Dépression by Catherine ChabertDocument440 pagesTraité de Psychopathologie de L'adulte - Narcissisme Et Dépression by Catherine ChabertFrank Eric Ciatchoua Ngoundjo100% (7)