Académique Documents
Professionnel Documents
Culture Documents
2017 NR Exam
Transféré par
douchnaima09Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2017 NR Exam
Transféré par
douchnaima09Droits d'auteur :
Formats disponibles
Nom : |_|_|_|_|_|_|_|_|_|_|_| N° Examen : |_|_|_|_|
Prénom : |_|_|_|_|_|_|_|_|_|_| CNE : |_|_|-|_|_|_|_|_|_|_|_|
Filière : SMC6 – Module : CH. DESCRIPTIVE II & CH. DE COORDINATION
Session : NORMALE – Date : 29 MAI 2017 – Durée : 2H00 (CM+TP)
Questions QCM → Cocher une seule case par question.
Chimie descriptive II (0H45) 4 → Industrie du titane
- Citer trois industries par ordre d’importance dans
Éléments bloc d lesquelles le titane est employé :
………………………………………………………………………..
………………………………………………………………………..
………………………………………………………………………..
5 → Oxyde TiO
- Une de ces propositions concernant TiO n’est pas
vraie. Laquelle ?
1 → Variation des rayons des cations M2+ N'est pas un véritable oxyde.
- Donner l’explication de la variation des rayons des Structure de type NaCl.
éléments de transition M2+ en 4 temps. C’est une dissolution de Ti dans la maille CFC de
……………………………………………………………………….. l’oxygène.
……………………………………………………………………….. Le composé est doublement lacunaire.
………………………………………………………………………..
CHROME
2 → Propositions
6 → Dichromate de potassium
- Quelle est la proposition incorrecte ? - Donner les étapes de décomposition thermique de
Le manganèse peut avoir jusqu’à 6 degrés d’oxy- K2Cr2O7 en Cr2O3 :
………………………………………………………………………..
dation différents.
………………………………………………………………………..
L’ordre d’abondance (A) des métaux titane,
Chrome et fer est le suivant : AFe > ACr > ATi. 7 → Chromate de potassium
Le fer dans certains composés peut avoir des de- - Une de ces affirmations est fausse :
grés d’oxydation : d>0, d<0 ou d=0.
CrO42- est de couleur jaune.
Les éléments de transition ne se trouvent pas
toujours sous forme d’oxydes. CrO42- ↔ Cr2O72- sont en équilibre acido-basique.
Peut s’obtenir par décomposition thermique :
TITANE K2Cr2O7 → K2CrO4.
3 → Oxyde TiO2 L’ion chromate est majoritaire en milieu acide.
- Décrire les quatre étapes nécessaires pour prépa- 8 → Utilisation du chrome
rer l’oxyde TiO2 hydraté à partir de FeTiO3.
……………………………………………………………………….. - Citer quatre domaines d’utilisation du chrome en
s’appuyant sur les caractéristiques suivantes :
………………………………………………………………………..
. augmente la dureté et la robustesse…
………………………………………………………………………..
. résistant à la corrosion et brillant…
………………………………………………………………………..
. point de fusion élevé, structure cristalline stable…
- Dessiner la structure de TiO2 rutile et donner le
. intervient dans les procédés industriels…
nombre de motif par maille et la coordinance des
ions. ………………………………………………………………………..
……………………………………………………………………….. ………………………………………………………………………..
Z= ………………………………………………………………….. ………………………………………………………………………..
Coordinance : …………………………………………………… ………………………………………………………………………..
Ch. Descriptive & de Coordination 1/4
Fer - Quelles sont les deux demi-branches instables (do-
maine) ? Justifier votre réponse.
9 → Corrosion ………………………………………………………………………..
- Parmi les méthodes de protection des pièces mé- ………………………………………………………………………..
talliques du fer, une méthode ne permet pas d’em- ………………………………………………………………………..
pêcher la corrosion du fer. Laquelle ?
- Ecrire alors la réaction d’oxydation du nouvel équi-
Chromatation Passivation
libre (d) dans ce domaine de température :
Isolement Galvanisation ………………………………………………………………………..
10 → Protection - Tracer sur le diagramme (en trait continu) les
Le minium de plomb Pb3O4 (PbII & PbIV) est utilisé branches stables et la demi-droite (d) en indiquant
pour protéger le métal fer. les domaines de stabilité des différentes espèces.
- Donner les deux demi-réactions d’oxydoréduction Donnée : G°(d)= -564 +0,170 T kJ/mol.
des couples (Pb3O4/PbO) et (FeO/Fe) et la réaction
globale : 12 → Réduction de Fe3O4 en FeO
……………………………………………………………………….. - Écrire l'équation de réduction de Fe3O4 en en FeO :
……………………………………………………………………….. ………………………………………………………………………..
……………………………………………………………………….. - A l'aide des données, établir l'expression de l'en-
- Déduire la composition de la couche d’oxydes qui thalpie libre standard G°(T) de cette réaction :
protège le métal : ………………………………………………………………………..
………………………………………………………………………..
- Calculer la constante d’équilibre à 700 K. Conclure.
Données ………………………………………………………………………..
E°(Pb3O4/PbO)= +0,5 V ; E°(FeO/Fe)= -0,4 V ………………………………………………………………………..
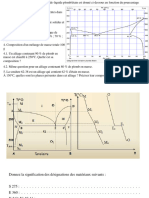
11 → Diagramme d’Ellingham Données
O2
On s’intéresse aux couples : FeO/Fe (a), Fe3O4/FeO CO(s) → CO2(s) → °G1= -566 +0,173 T
(b) et Fe2O3/Fe3O4 (c).
O2
FeO(s) → Fe3O4(s) → °G2= -660 +0,291 T
(c)
Chimie de coordination (0H45)
I - Soient les complexes et l’ion complexe suivants :
(b) a- [CoCl2(en)2]Cl,2H2O ; b- [Cu(C2O4)(en)2] ;
c- Na[NiCl3(H2O)] ; d- [(H2O)5Co-O-O-Co(NH3)5]4+
(a) Q1- Donner les noms de ces espèces :
a- …………………………………………………………………
b- …………………………………………………………………
c- …………………………………………………………………
d- …………………………………………………………………
Q2- Donner les différents types d’isoméries pour les
trois premiers composés :
- Ecrire les réactions d’oxydation (ramenées à une
mole d’oxygène) correspondant aux différents a- isomérie d’ionisation, b- isomérie géomé-
couples (a), (b) et (c). trique, c- isomérie d’ionisation
……………………………………………………………………(a) a- isomérie d’hydratation, b- isomérie optique,
……………………………………………………………………(b) c- pas d’isomérie
……………………………………………………………………(c) a- isomérie cis-trans, b- pas d’isomérie,
Les droites représentatives des couples (a) et (b) c- isomérie d’ionisation
tracées en pointillées sur le diagramme, se coupent a- isomérie d’ionisation, b- isomérie de liaison,
en un point Te (voir diagramme) : c- isomérie géométrique
Ch. Descriptive & de Coordination 2/4
Q3- En appliquant la théorie de la liaison de va- . Ion B : …………………………………………………………….
lence, déterminer l’état d’hybridation du métal pour ………………………………………………………………………..
les différents composés sachant que exp(a)= 0,
………………………………………………………………………..
exp(b)= 1,7 et exp(c)= 0 MB :
Q8- Lors de la réaction, on observe un changement
a- sp3d2 ; b- sp3d2 ; c- dsp2 de couleur de l’ion complexe. L’origine de cette co-
a- sp3d2 ; b- sp3 ; c- dsp2 loration est la transition de l’électron de :
a- d2sp3 ; b- dsp2 ; c- sp3d2 eg vers t2g t2g vers eg
a- sp3d2 ; b- dsp2 ; c- sp3 dxz vers dxy dx2-y2 vers dz2
données : Z(Co)= 27 ; Z(Ni)= 28 ; Z(Cu)= 29 Q9- Expliquer pourquoi on a ce changement de cou-
leur. Donner le sens de variation de :
II - Un solide A rose possède une formule générale ………………………………………………………………………..
de CoCl3.5NH3.H2O. Une solution de ce sel est
………………………………………………………………………..
également rose et donne rapidement 3 moles
d'AgCl par réaction avec AgNO3. ………………………………………………………………………..
Quand ce solide est chauffé, il perd une molécule Q10- L’ion complexe A est oxydé, il donne l’ion
d'eau pour donner un solide B pourpre avec les complexe C, écrire la formule de C et calculer son
mêmes composés : NH3 ; Cl et Co. moment magnétique :
………………………………………………………………………..
Q4- Donner les formules et les noms des deux com- ………………………………………………………………………..
posés A et B :
………………………………………………………………………..
Composé A : .……………………………………………………
Q11- L’ion complexe C est différent de A non seule-
……………………………………………………………………….. ment par sa formule et sa propriété magnétique
Composé B : .…………………………………………………… mais aussi par sa coloration et sa géométrie.
……………………………………………………………………….. Expliquer pourquoi ?
. Coloration : ……………………………………………………..
III - On considère l’ion complexe A formé entre le
………………………………………………………………………..
manganèse, l’ion chlorure et l’ion glycinate
NH2CH2COO- de formule [MnCl2(NH2CH2COO)2]2- et . Géométrie : …..………………………………………………..
qui possède un moment magnétique (A)= 5,9 MB. ………………………………………………………………………..
Par action d’ions cyanures CN-, l’ion complexe A est Donnée : Z(Mn) = 25
converti en un ion complexe B dont l’analyse donne
comme formule brute [C6H4N5O2Mn]3- et qui pos- IV – Energie de stabilisation (Es)
sède un moment magnétique (B)= 1,7 MB. Q12- En utilisant Es, on montre que le spinelle
FeCr2O4 est un :
Q5- Indiquer comment s’effectue la coordination
entre Mn et l’ion glycinate ? Spinelle intermédiaire Spinelle inverse
Le glycinate se lie au Mn par un doublet de N et Spinelle direct Spinelle lacunaire
un doublet de O. Données : Z(Cr)= 24 ; Z(Fe)= 26
Le glycinate se lie au Mn par un doublet de O et
V – Constante de Curie
un doublet de O-.
Le glycinate se lie au Mn par un doublet de N, un Al2O3 possède la même structure que Ti2O3.
doublet de O et un doublet de O-. Q13- Indiquer la formule de la solution solide de
Le glycinate se lie au Mn par un doublet de N et substitution pouvant exister entre ces deux compo-
un doublet de O-. sés (0 ≤ x ≤ 1) :
Al2-2xTixO3 Al2-xTixO3
Q6- Donner la formule de l’ion complexe B :
Al2-xTi2xO3 Al2-2xTi2xO3
………………………………………………………………………..
Q7- En appliquant la théorie du champ cristallin, Q14- Donner l’expression de la constante de Curie
établir le diagramme d’énergie des orbitales d du C de cette solution solide en fonction de x :
manganèse dans ces deux ions complexes : ………………………………………………………………………..
. Ion A : …..……………………………………………………….. ………………………………………………………………………..
……………………………………………………………………….. ………………………………………………………………………..
……………………………………………………………………….. Données : Z(Al)= 13 ; Z(Ti)= 22
Ch. Descriptive & de Coordination 3/4
Vous aimerez peut-être aussi
- Technologie de l’acier: Les Grands Articles d'UniversalisD'EverandTechnologie de l’acier: Les Grands Articles d'UniversalisPas encore d'évaluation
- Traité d'économétrie financière: Modélisation financièreD'EverandTraité d'économétrie financière: Modélisation financièrePas encore d'évaluation
- Introduction À La Métallurgie ExtractiveDocument23 pagesIntroduction À La Métallurgie ExtractiveMourad Ezz100% (2)
- Refroidissement de Composants ÉlectroniqueDocument35 pagesRefroidissement de Composants ÉlectroniqueYassine Aallalou100% (1)
- 2STM Eleve T1 PDFDocument59 pages2STM Eleve T1 PDFHanane TounsiPas encore d'évaluation
- Les 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointD'EverandLes 4 piliers de la destinée: L'astrologie chinoise expliquée point par pointÉvaluation : 5 sur 5 étoiles5/5 (1)
- Unité 3. Les Materiaux Et Leurs PropriétésDocument12 pagesUnité 3. Les Materiaux Et Leurs Propriétésanafinfo100% (2)
- MatériauxDocument13 pagesMatériauxYass Ine100% (1)
- Belot André - Culture Potagère ModerneDocument431 pagesBelot André - Culture Potagère ModerneDavid92350Pas encore d'évaluation
- Catalog Recondi Sectoriel 2015Document280 pagesCatalog Recondi Sectoriel 2015atisz333Pas encore d'évaluation
- 1-Caractéristiques Des Matériaux PDFDocument7 pages1-Caractéristiques Des Matériaux PDFHanane TounsiPas encore d'évaluation
- 2STM EXERCICES ProcédésDocument19 pages2STM EXERCICES ProcédésImane DrihemPas encore d'évaluation
- Experiences de Chimie - Aspects Pedagogiques Et Sequences D'enseignement - Capes - Capet - AgregationDocument544 pagesExperiences de Chimie - Aspects Pedagogiques Et Sequences D'enseignement - Capes - Capet - AgregationAmadou Soufi Diallo100% (1)
- 2021 NRDocument4 pages2021 NRdouchnaima09Pas encore d'évaluation
- 2019 Rat ExamDocument4 pages2019 Rat Examdouchnaima09Pas encore d'évaluation
- 2017 Rat ExamDocument3 pages2017 Rat Examdouchnaima09Pas encore d'évaluation
- 2018 Rat ExamDocument4 pages2018 Rat Examdouchnaima09Pas encore d'évaluation
- 2019 NRDocument4 pages2019 NRdouchnaima09Pas encore d'évaluation
- T3 ElèveDocument8 pagesT3 ElèveTHE K1NGPas encore d'évaluation
- Matériaux Amorphe Ou Cristallisés - ExercicesDocument3 pagesMatériaux Amorphe Ou Cristallisés - ExercicesphysikcollegePas encore d'évaluation
- Exam PCDocument2 pagesExam PCirgui saidPas encore d'évaluation
- Diagrammedelligham Ecc81lecc80veDocument10 pagesDiagrammedelligham Ecc81lecc80veHeba ZerroukPas encore d'évaluation
- 1 TD 1 Désignation Des MatériauxDocument5 pages1 TD 1 Désignation Des MatériauxnahimPas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- Caractéristiques de Quelques Matériaux CommunDocument6 pagesCaractéristiques de Quelques Matériaux CommunAnonymous 9qKdViDP4Pas encore d'évaluation
- Ds 2010Document3 pagesDs 2010ESSOME ESSOME OLIVIER STEPHANEPas encore d'évaluation
- Exam HamzaDocument2 pagesExam Hamzakasnaoui23Pas encore d'évaluation
- Exercice Designiation Des MateriauxDocument1 pageExercice Designiation Des MateriauxSami Khemiri100% (1)
- Oxydo DossierDocument6 pagesOxydo DossierjeanPas encore d'évaluation
- ExercicesDocument9 pagesExercicesybenguennyPas encore d'évaluation
- Controle 1 - 25 S1Document2 pagesControle 1 - 25 S1moulay driss100% (1)
- Série 6 3ACDocument4 pagesSérie 6 3AChamza elkarmiPas encore d'évaluation
- 04 QCM Designation Des Materiaux Ferreux PDFDocument3 pages04 QCM Designation Des Materiaux Ferreux PDF97c59gzcy6Pas encore d'évaluation
- S6 Tests D'identifiDocument1 pageS6 Tests D'identifiAgnaou MohamedPas encore d'évaluation
- Examen Local 8 Physique Chimie 3ac Sujet 1Document3 pagesExamen Local 8 Physique Chimie 3ac Sujet 1Hbn S'hra100% (1)
- Correction Exam 2020 FR Prof - Omari (WWW - Pc1.ma)Document2 pagesCorrection Exam 2020 FR Prof - Omari (WWW - Pc1.ma)Raghib MohamedPas encore d'évaluation
- Classification - Electrochimique 3scDocument2 pagesClassification - Electrochimique 3scRiadh MarouaniPas encore d'évaluation
- Série 7 3ACDocument3 pagesSérie 7 3AChamza elkarmiPas encore d'évaluation
- S1 EXO 3 3APIC (WWW - Pc1.ma)Document5 pagesS1 EXO 3 3APIC (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- DM Oxydo - Réduction BTS Bât Version PDFDocument1 pageDM Oxydo - Réduction BTS Bât Version PDFdelobelPas encore d'évaluation
- EXAMEN MDD Ratrrapage Master 2 en 23Document2 pagesEXAMEN MDD Ratrrapage Master 2 en 23kadere83Pas encore d'évaluation
- SMC S3 Ratt 2021Document7 pagesSMC S3 Ratt 2021Abdelhakim BailalPas encore d'évaluation
- Examne Locale 1 - Janvier 2022Document2 pagesExamne Locale 1 - Janvier 2022Mohamed gadmyPas encore d'évaluation
- Examen Local 4 Physique Chimie 3ac CorrigeDocument2 pagesExamen Local 4 Physique Chimie 3ac CorrigeMohamed LamsaafPas encore d'évaluation
- Iso 12944-4Document27 pagesIso 12944-4Youssef EL MIRPas encore d'évaluation
- Devoir 2 Modele 1 Physique Chimie 3ac Semestre 1Document2 pagesDevoir 2 Modele 1 Physique Chimie 3ac Semestre 1safae amerPas encore d'évaluation
- Examne Locale 1 - Janvier 2023Document2 pagesExamne Locale 1 - Janvier 2023Home erriahiPas encore d'évaluation
- Catalogue Inox 2014Document40 pagesCatalogue Inox 2014Zackaria El IdrissiPas encore d'évaluation
- Série D'oxydoreduction 1er Bac SC BiofDocument2 pagesSérie D'oxydoreduction 1er Bac SC Biofbenmaleksamir84Pas encore d'évaluation
- Examen Normalisé 2023 - V.ADocument3 pagesExamen Normalisé 2023 - V.Anetflix2p099Pas encore d'évaluation
- Réactions D'oxydoréductionDocument15 pagesRéactions D'oxydoréductionAya PubgPas encore d'évaluation
- 2017 NR CRCDocument3 pages2017 NR CRCdouchnaima09Pas encore d'évaluation
- Chemistry - Paper - 2 - HL - French 1Document24 pagesChemistry - Paper - 2 - HL - French 1zicheng wangPas encore d'évaluation
- Fonderie Et Moulage Des Alliages de CuivreDocument11 pagesFonderie Et Moulage Des Alliages de Cuivrefranck rogerPas encore d'évaluation
- ABDEDOU NazimDocument88 pagesABDEDOU NazimRyad100% (2)
- T 3 CorrosionDocument7 pagesT 3 Corrosioncelia bgrnPas encore d'évaluation
- L6 Tests D'identification de QuelquesDocument2 pagesL6 Tests D'identification de QuelquesAgnaou MohamedPas encore d'évaluation
- Énonce Session Normale Descriptive & Diagramme de Phases 2022-2023Document4 pagesÉnonce Session Normale Descriptive & Diagramme de Phases 2022-2023Ali AtbirPas encore d'évaluation
- 2016 RatDocument3 pages2016 Ratdouchnaima09Pas encore d'évaluation
- Ds PhysiqueDocument4 pagesDs PhysiqueLamya LoukiliPas encore d'évaluation
- Examen 15 - 3AC FR 2019 - 2020Document2 pagesExamen 15 - 3AC FR 2019 - 2020abdoPas encore d'évaluation
- 3e Cntphy 2013 11 26Document6 pages3e Cntphy 2013 11 26Matthieu MoredPas encore d'évaluation
- Elaboration Des Métaux Ferreurs: I. GénéralitésDocument7 pagesElaboration Des Métaux Ferreurs: I. GénéralitésCHERIFPas encore d'évaluation
- 2016 RatDocument3 pages2016 Ratdouchnaima09Pas encore d'évaluation
- 2016 Rat CRTDocument3 pages2016 Rat CRTdouchnaima09Pas encore d'évaluation
- 2016 NRDocument4 pages2016 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat ExamDocument3 pages2015 Rat Examdouchnaima09Pas encore d'évaluation
- 2015 NRDocument4 pages2015 NRdouchnaima09Pas encore d'évaluation
- 2015 Rat CRTDocument3 pages2015 Rat CRTdouchnaima09Pas encore d'évaluation
- CompDéfini MG ZNDocument4 pagesCompDéfini MG ZNChikov ÆminePas encore d'évaluation
- Réactions de Quelques Matériaux Avec L'air P.khouya (WWW - Pc1.ma)Document1 pageRéactions de Quelques Matériaux Avec L'air P.khouya (WWW - Pc1.ma)gtPas encore d'évaluation
- Meca SolDocument18 pagesMeca SolWiam Elk100% (1)
- IP IK Classification LocauxDocument1 pageIP IK Classification LocauxSylvain DenisPas encore d'évaluation
- Arpin THESEDocument154 pagesArpin THESEliliPas encore d'évaluation
- Dta CLTDocument50 pagesDta CLTedonPas encore d'évaluation
- Applications Charbon ActifDocument3 pagesApplications Charbon ActifKhaoula ZefanePas encore d'évaluation
- Traitement Air Interieur Evaluation Innocuite Systemes Par Photocatalyse 201703 RapportDocument124 pagesTraitement Air Interieur Evaluation Innocuite Systemes Par Photocatalyse 201703 RapportDaniel NguyễnPas encore d'évaluation
- TD HPLC Énoncé EtuDocument6 pagesTD HPLC Énoncé EtuDiallo Katy100% (1)
- Composés Oxygènés: Première S - LMCM'BAYE - Année Scolaire: 2013 - 2014Document2 pagesComposés Oxygènés: Première S - LMCM'BAYE - Année Scolaire: 2013 - 2014DavePas encore d'évaluation
- TP 1 MessureDocument15 pagesTP 1 Messurewalid djouzaPas encore d'évaluation
- ETA Macalloy 1030Document36 pagesETA Macalloy 1030jeff_56Pas encore d'évaluation
- 1 - Transformation Spontanées Dans Le Piles Et Production D'énergieDocument7 pages1 - Transformation Spontanées Dans Le Piles Et Production D'énergieTaha BoulmanePas encore d'évaluation
- Chapitre 4Document10 pagesChapitre 4Hamza TliliPas encore d'évaluation
- TP ConductimetrieDocument1 pageTP ConductimetrieIndai apekoPas encore d'évaluation
- Série. Les Lois de La Réaction ChimiqueDocument2 pagesSérie. Les Lois de La Réaction ChimiqueAyoub EchahelPas encore d'évaluation
- Rap KetarraDocument10 pagesRap Ketarraayoub opéraPas encore d'évaluation
- Spe-2 1 1-PluiesAcidesDocument3 pagesSpe-2 1 1-PluiesAcidesMohamed DahmanePas encore d'évaluation
- Section NementDocument34 pagesSection NementLorenzo CirrincionePas encore d'évaluation
- Mud LoggingDocument15 pagesMud Loggingحسام الدين100% (1)
- FREHAUT 2001 Composition Biochimique MangueDocument65 pagesFREHAUT 2001 Composition Biochimique MangueRai AwakePas encore d'évaluation
- La SiliceeDocument16 pagesLa Siliceemaher mzoughiPas encore d'évaluation
- SDS BOule Cal 3 MLDocument3 pagesSDS BOule Cal 3 MLInna FaridahPas encore d'évaluation
- Techniques de ConcentrationDocument57 pagesTechniques de Concentrationsami aida80% (5)
- Rapport PFE "Etude Thermique Et Réalisation D'un Humidificateur À Ruissellement D'eauDocument74 pagesRapport PFE "Etude Thermique Et Réalisation D'un Humidificateur À Ruissellement D'eauKhalid Ahyeoud100% (4)