Académique Documents
Professionnel Documents
Culture Documents
CH 1 Diagrammes D'equilibres Métalliques (v1.1)
Transféré par
Chokri AtefTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
CH 1 Diagrammes D'equilibres Métalliques (v1.1)
Transféré par
Chokri AtefDroits d'auteur :
Formats disponibles
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
Diagrammes dquilibre des alliages binaires
1. Introduction
Un alliage mtallique est compos dun mtal de base (constituant) (prsent en trs grande
proportion) et de un ou plusieurs autres mtaux (ou non mtaux comme le carbone) appel(s)
lment(s) dalliage.
Mtal de base et lments dalliage constituent un alliage.
Si lalliage mtallique est compos dun mtal de base et dun seul autre lment dalliage,
lalliage est dit binaire. Exemples : les alliages Fer-Carbone, Titane-Aluminium, Cuivre-Zinc,
Cuivre-Etain,
En ralit, les alliages industriels contiennent trs souvent plus de deux lments dalliages,
dont certains sont de trs faibles proportions.
Lalliage mtallique est caractris par sa composition chimique.
Celle-ci est dfinie par la concentration des diffrents lments. Ces concentrations peuvent
tre exprimes en % massique (%m) ou en % atomique (%at).
2. Les solutions
solides
Il y a deux types de
solutions solides :
les solutions
solides dinsertion
qui se forment lorsque les atomes dlment dalliage sont de taille suffisamment
petite pour pouvoir se loger dans les sites interstitiels du rseau du mtal de base;
0,41.dA< dB <0,59.dA
Solution solides dinsertion
P 1 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
les solutions solides de substitution qui se forment lorsque les atomes dlment
dalliage sont de taille sensiblement identique celle des atomes du mtal de base; dans
ce cas, ils se substituent aux atomes du rseau du rseau du mtal de base.
Les atomes ne pouvant tre dissous dans la solution (1) du fait de la solubilit limite, vont
former une seconde solution (2). Elle sera naturellement riche en lments dalliage avec trs
certainement des atomes du mtal de base en insertion ou en substitution. On observera alors
une microstructure constitue dune multitude de grains des deux solutions (constituants).
0,85.dA< dB <1,15.dA
Solution solide de substitution
Compos dfinie :
Dans certains cas, les atomes ne pouvant tre dissous dans la solution (1) vont former
avec les atomes du mtal de base un compos chimique appel aussi compos intermtallique
(2). Ces composs intermtalliques sont caractriss par une composition chimique prcise
et une structure cristalline souvent complexe.
Un exemple typique de ce genre de composs intermtalliques est celui que lon retrouve
dans le systme mtastable fer-carbone : le carbure de fer Fe3C appel galement Cmentite.
Sa structure cristalline est orthorhombique avec un atome de carbone au sommet dune
pyramide de base triangulaire quilatrale dont les coins sont occups par les atomes de fer.
P 2 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
Phase :
Lorsque la solubilit en lment dalliage est limite, on observe donc soit deux solutions
solides soit une solution solide et un compos intermtallique. Ces solutions ou composs
sont appels phases et lalliage est dit biphas. Chaque phase est caractrise par sa
composition chimique et sa structure cristalline. Ces phases sont rparties uniformment sous
forme de grains. Entre ces grains, on retrouve des interfaces appeles joints de grains,
caractriss par un certain dsordre cristallin.
3. Construction exprimentale des diagrammes de solidification
Il existe des logiciels qui permettent dtablir ces diagrammes partir de calculs
thermodynamiques, la mthode la plus courante pour les construire reste cependant
exprimentale : lanalyse thermique simple.
Lanalyse thermique consiste enregistrer lvolution temprature au cur dun chantillon
au cours de son refroidissement (trs lent lorsque lon tudie les transformations dquilibre).
3.1. Courbes de refroidissement
Pour un corps pur, la solidification se fait temprature constante. La courbe de
refroidissement prsente un palier.
Pour un alliage, la solidification se fait temprature variable.
3.2. Construction dun diagramme dquilibre
P 3 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
On trace les courbes de refroidissement dune srie dalliages binaires A-B et on porte, en
fonction des diffrentes compositions de A et de B, les tempratures de dbut et de fin de
solidification. On obtient ainsi lensemble du diagramme de solidification de lalliage A-B.
Lensemble des points de dbut de solidification constituent une courbe appele : Liquidus.
Lensemble des points de fin de solidification constituent une courbe appele : Solidus.
Les deux courbes liquidus et solidus dterminent trois domaines :
A haute temprature un domaine monophas liquide ;
A basse temprature un domaine monophas solide ;
A des tempratures intermdiaires un domaine biphas liquide + solide.
Exemple : diagramme dquilibre Cuivre-Nickel (Cu-Ni)
4. Familles des digrammes
4.1. Les diagrammes miscibilit totale
Cela signifie que les mtaux A et B sont miscible en toute proportion ltat solide. On
obtient une seule solution solide, quelle que soit la quantit de mtal B incorpore au
mtal A.
P 4 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
4.1.1.
Cours : matriaux mtalliques
Les diagrammes un seul fuseau
Exemples de diagrammes un seul fuseau : Cu-Ni, Cu-Pd, Ag-Au, Ag-Pd,
4.1.2.
Les diagrammes deux fuseaux
Exemples de diagrammes un deux fuseaux : Sb-As, Fe-Cr, Au-Cu, Cu-Mn,
4.2. Les diagrammes miscibilit partielle
Reprsente la grosse majorit des alliages binaires. Il nexiste pas de miscibilit en toute
proportion de A et B. cette partialit implique la prsence de deux solutions solides, notes
et .
Le domaine biphas + est ncessairement born de chaque cot par les domaines
monophass et . Les frontires entre ces domaines monophass et le domaine biphas ne
portent aucun nom particulier.
Le diagramme ainsi obtenu est appel diagramme eutectique. Le point dintersection des
liquidus est appel point eutectique et lalliage CE% de B alliage eutectique.
5. Rgles de lecture du diagramme
Pour dterminer les compositions et les proportions des phases prsentes on utilise les rgles
de lhorizontale et des segments inverses.
A la temprature Ti, lalliage de concentration C0 en B est compos de deux phases : liquide +
solide.
P 5 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
La phase liquide est compose de CL% en B et (100 CL%) en A.
La phase solide est compose de CS% en B et (100 CS%) en A.
Le % de la phase liquide est
Le % de la phase solide est
6. tude des diagrammes de phase
Prenons comme exemple dtude le diagramme Pb-Sn.
P 6 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
P 7 / 10
Cours : matriaux mtalliques
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
P 8 / 10
Cours : matriaux mtalliques
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
Applications
Rappel :
La constitution d'un alliage est dcrite par :
la composition globale (% massique ou % atomique)
le nombre de phases
la composition de chaque phase
la fraction massique de chaque phase
Un alliage est en quilibre si cette constitution n'volue pas avec le temps (pas de
transformations de phases liquides en solides ou inversement).
Le diagramme d'quilibre ou diagramme de phases, prsente graphiquement les
constitutions d'un alliage en quilibre.
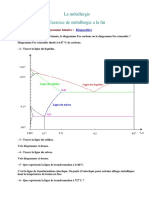
Exercice 1
1. Quelle est la miscibilit des deux corps Pb et Sn (totale ou partielle)?
2. Dfinir une phase.
3. Combien
de
phases
C
comporte ce diagramme ?
Quelles sont ces phases ?
4. Quelles sont les lignes
Solidus, liquidus, Solvus ?
A
5. Quelle est la solubilit du Pb
dans (Sn) ? quelle
E
B
D
temprature ?
6. Quelle est la solubilit
maximale de Sn dans (Pb) ?
quelle temprature ?
7. Quelle est la concentration
eutectique ?
8. Quelle est la concentration
massique de Sn qui donne
O
F
20% (Pb) et 80% (Sn)
150C?
9. quelle est le pourcentage de
liquide et de (Sn) la
temprature 200C.
10. L'une des utilisations des alliages Pb-Sn est le soudage des composants
lectronique (ce procd d'assemblage appel brasage). Ces composants
peuvent tre endommags si on utilise un alliage temprature leve.
Quelle est la composition de l'alliage la plus convenable pour cette application.
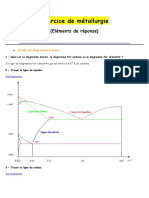
Exercice 2
On vous donne le diagramme Pb-Sn reprsent par la figure 1. on considre un
alliage de composition globale 50%m Pb et 50% m Sn temprature 150C.
1- combien de phases on a dans cette constitutions ? Quelles sont ces phases?
2- Quelle est la solubilit maximale du Pb dans la phase (Sn) 150C?
3- Quelle est la solubilit maximale du Sn dans la phase (Pb) 150C?
4-Quelle est la fraction massique des phases (Pb) et de (Sn)?
5- reprsenter la microstructure de cette constitution.
P 9 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
ISET de MAHDIA - Licence professionnelle en Gnie Mcanique
Cours : matriaux mtalliques
Exercice 3
Mmes questions pour temprature = 200 C et %m Pb = 50 %.
Exercice 4 :
Complter le tableau suivant :
Composition
N
%m Pb
%m Sn
Nombre de
phases
Solubilits
en %mPb
dans (Sn)
Solubilits
en %mPb
dans (Pb)
%m (Sn)
%m (Pb)
La temprature est de 200C
P 10 / 10
K. ZID - M. MBAREK M.W. LANDOLSI
Vous aimerez peut-être aussi
- Introduction à la physique de la matièreD'EverandIntroduction à la physique de la matièreÉvaluation : 3 sur 5 étoiles3/5 (1)
- MatériauxDocument8 pagesMatériauxMohamed SnoussiPas encore d'évaluation
- Métal Amorphe: Le verre métallique mince du futur ressemble à du papier d'aluminium, mais essayez de le déchirer, ou voyez si vous pouvez le couper, de toute votre puissance, pas de chanceD'EverandMétal Amorphe: Le verre métallique mince du futur ressemble à du papier d'aluminium, mais essayez de le déchirer, ou voyez si vous pouvez le couper, de toute votre puissance, pas de chancePas encore d'évaluation
- Elements de ReponsesDocument9 pagesElements de ReponsesjaouyaPas encore d'évaluation
- Explication Du Diagramme de Phase Fer-Carbone (With Graphs) INGENIERIE MECANIQUEDocument9 pagesExplication Du Diagramme de Phase Fer-Carbone (With Graphs) INGENIERIE MECANIQUEWalid Ben AmirPas encore d'évaluation
- K Diagramme de Phase PDFDocument6 pagesK Diagramme de Phase PDFSmail BenidirPas encore d'évaluation
- Simulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysD'EverandSimulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysPas encore d'évaluation
- Examen M1CMM20192020 CorrectionDocument1 pageExamen M1CMM20192020 CorrectionAnes MeraziPas encore d'évaluation
- Fonderie D3 SolidificationDocument67 pagesFonderie D3 SolidificationAmine Saidi100% (2)
- MetauxDocument13 pagesMetauxDarel NadjieraPas encore d'évaluation
- MQ17 Chap4 Metaux Alliages 1.0.0Document25 pagesMQ17 Chap4 Metaux Alliages 1.0.0GOUAREF SAMIR100% (2)
- Traitement Thermique Des Aciers PDFDocument66 pagesTraitement Thermique Des Aciers PDFaboumoussaPas encore d'évaluation
- 2 Elaboration Des Metaux FerreuxDocument55 pages2 Elaboration Des Metaux FerreuxZakari YaePas encore d'évaluation
- Materiaux MetalliquesDocument32 pagesMateriaux Metalliquesزهير مزريقيPas encore d'évaluation
- Aaaaa PDFDocument50 pagesAaaaa PDFKim Palacio100% (2)
- 1 Binaires RDocument100 pages1 Binaires ROuday Chikhaoui100% (1)
- 05 Trait ThermDocument51 pages05 Trait ThermRamzi MansouriPas encore d'évaluation
- Compte Rendu TTHDocument11 pagesCompte Rendu TTHAbdelkhalek SaidiPas encore d'évaluation
- TPE Science de Materiaux ENIMDocument20 pagesTPE Science de Materiaux ENIMWassim Ben Salah0% (1)
- Designatin Des MateriauxDocument6 pagesDesignatin Des MateriauxMohsen SaidiPas encore d'évaluation
- (Tec) (CO) Traitements Thermiques PDFDocument11 pages(Tec) (CO) Traitements Thermiques PDFLina Ben amorPas encore d'évaluation
- TP1Document12 pagesTP1Firass ChafaiPas encore d'évaluation
- Métaux Non FerreuxDocument6 pagesMétaux Non Ferreuxkebbab faroukPas encore d'évaluation
- Presentation MateriauxDocument27 pagesPresentation MateriauxBARNABAS KOUASSIPas encore d'évaluation
- TPE 2020 Matériaux Métalliques V EtudiantDocument13 pagesTPE 2020 Matériaux Métalliques V EtudiantDerouich RahmaPas encore d'évaluation
- Chapitre 2 Designation Des MetauxDocument5 pagesChapitre 2 Designation Des MetauxhammouPas encore d'évaluation
- Élaboration Des MetauxDocument23 pagesÉlaboration Des MetauxdayangPas encore d'évaluation
- Chap 5 Traitement Thermiques Des Aciers - Trempe Et Revenu - 2018Document28 pagesChap 5 Traitement Thermiques Des Aciers - Trempe Et Revenu - 2018Wissem El'MissaouiPas encore d'évaluation
- 82 B1 MP1 DiagrammesDocument18 pages82 B1 MP1 DiagrammesanassPas encore d'évaluation
- Chap 2 Liaisons Atomiques NewDocument31 pagesChap 2 Liaisons Atomiques NewNapsterPas encore d'évaluation
- Structures Metallographiques Des AciersDocument4 pagesStructures Metallographiques Des Aciersmichel_bnjPas encore d'évaluation
- TD1 Exercice Acier. Et FonteDocument6 pagesTD1 Exercice Acier. Et FontehakimkorichiPas encore d'évaluation
- TP de MateriauDocument24 pagesTP de MateriaubourabahPas encore d'évaluation
- Diagramma Fer-Carbone PDFDocument23 pagesDiagramma Fer-Carbone PDFFred VitafizzPas encore d'évaluation
- METALLURGIE20 Converti PDFDocument33 pagesMETALLURGIE20 Converti PDFMohamed mellahPas encore d'évaluation
- Chapitre II - Traitement Thermique Des AciersDocument47 pagesChapitre II - Traitement Thermique Des AciersHeni Elhaj SalahPas encore d'évaluation
- Micro StructureDocument8 pagesMicro StructureJari LahcenPas encore d'évaluation
- Revenu Des AciersDocument5 pagesRevenu Des AciersNour KheninePas encore d'évaluation
- Les AciersDocument89 pagesLes AciersImad achlih100% (1)
- Chapitre 5 Diagramme de Phases de Corps Purs-1Document10 pagesChapitre 5 Diagramme de Phases de Corps Purs-1Rayen Jlassi100% (1)
- 2 Trempe PDFDocument2 pages2 Trempe PDFMouad Ouahbi100% (1)
- Cours Matériaux Et Structures Partie 2 PDFDocument35 pagesCours Matériaux Et Structures Partie 2 PDFMoudi Bouhlel100% (1)
- Corrigé MetallurgieDocument4 pagesCorrigé MetallurgieKengheu KevinPas encore d'évaluation
- Chapitre2 Diagramme de PhaseDocument22 pagesChapitre2 Diagramme de PhaseOussama El BouadiPas encore d'évaluation
- Examen Traitement Surface 2020Document4 pagesExamen Traitement Surface 2020HOUSSAME NAIMPas encore d'évaluation
- Examen M1CMM20192020 - 2 CorrectionDocument1 pageExamen M1CMM20192020 - 2 CorrectionAnes MeraziPas encore d'évaluation
- Plan Cours Cours Materiaux MetalliquesDocument5 pagesPlan Cours Cours Materiaux MetalliquesAssãt ÀîssātPas encore d'évaluation
- Application Diagramme D Quilibre SDMDocument1 pageApplication Diagramme D Quilibre SDMBø ÑyPas encore d'évaluation
- 8-Solidification Des AlliagesDocument3 pages8-Solidification Des AlliagesPierre MackenziePas encore d'évaluation
- Cours 2 Theorie Des Alliages Binaires Diagrammes D'équilibreDocument21 pagesCours 2 Theorie Des Alliages Binaires Diagrammes D'équilibreslimane taleb bahmedPas encore d'évaluation
- Durete 1 PDFDocument2 pagesDurete 1 PDFamrPas encore d'évaluation
- Cours ACIERS DE CONSTRUCTIONDocument5 pagesCours ACIERS DE CONSTRUCTIONCarmen AdlerPas encore d'évaluation
- Materiaux MetalliquesDocument58 pagesMateriaux MetalliquesDjm AlgPas encore d'évaluation
- Métallurgie Des MétauxDocument11 pagesMétallurgie Des MétauxLoulou rifiaPas encore d'évaluation
- Chap. 3-Alliages & Défauts Des MétauxDocument3 pagesChap. 3-Alliages & Défauts Des MétauxBénédicte & Christophe MULLERPas encore d'évaluation
- 2STM EXERCICES ProcédésDocument19 pages2STM EXERCICES ProcédésImane DrihemPas encore d'évaluation
- Alliages Binaires Isep Promo 4 À Envoyer Aux ÉtudiantsDocument11 pagesAlliages Binaires Isep Promo 4 À Envoyer Aux Étudiantslombacke309Pas encore d'évaluation
- Mini-Projets de Thermo-Des Matériaux - BisDocument12 pagesMini-Projets de Thermo-Des Matériaux - BisderbessPas encore d'évaluation
- TP FAO Eficn FraisageDocument5 pagesTP FAO Eficn FraisageChokri AtefPas encore d'évaluation
- Tutorial Catia v5R19Document70 pagesTutorial Catia v5R19Chokri AtefPas encore d'évaluation
- TP PionDocument3 pagesTP PionChokri AtefPas encore d'évaluation
- 1 Dossier TechniqueDocument2 pages1 Dossier TechniqueChokri AtefPas encore d'évaluation
- A3035 PDFDocument16 pagesA3035 PDFChokri AtefPas encore d'évaluation
- Pages Extraites de Examens Corriges Sciences Des MateriauxDocument4 pagesPages Extraites de Examens Corriges Sciences Des MateriauxChokri AtefPas encore d'évaluation
- Correction Sujet 4Document9 pagesCorrection Sujet 4Chokri Atef0% (3)
- TD 3 Loi Entrée Sortie Par Fermeture GéométriqueDocument4 pagesTD 3 Loi Entrée Sortie Par Fermeture GéométriqueChokri AtefPas encore d'évaluation
- 2 Dessin D'ensembleDocument1 page2 Dessin D'ensembleChokri AtefPas encore d'évaluation
- Video 14 PDFDocument9 pagesVideo 14 PDFChokri AtefPas encore d'évaluation
- Page de Garde SDMDocument1 pagePage de Garde SDMChokri AtefPas encore d'évaluation
- 40 DS Moulage 2016 2017Document4 pages40 DS Moulage 2016 2017Chokri Atef67% (3)
- 6464 TP Distributeur Doc EleveDocument11 pages6464 TP Distributeur Doc EleveChokri AtefPas encore d'évaluation
- PDFDocument6 pagesPDFChokri AtefPas encore d'évaluation
- Tournage PDFDocument45 pagesTournage PDFChokri AtefPas encore d'évaluation
- TournageDocument13 pagesTournageChokri AtefPas encore d'évaluation
- Devoir de Contrôle N°2 - Technologie - Bridage - 3ème Technique (2015-2016) MR Mnejja SlimDocument7 pagesDevoir de Contrôle N°2 - Technologie - Bridage - 3ème Technique (2015-2016) MR Mnejja SlimChokri Atef100% (1)
- 3202540912-U41 PDFDocument13 pages3202540912-U41 PDFChokri AtefPas encore d'évaluation
- Ce Document A Été Numérisé Par Le CRDP de Bordeaux Pour LaDocument6 pagesCe Document A Été Numérisé Par Le CRDP de Bordeaux Pour LaChokri AtefPas encore d'évaluation
- CATIA V5 DocumentDocument6 pagesCATIA V5 DocumentChokri AtefPas encore d'évaluation
- 5325 Sujet U11 Sept 2014Document17 pages5325 Sujet U11 Sept 2014Chokri AtefPas encore d'évaluation
- Acier: Choix Des Aciers Analyse & Résistance DescriptionDocument4 pagesAcier: Choix Des Aciers Analyse & Résistance DescriptionChokri AtefPas encore d'évaluation
- 2604f Tournage ConventionnelDocument4 pages2604f Tournage ConventionnelChokri AtefPas encore d'évaluation
- Chapitre 4 Les Transformations A Etat Solide Des Alliages Fe CDocument24 pagesChapitre 4 Les Transformations A Etat Solide Des Alliages Fe CChokri AtefPas encore d'évaluation
- 01 Materiaux CompositesDocument2 pages01 Materiaux CompositesChokri AtefPas encore d'évaluation
- Cours CH III Moment D Une Force D Un Couple NIIDocument7 pagesCours CH III Moment D Une Force D Un Couple NIIChokri Atef100% (1)
- Notice FH Alcatel 9400uxDocument63 pagesNotice FH Alcatel 9400uxMichelchaPas encore d'évaluation
- Epreuve Types Validés Maths 16 4 2021Document79 pagesEpreuve Types Validés Maths 16 4 2021Félix NKURUNZIZAPas encore d'évaluation
- DMbac STI2 DDocument2 pagesDMbac STI2 DzeriPas encore d'évaluation
- Les VecteursDocument6 pagesLes VecteursGAEL ETIENNEPas encore d'évaluation
- Chap2. Analyse Des Causes de DefaillanceDocument6 pagesChap2. Analyse Des Causes de DefaillanceWijdanePas encore d'évaluation
- PL - Chap I - Copie PDFDocument5 pagesPL - Chap I - Copie PDFmme tPas encore d'évaluation
- Sujet 03Document4 pagesSujet 03lbog.trashPas encore d'évaluation
- Notes de Cours BD 27-07-2023Document3 pagesNotes de Cours BD 27-07-2023Aimé ZahuiPas encore d'évaluation
- Automatique Niveau1Document77 pagesAutomatique Niveau1ssssPas encore d'évaluation
- Cours 6 Moteurs A Combustion InternesDocument7 pagesCours 6 Moteurs A Combustion Internesahmed ahmadPas encore d'évaluation
- Installation Et Configuration D'un Serveur FTP Sous LinuxDocument7 pagesInstallation Et Configuration D'un Serveur FTP Sous LinuxClubTutorielInformatiquePas encore d'évaluation
- Memoire de Fin D'EtudesDocument63 pagesMemoire de Fin D'Etudestakoua.belghitPas encore d'évaluation
- Pages From ASIRI-Recommandations-2012 - CompressedDocument190 pagesPages From ASIRI-Recommandations-2012 - CompressedYaseen AlAjmi CompanyPas encore d'évaluation
- Correction Activité1Document9 pagesCorrection Activité1Dany ObeidPas encore d'évaluation
- 4-Les AnnuitésDocument17 pages4-Les AnnuitésMarcelo BouhbaPas encore d'évaluation
- Radiologie Anul IIIDocument47 pagesRadiologie Anul IIIlolcPas encore d'évaluation
- Guide D'administration TWSDocument413 pagesGuide D'administration TWSDenazareth JesusPas encore d'évaluation
- Examen Blanc 2Document4 pagesExamen Blanc 2AlcalinaPhysicsPas encore d'évaluation
- J.J. CourtineDocument121 pagesJ.J. Courtineyankel98Pas encore d'évaluation
- IntroductionDocument8 pagesIntroductionMezine SohaibPas encore d'évaluation
- Mise en Forme Des Polymeres Approche Thermomecanique de La Plasturgie 4 Ed SommaireDocument36 pagesMise en Forme Des Polymeres Approche Thermomecanique de La Plasturgie 4 Ed Sommairemostafa oubihiPas encore d'évaluation
- DS1b PCDocument3 pagesDS1b PCfrancoisbPas encore d'évaluation
- TD Thermo SERIE2 AIT HOUDocument2 pagesTD Thermo SERIE2 AIT HOUOum FirasPas encore d'évaluation
- Canevas LicenceDocument8 pagesCanevas LicenceKassi ZidanePas encore d'évaluation
- L Etude de La Geolocalisation Dans Les Reseaux Mobiles GSM Et CDMA A MOBILINFODocument77 pagesL Etude de La Geolocalisation Dans Les Reseaux Mobiles GSM Et CDMA A MOBILINFOAdama SowPas encore d'évaluation
- 2022 NelleCaledo SI J2 Exo3 Sujet PAC 10ptsDocument3 pages2022 NelleCaledo SI J2 Exo3 Sujet PAC 10ptsgabinPas encore d'évaluation
- Pfe GC 0012-7Document10 pagesPfe GC 0012-7Gifted MouhcinePas encore d'évaluation
- TD PharmacométrieDocument8 pagesTD PharmacométrieSoumaya HizaouiPas encore d'évaluation
- Cours Materiaux Isolants - DocDocument35 pagesCours Materiaux Isolants - DocJihen Rf100% (1)
- Guide Reporting Tableaux de Bord Microsoft Dynamics CRM 2013Document78 pagesGuide Reporting Tableaux de Bord Microsoft Dynamics CRM 2013youssef MCHPas encore d'évaluation