Académique Documents
Professionnel Documents
Culture Documents
Chapitre 5 Diagramme de Phases de Corps Purs-1
Transféré par
Rayen JlassiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 5 Diagramme de Phases de Corps Purs-1
Transféré par
Rayen JlassiDroits d'auteur :
Formats disponibles
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Chapitre 5
Diagrammes de phase
de corps purs
Noura FAKHAR BOURGUIBA 49
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
1. Règle des phases – variance
1.1. Notion de phase
C’est l’état sous lequel on trouvera un constituant A ou un mélange de constituants. Un
système comporte une seule phase, s’il est bien homogène (même composition chimique et
mêmes propriétés physico-chimiques en tout point).
Un diagramme de phases représente donc les états sous lesquels on retrouve les constituants
dans les différents domaines de température et de pression.
1.2. Variance ou degrés de liberté d’un système
➢ Définition : la variance d’un système physico-chimique est le nombre de paramètres
intensifs indépendants dont l’expérimentateur peut fixer arbitrairement la valeur pour
atteindre un état d’équilibre de ce système.
➢ Calcul de la variance. La règle des phases (ou de GiBBS) permet de déterminer la variance.
Elle est traduite par l’équation suivante :
v = (n – r – q) + p -
v : la variance du système ;
n : le nombre total de constituants chimiques du système ;
r : le nombre de réactions chimiques indépendantes faisant intervenir ces constituants ;
: le nombre de phases en équilibre dans le système ;
p = 2 : paramètres physiques T et P.
q : nombre de relations particulières entre les paramètres intensifs des constituants d’une même
phase.
1.3. Application de la règle des phases
Exemple
Synthèse de l’ammoniac : N2(g) + 3H2(g) ══ 2 NH3(g)
v = (3-1) + 2- 1 = 3 (ou degrés de liberté maximum)
Noura FAKHAR BOURGUIBA 50
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Il faut fixer arbitrairement trois variables intensives pour déterminer un état d’équilibre.
Variables intensives : T, P, PH2, PN2, PNH3. L’opérateur peut fixer T, P et PH2, alors :
T fixée K°(T) = P2NH3(P°)2 / PN2. P3H2 est fixée ;
P fixée P = PH2 + PN2 + PNH3 et PH2 fixée.
Les autres pressions à l’équilibre peuvent être ainsi déterminées (on a deux équations à deux
inconnues PN2 et PNH3).
Cas particulier.
L’opérateur utilise un mélange stœchiométrique n0(H2) = 3n0(N2) pour faire la synthèse. A
l’équilibre PeqH2 = 3PeqN2, il s’agit d’une relation (ou d'une contrainte) supplémentaire, la
variance se réduit :
v = (3–1) + 2 –1 – 1 = 2 (ou degrés de liberté restants)
On dit aussi que la variance apparente est égale à 2 ou qu’il reste 2 degrés de liberté.
Si on fixe P et T, on peut déterminer les trois pressions partielles d’équilibre.
2. Equilibres de changement de phase
2.1. Généralités
2.1.1. Etats de la matière
Toutes les substances, corps purs ou mélanges, peuvent exister sous différents états
physiques : solide, liquide, gaz. A l’état solide certaines substances peuvent de plus exister sous
différents états d’agrégations qui sont appelés variétés allotropiques ; c’est le cas par exemple
du carbone (carbone diamant et carbone graphite).
2.1.2. Changement d’état
Un terme spécifique est attribué à chacun des changements d’état physique :
Noura FAKHAR BOURGUIBA 51
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Nom du changement d’état Transformation
Sublimation Solide → Gaz Transformations endothermiques
Fusion Solide → Liquide (transformation nécessitant un apport
Vaporisation Liquide → Gaz d’énergie thermique)
Condensation Gaz → Solide Transformations exothermiques
Liquéfaction Gaz → Liquide (transformation libérant de l’énergie
Solidification Liquide → Solide thermique)
Transformation polymorphique : variété allotropique → autre variété allotropique
3. Diagramme de changement d’état : diagramme unaire d’un corps pur
Le diagramme P = f(T) d’un corps pur représente les domaines de stabilité des divers
états (solide, liquide, gaz et éventuellement des différentes variétés allotropiques). Ces
domaines sont séparés par des courbes de changement de phase représentant des états
d’équilibre à deux phases.
3.1. Caractéristiques
Le corps pur est un système unaire. La variance v = (n - r) + 2 - devient dans ce cas
où n =1 et r = 0 : v=3-0 (1)
De la relation (1), il découle un certain nombre de caractéristiques pour le diagramme d’état
du corps pur :
• Il ne peut coexister au maximum que trois phases en équilibre.
• Lorsque deux phases sont en équilibre, v = 1 ; il existe donc entre les facteurs d’équilibre p
et T une relation P = f(T) se traduisant par une courbe de changement d’état dans le diagramme
P = f(T)
• Lorsque trois phases sont en équilibre en un point T, appelé point triple (intersection de
trois courbes de changement d'état), la variance est nulle ; l’état du système est donc
complètement défini : les coordonnées du point T (TT, pT) constituent un point fixe pour le
système.
Noura FAKHAR BOURGUIBA 52
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
• Si le système est monophasé, v = 2 ; dans ce cas, les facteurs d’équilibre P et T sont
indépendants. Le domaine de stabilité de la phase considérée occupe une surface du plan (P,T).
• Point critique
La courbe de vaporisation est limitée vers les hautes températures et fortes pressions au point
critique, au-delà duquel le changement d’état liquide gaz n’est pas observé.
➢ Obtention expérimentale du point critique
- Courbes isothermes P= f(V)
La figure ci-après représente les variations de la pression en fonction du volume molaire Vm
d’un corps pur pour différentes températures.
Partons d’un liquide à la température T, à température constante diminuons la pression, la
détente provoque une faible variation molaire du liquide. Quand apparaît la première bulle de
gaz la pression reste constante et le volume molaire augmente jusqu’à la valeur de celui du gaz.
Au-delà le corps pur est gazeux. L’isotherme pour la température critique présente un point
d’inflexion d2P/dV2=0. Pour des températures supérieures à la température critique, il est
impossible d’observer la liquéfaction des gaz, l’isotherme présentée ne montre aucune
discontinuité.
Le diagramme P = f(T) représente les domaines de stabilité des différents états physiques :
vapeur, liquide, solide. L’attribution des domaines est indiquée à la figure 1 ainsi que la
signification des différentes courbes de changement d’état.
Noura FAKHAR BOURGUIBA 53
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Figure 1 : Diagramme de phase d’un corps pur dans le cas usuel (général)
(a): Courbe de fusion : elle représente l’équilibre solide/liquide ayant lieu entre phases
condensées, la pression a très peu d’influence et la courbe de fusion Pfus = f (T) est presque
verticale. La pente de la courbe fusion peut être positive (cas le plus fréquent) ou négative
(eau, bismuth (Bi), Silicium (Si), Gallium (Ga) et Antimoine (Sb)).
La courbe de fusion est limitée pour les basses pressions par le point triple (Tr) mais pas pour
les hautes pressions.
(b) : Courbe de vaporisation : elle représente l’équilibre liquide/vapeur, elle est limitée vers
les basses températures par le point triple (Tr) et vers les hautes Températures par le point
critique (C). La pression de la vapeur en équilibre avec le liquide est appelée aussi pression
de vapeur saturante.
La pression de vapeur saturante ou la tension de vapeur saturante (𝑻) est la pression à
laquelle la phase gazeuse d'un corps pur est en équilibre avec sa phase liquide à une température
donnée dans un système fermé.
(c) : Courbe de sublimation : elle représente l’équilibre solide/vapeur qui concerne les
faibles valeurs de pression et température. La pression de la vapeur en équilibre avec le solide
est appelée aussi pression de vapeur saturante. La courbe de sublimation est limitée au
niveau supérieur par le point triple (Tr).
3.2. Courbe d’analyse thermique isobare d’un corps pur
Noura FAKHAR BOURGUIBA 54
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Figure 2 : courbe d’analyse thermique
La figure 2 représente la courbe d’analyse thermique lors d’un refroidissement : de la vapeur
est refroidie régulièrement à pression constante et on mesure sa température T au cours du
temps t.
Un corps pur bout lorsque sa pression de vapeur est égale à la pression de l’atmosphère
qui le surmonte. La température reste constante jusqu’à ce que la dernière goutte de liquide
soit vaporisée.
Les figures 3 et 4 représentent les diagrammes respectivement pour l’eau et le dioxyde de
carbone. Les figures 5 et 6 représentent les diagrammes pour le soufre et pour le carbone,
substances pour lesquelles il y a polymorphisme.
Figure 3 : Diagramme de changement d’état Figure 4: Diagramme de changement d’état
de l’eau. Les échelles ne sont pas respectées du dioxyde de carbone CO2.
Noura FAKHAR BOURGUIBA 55
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
Figure 5 : Diagramme de changement Figure 6: Diagramme de changement d’état du
d’état du soufre. carbone
4. Etude thermodynamique des équilibres de phases
4.1. Obtention théorique du diagramme de phases
4.1.1. Relation de Clapeyron.
Cette relation permet de relier la chaleur latente de changement d’état et la pression d’équilibre.
Quand un corps pur est en équilibre, à T et P données, sous deux phases et .
B() ═ B()
*(P,T) = *(P,T)
(Avec *= (G/n)T,p: enthalpie libre molaire du corps pur ou potentiel chimique).
En différenciant cette égalité pour une variation élémentaire de T et P on obtient :
d* = d* (2)
D’autre part, nous savons que : dG = VdP – SdT (si Wélect = 0).
La relation (2) devient :
𝑣𝛼∗ dP – 𝑠𝛼∗ dT = 𝑣𝛽∗ dP – 𝑠𝛽∗ dT
(𝑥𝛼∗ : grandeur molaire de la phase ) ; (𝑥𝛽∗ : grandeur molaire de la phase β)
Noura FAKHAR BOURGUIBA 56
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
En regroupant les variables on aboutit à :
∗ ∗)
𝑑𝑃 (𝑠𝛽− 𝑠𝛼
= ∗ −𝑣 ∗ )
𝑑𝑇 (𝑣𝛽 𝛼
En rappelant qu’à l’équilibre : rG = - = rH - T rS = 0, Il en résulte que
rS = rH/T. D’où la relation de Clapeyron :
∗
𝛥(𝛼→𝛽) 𝐻𝑚
𝑑𝑃
= ∗ −𝑣 ∗ )
𝑑𝑇 𝑇(𝑣𝛽 𝛼
𝑑𝑃
Représente la pente de la courbe P = f(T) du changement d’état considéré.
𝑑𝑇
4.1.2. Equilibre phase condensée – vapeur
Les deux équilibres :
Corps pur (sd) ═ corps pur gaz (g) ; corps pur (lq) ═ corps pur gaz (g)
Correspondent respectivement l’un à la sublimation du solide, l’autre à l’ébullition du liquide.
Ils se caractérisent respectivement par les enthalpies standard de sublimation subH
subH° et d’ébullition ebH ebH°. Ces deux enthalpies sont positives.
Comme, d’autre part, le volume molaire de la phase condensée (𝑣𝑠∗ pour le solide, 𝑣𝑙∗ pour le
∗
liquide) est toujours inférieur à celui de la phase gaz, (𝑣𝑣𝑎𝑝 –𝑣𝑠∗ ) et (𝑣𝑣𝑎𝑝
∗
-𝑣𝑙∗ ) sont positifs.
Il en résulte que dans la relation de Clapeyron, dp/dT 0.
Dans la mesure où le volume 𝑣𝑐∗ de la phase condensée (𝑣𝑐∗ =𝑣𝑠∗ ou 𝑣𝑐∗ =𝑣𝑙∗ ) est généralement
négligeable devant celui de la vapeur assimilée à un gaz parfait, il est possible d’écrire :
∗ 𝑅𝑇
(𝑣𝑣𝑎𝑝 –𝑣𝑐∗ ) 𝑣𝑣𝑎𝑝
∗
=
𝑃
La relation de Clapeyron s’écrit alors :
∗
𝛥(𝑐→𝑣𝑎𝑝) 𝐻𝑚
𝑑𝑃
= 𝑃
𝑑𝑇 𝑅 𝑇2
∗
Généralement 𝛥(𝑐→𝑣𝑎𝑝) 𝐻𝑚 dépend de la température, ce qui se traduit par :
Noura FAKHAR BOURGUIBA 57
Thème 2 : Thermodynamique Chapitre 5 : Diagrammes de phase de corps purs
∗
𝑃 𝑑𝑃 𝑇 𝛥(𝑐→𝑣𝑎𝑝) 𝐻𝑚
∫𝑃° 𝑃 = ∫𝑇 ° 𝑅 𝑇 2 𝑑𝑇
Il en résulte les équations des courbes (de sublimation) et (d’ébullition) de la figure 1 où C
représente le point critique, du corps étudié, au-delà duquel le changement d’état Liquide-gaz
n’est plus observé.
Il est à noter qu’au-delà du point critique, lorsque la pression et la température sont
simultanément supérieures à 𝑃𝑐 et 𝑇𝑐 (Fig.1), il existe un état fluide, intermédiaire entre l’état
liquide et l’état gazeux, appelé état supercritique.
4.1.3. Equilibre solide – liquide
La transformation : corps pur (sd) ═ corps pur (lq) est caractérisée par l’enthalpie de
fusion subH° 0 ; donc, le signe de la dérivée de la fonction P = f(T), donné par la relation
de Clapeyron est du signe de (𝑣𝑙∗ –𝑣𝑠∗ ).
En général, le volume 𝑣𝑙∗ du liquide est supérieur au volume 𝑣𝑠∗ du solide correspondant, de
𝑑𝑃
sorte que 0. Comme fusH° et fusV dépendent peu de la température, l’intégration de :
𝑑𝑇
𝛥𝑓𝑢𝑠 𝐻 ∗
𝑑𝑃 = dT
𝑇𝛥𝑓𝑢𝑠 𝑣 ∗
conduit à l’équation de la courbe de fusion (Fig. 1) :
𝛥𝑓𝑢𝑠 𝐻 ∗
P(T) = P(T°) + LnT/T° ; T° : température standard choisie.
𝛥𝑓𝑢𝑠 𝑣 ∗
Remarques
• Le diagramme de l’eau (Fig. 2) présente, pour la fusion, une pente dP/dT 0. Cela est due
au fait que 𝑣𝑙∗ (H2O) 𝑣𝑠∗ (H2O) : la glace est moins dense que l’eau. Sb et Bi sont dans ce
cas.
• Pour les autres substances, la pente dP/dT 0 : le solide est plus dense que le liquide.
Noura FAKHAR BOURGUIBA 58
Vous aimerez peut-être aussi
- Cours - Diagrammes Entre Phases - Sèances 1,2 Et 3Document35 pagesCours - Diagrammes Entre Phases - Sèances 1,2 Et 3Abdelhakim AkrouchePas encore d'évaluation
- Chapitre II Diagramme D Quilibre Les AlliagesDocument6 pagesChapitre II Diagramme D Quilibre Les AlliagesSH MahdiPas encore d'évaluation
- SMC4 Cristallo - Principale 2015Document2 pagesSMC4 Cristallo - Principale 2015ayoub dahbiPas encore d'évaluation
- CCP DEUG 2003 - Thermodynamique - Electro - OptiqueDocument13 pagesCCP DEUG 2003 - Thermodynamique - Electro - OptiqueYahya ElamraniPas encore d'évaluation
- Chap. 3-Alliages & Défauts Des MétauxDocument3 pagesChap. 3-Alliages & Défauts Des MétauxBénédicte & Christophe MULLERPas encore d'évaluation
- Exos CH 15Document2 pagesExos CH 15lol testPas encore d'évaluation
- TD Diagram ÉquilibreDocument9 pagesTD Diagram Équilibremaroun KerboutPas encore d'évaluation
- Axe Instantané de Rotation - WikipédiaDocument19 pagesAxe Instantané de Rotation - WikipédiaLoïc yvan steve FezePas encore d'évaluation
- Corrigé Exemples Application Ch3 PDFDocument17 pagesCorrigé Exemples Application Ch3 PDFDjo DjaPas encore d'évaluation
- Chapitre 5 Caracteristiques Inertie Des SolidesDocument21 pagesChapitre 5 Caracteristiques Inertie Des Solidesjoe100% (1)
- E Bascules DDocument4 pagesE Bascules DTaoufiqBaouchPas encore d'évaluation
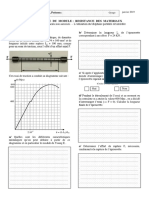
- Devoir de Synthèse N°2 - Math - Bac Sciences Exp (2011-2012) MR Maatallah - pdf1Document2 pagesDevoir de Synthèse N°2 - Math - Bac Sciences Exp (2011-2012) MR Maatallah - pdf1Mohamed SaidiPas encore d'évaluation
- Chapitre Transistor Bip 16-17Document18 pagesChapitre Transistor Bip 16-17abdelkanPas encore d'évaluation
- Durete 1 PDFDocument2 pagesDurete 1 PDFamrPas encore d'évaluation
- 170-E13 Frottement AdherenceDocument2 pages170-E13 Frottement AdherenceSegaAlainCoulibaly100% (1)
- Transfert Thermique Isolation v2Document49 pagesTransfert Thermique Isolation v2azzam100% (1)
- TD - Forge-2017 2018Document4 pagesTD - Forge-2017 2018Awatif BePas encore d'évaluation
- CH 1 Diagrammes D'equilibres Métalliques (v1.1)Document10 pagesCH 1 Diagrammes D'equilibres Métalliques (v1.1)Chokri AtefPas encore d'évaluation
- TD RDM L2 TroncDocument3 pagesTD RDM L2 TroncANGEL KOUAMEPas encore d'évaluation
- Chap2 Leçon2 3&4Document52 pagesChap2 Leçon2 3&4Guiliass100% (2)
- 4 Oscillateur Mecanique - CoursDocument22 pages4 Oscillateur Mecanique - Coursmariamars100% (2)
- Cinematique Des Fluides Exercices - Compress PDFDocument2 pagesCinematique Des Fluides Exercices - Compress PDFRenaud NsiepingPas encore d'évaluation
- Chapitre 2 Cinematique Des SolidesDocument40 pagesChapitre 2 Cinematique Des SolidesOthniel Meignan100% (2)
- 1729316434Document2 pages1729316434saad_m12100% (1)
- Ex 15 16Document18 pagesEx 15 16Sd instruPas encore d'évaluation
- Les Organes de GuidagesDocument4 pagesLes Organes de GuidagesHamza BNBPas encore d'évaluation
- Chap 5 Traitement Thermiques Des Aciers - Trempe Et Revenu - 2018Document28 pagesChap 5 Traitement Thermiques Des Aciers - Trempe Et Revenu - 2018Wissem El'MissaouiPas encore d'évaluation
- SERIE 4 - Conducteurs Et CondensateursDocument2 pagesSERIE 4 - Conducteurs Et CondensateursMohamed AlPas encore d'évaluation
- LTDE Série d'Exercice Corrigé Cisaillement 02-28-2024Document5 pagesLTDE Série d'Exercice Corrigé Cisaillement 02-28-2024Thierry MarvynPas encore d'évaluation
- C 7 Cristallographie PDFDocument3 pagesC 7 Cristallographie PDFPřøfëssêűr MåřťınPas encore d'évaluation
- TD2 CorrectionDocument4 pagesTD2 CorrectionAmayas BerdousPas encore d'évaluation
- Cristall o Graph I eDocument15 pagesCristall o Graph I eWPas encore d'évaluation
- Cours RD RR Francais AnnabaDocument42 pagesCours RD RR Francais AnnabaDaoud El CaidPas encore d'évaluation
- Travaux Diriges de Science Des Materiaux-1Document10 pagesTravaux Diriges de Science Des Materiaux-1héma tologiePas encore d'évaluation
- TD CristalloDocument4 pagesTD CristalloAyoub Moustaouli50% (2)
- Exo1 SDMDocument3 pagesExo1 SDMkouakou jean sylvestre yaoPas encore d'évaluation
- Chaînes de Solides Et Hyperstatisme PDFDocument13 pagesChaînes de Solides Et Hyperstatisme PDFmmPas encore d'évaluation
- Colle 10 ExercicesDocument6 pagesColle 10 ExercicesLOUEMBET Bourget100% (1)
- ThermodynamiqueDocument37 pagesThermodynamiqueBilal Bouakrif100% (1)
- SMC4 Cristallo - Rattrapage 2015 ReponsesDocument1 pageSMC4 Cristallo - Rattrapage 2015 ReponsesYc YacinePas encore d'évaluation
- Etude MacroscopiqueDocument36 pagesEtude MacroscopiqueMohamed Cheddad100% (1)
- Vis EcrouDocument8 pagesVis EcrouAsma MoussaPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 3ème Info (2009-2010) MR Jalel ChakrounDocument5 pagesDevoir de Contrôle N°1 - Physique - 3ème Info (2009-2010) MR Jalel ChakrounSaidi JalelPas encore d'évaluation
- +++examen Final d'RDM1 - Jan 2019 PDFDocument4 pages+++examen Final d'RDM1 - Jan 2019 PDFAitHammoudi AbdElmalekPas encore d'évaluation
- TCP-03-Cotation P 41-43Document3 pagesTCP-03-Cotation P 41-43Hassan OujgliPas encore d'évaluation
- TD Matériaux Métalliques MasterGMGP 2019Document8 pagesTD Matériaux Métalliques MasterGMGP 2019Mouad HaritPas encore d'évaluation
- Solide en Rotation CoursDocument4 pagesSolide en Rotation CoursMehdi BnmssdPas encore d'évaluation
- TD1 Exercice Acier. Et FonteDocument6 pagesTD1 Exercice Acier. Et FontehakimkorichiPas encore d'évaluation
- Les Materiaux DiélectriqueDocument33 pagesLes Materiaux DiélectriqueIs LamPas encore d'évaluation
- Mécanisme Fin 5Document78 pagesMécanisme Fin 5akarne YounessPas encore d'évaluation
- TP Ondes Et VibrationsDocument8 pagesTP Ondes Et VibrationsNo1 Ad3Pas encore d'évaluation
- Chaîne en Mouvement Sur Le Bord D'une Table)Document3 pagesChaîne en Mouvement Sur Le Bord D'une Table)Kamel KamatchoPas encore d'évaluation
- Cours Diagramme Master 2Document48 pagesCours Diagramme Master 2ayoub dahmanPas encore d'évaluation
- Document Sans TitreDocument7 pagesDocument Sans TitreMohamed MahdiPas encore d'évaluation
- Equilibre Solide Liquide OUII Du 1ère masterGCDocument8 pagesEquilibre Solide Liquide OUII Du 1ère masterGCRay CharlesPas encore d'évaluation
- Chapitre II - Equilibres Liquide - VapeurDocument28 pagesChapitre II - Equilibres Liquide - Vapeurben binahPas encore d'évaluation
- Cours IIA Termo 3Document5 pagesCours IIA Termo 3Nizar BenYahiaPas encore d'évaluation
- CH I Equilibre Liquide VapeurDocument10 pagesCH I Equilibre Liquide Vapeurlo100% (1)
- Cours Thermo - Chapitre 3 - Diagramme de Phase Du Corps Pur - 2018Document28 pagesCours Thermo - Chapitre 3 - Diagramme de Phase Du Corps Pur - 2018ait hssain100% (1)
- Chapitre 1 Objectifs de La MaintenanceDocument40 pagesChapitre 1 Objectifs de La MaintenanceAhmed ELBOUZIDIPas encore d'évaluation
- PrincipéchangeurDocument5 pagesPrincipéchangeurAyoub Magroud100% (1)
- Fiche Technique de Sécurité 93/112/CEE M 220: 883816.0, 883816.00010, 9.3027.0 Oel - D.DotDocument6 pagesFiche Technique de Sécurité 93/112/CEE M 220: 883816.0, 883816.00010, 9.3027.0 Oel - D.DotSMM ENTREPRISEPas encore d'évaluation
- TC - Examen - Emd 2 6728Document13 pagesTC - Examen - Emd 2 6728Ha NahPas encore d'évaluation
- DS-051004 EnonceDocument6 pagesDS-051004 EnonceIhsan MokhlissePas encore d'évaluation
- Ex RCDocument4 pagesEx RCPc KawtarPas encore d'évaluation
- Bougies de Prechauffage: NGK France MFBP0905Document71 pagesBougies de Prechauffage: NGK France MFBP0905OS DiagnosticAutoPas encore d'évaluation
- Fiche05 Finition ZINTEKDocument1 pageFiche05 Finition ZINTEKValtessPas encore d'évaluation
- 01 Controle #3 Semestre 2Document6 pages01 Controle #3 Semestre 2JOKER YTPas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- Ondes Electromagnetiques Dans Le Vide CoursDocument7 pagesOndes Electromagnetiques Dans Le Vide Coursbadr pedroPas encore d'évaluation
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- Cours Cycles Biogéochimique M2 BiodiversitéDocument10 pagesCours Cycles Biogéochimique M2 BiodiversitéFATIMA-ZAHRA JAPas encore d'évaluation
- Cours de Geologie Petroliere OriDocument13 pagesCours de Geologie Petroliere OriSamba Koukouare ProsperPas encore d'évaluation
- PFE Les SulfatesDocument14 pagesPFE Les SulfatesisabelpenamantePas encore d'évaluation
- Dossier Energies RenouvelablesDocument5 pagesDossier Energies RenouvelablesskitocPas encore d'évaluation
- TD Transformateurs Électriques LVDocument5 pagesTD Transformateurs Électriques LVIhssane IdrissiPas encore d'évaluation
- 16 Les AC MarquésDocument70 pages16 Les AC MarquésDr BENOUADFELPas encore d'évaluation
- Chrome PresentationDocument5 pagesChrome PresentationNesrinePas encore d'évaluation
- Universite Felix Houphouet-Boigny: Ufr SSMT Année Académique 2022-2023 Master 2 EEAI-EEMDocument2 pagesUniversite Felix Houphouet-Boigny: Ufr SSMT Année Académique 2022-2023 Master 2 EEAI-EEMAxel AssamoaPas encore d'évaluation
- TD Transferts de Chaleur Et de Matière FPN Master Chimie Des Matériaux S2 PDFDocument35 pagesTD Transferts de Chaleur Et de Matière FPN Master Chimie Des Matériaux S2 PDFAbir AbkariPas encore d'évaluation
- TD1 Diagrammes Déquilibres Des Alliagess-1Document4 pagesTD1 Diagrammes Déquilibres Des Alliagess-1jihed korbiPas encore d'évaluation
- TransiDocument5 pagesTransinouredine akliPas encore d'évaluation
- Chap1 VetdDocument3 pagesChap1 VetdDialloPas encore d'évaluation
- Rapport Geotechnique CompletDocument65 pagesRapport Geotechnique CompletGORGUI SOWPas encore d'évaluation
- HH MergedDocument12 pagesHH Mergedbenaoua nourPas encore d'évaluation
- Interrogation 01 Avec Corrigé - Physique 02 - 2020-2021Document5 pagesInterrogation 01 Avec Corrigé - Physique 02 - 2020-2021Ayoub FekharPas encore d'évaluation
- THERMODYNAMIQUEDocument15 pagesTHERMODYNAMIQUESAIDPas encore d'évaluation
- Série D'exercices 4, État D'équilibre D'un Système Chimique, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Unlocked PDFDocument6 pagesSérie D'exercices 4, État D'équilibre D'un Système Chimique, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Unlocked PDFkhaled nawiPas encore d'évaluation
- Classification Périodique PDFDocument2 pagesClassification Périodique PDFRaja BenabPas encore d'évaluation