Académique Documents
Professionnel Documents
Culture Documents
2005 National Correction Exo3 IndicColor 6 5pts
2005 National Correction Exo3 IndicColor 6 5pts
Transféré par
Harakat Elhoucine0 évaluation0% ont trouvé ce document utile (0 vote)
4 vues2 pagesn
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentn
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
4 vues2 pages2005 National Correction Exo3 IndicColor 6 5pts
2005 National Correction Exo3 IndicColor 6 5pts
Transféré par
Harakat Elhoucinen
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
2005 National Exercice n°3 : Les indicateurs colorés naturels de la cuisine à la chimie (6,5 points)
Correction http://labolycee.org © Calculatrice interdite
1. Les indicateurs colorés en cuisine
1.1. Un indicateur coloré a la propriété de changer de couleur en fonction du pH.
1.2. Le vinaigre est acide, car le choux rouge devient violet en sa présence (pH : 4 à 6)
Le détergent est basique car l’eau de rinçage devient verte (pH : 9 à 12)
2. Les indicateurs colorés pour les titrages
2.1. Dilution du vinaigre
Une dilution s’effectue avec de la verrerie jaugée.
Solution mère : c0 ; V0 Solution fille : c = c0 / 10 ; V
Au cours d’une dilution la quantité de matière de soluté se conserve : c×V = c0×V0 = (c0/10) ×V
Soit V0 = V/10.
On prélève V0 à l'aide d'une pipette jaugée de 20,0 mL et on effectue la dilution dans une fiole jaugée de
200,0 mL.
2.2. Réaction de dosage
2.2.1. HA(aq) + HO–(aq) = A–(aq) + H2O(l)
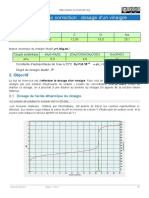
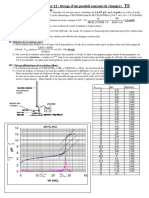
2.2.2. Pour un volume de soude versé VB = 6,0 mL, le réactif limitant est la soude, en effet d’après la
courbe pH-métrique, le volume équivalent vaut VBE = 10 mL. Si VB < VBE alors le réactif titrant est en
défaut.
2.2.3.Equation HA(aq) + HO–(aq) = A–(aq) + H2O(l)
Etat initial x =0 mol cA×VA cB×VB 0 beaucoup
En cours de
x cA×VA – x cB×VB – x x bcp + x
transformation
Etat final si
xf cA×VA – xf n(HO–)f = cB×VB – xf xf bcp + xf
transformation limitée
Etat final si
xmax cA×VA – xmax 0 xmax bcp + xmax
transformation totale
xmax = cB×VB ×10–4 mol
soit xmax = 1,0×10–1×6,0×10–3 = 6,0×
2.2.4.Pour VB = 6,0 mL, le pH du mélange vaut pH = 5
Le produit ionique de l’eau nous donne : Ke = [H3O+(aq)]f×[HO–(aq)]f = 10-pH×[HO-(aq)]f
Soit [HO–(aq)]f = Ke×10pH
(n − ) f
Or [HO–(aq)]f = HO
VA + Veau + VB
Soit (nHO-)f = Ke×10pH×(VA+Veau + VB)
×10–12 mol
(nHO-)f = 10–14×105×(10,0 + 60 + 6,0) ×10–3 =76×
2.2.5. (nHO-)f = cB×VB – xf
xf = cB×VB – (nHO-)f
xf xmax − (n − ) f
HO
τ= =
xmax xmax
6,0 × 10−4 − 76 × 10−12 6,0 × 10−4
τ= = = 1 La transformation est donc totale.
6,0 × 10− 4 6,0 × 10− 4
2.3. Détermination par titrage de la concentration molaire en acide éthanoïque apporté du vinaigre
dpH
2.3.1. A l’équivalence la courbe passe par un maximum ce qui correspond à VBE = 10 mL
dVB
2.3.2. A l’équivalence la quantité de soude versée est égale à la quantité d’acide présente, soit :
cB×VBE = cA×VA
c × VBE
cA = B
VA
1,0 × 10−1 × 10
cA = = 1,0×10–1 mol.L-1
10,0
La solution de vinaigre a été diluée 10 fois soit c0 = 10×cA = 1,0 mol.L-1
2.4. Retour historique
− +
[AInd(aq)]éq × [H 3O(aq)]éq
2.4.1. HAInd(aq) + H2O(l) = AInd-(aq) + H3O+
(aq) Ki =
[HAInd(aq)]éq
Ki [AInd
−
(aq)]éq
=
[H3O(+aq)]éq [HAInd(aq)]éq
10−pKi pH − pKi
−
[AInd (aq)]éq
pH
= 10 =
10 − [HAInd(aq)]éq
2.4.2. Artichaut :
−
[AInd (aq)]éq
Pour VB = 9,8 mL = 106,5 − 7,5 = 10–1,0 HA prédomine
[HAInd(aq)]éq
−
[AInd(aq)]éq
Pour VB = 10,1 mL = 1010,5 − 7,5 = 103,0 A– prédomine
[HAInd(aq)]éq
Betterave rouge :
−
[AInd(aq)]éq
Pour VB = 9,8 mL = 106,5 −11,5 = 10–5,0 HA prédomine
[HAInd(aq)]éq
−
[AInd(aq)]éq
VB = 10,1 mL = 1010,5 −11,5 = 10–1,0 HA prédomine
[HAInd(aq)]éq
2.4.3.
Artichaut Betterave rouge
VB = 9,8 mL VB = 10,1 mL VB = 9,8 mL VB = 10,1 mL
−
[AInd(aq)]éq
10 –1,0 10 3,0 10 –5,0 10 –1,0
[HAInd(aq)]éq
Couleur incolore Jaune Rouge Rouge
2.4.4. La betterave ne convient pas, puisque aucun changement de couleur n'a lieu à l'équivalence.
Avec l’artichaut, le milieu réactionnel passera de l’incolore au jaune. C’est donc l’indicateur coloré le
mieux adapté.
2.4.5. Si le vinaigre était coloré, le changement de couleur serait peu visible. La coloration jaune de
l'indicateur coloré serait masquée par la couleur du vinaigre.
Vous aimerez peut-être aussi
- TP N2 PH MetrieDocument15 pagesTP N2 PH MetrieSellam Anis100% (2)
- Oscillateur À Résistance Négative Cours Morchid PDFDocument8 pagesOscillateur À Résistance Négative Cours Morchid PDFYassir RochdPas encore d'évaluation
- S7 Chapitre 03 Reaction Acide Base DosageDocument16 pagesS7 Chapitre 03 Reaction Acide Base DosageRADWAN100% (2)
- TD Acide Base 24 Fevrier 2016Document10 pagesTD Acide Base 24 Fevrier 2016Tkra G Sil100% (1)
- TP Chimie AnalytiqueDocument13 pagesTP Chimie AnalytiqueFedoua Benamer100% (1)
- TP Dosage de L Acidite D Un VinaigreDocument3 pagesTP Dosage de L Acidite D Un VinaigreDjahid Jo75% (4)
- 07 Titrage PH Vinaigre CorrectionDocument4 pages07 Titrage PH Vinaigre CorrectionChartier Julien86% (7)
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArPas encore d'évaluation
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 pagesSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Transformations Associés A Des Reactions Acido Basiques en Solution AqueusesDocument8 pagesTransformations Associés A Des Reactions Acido Basiques en Solution AqueusesJosé Ahanda NguiniPas encore d'évaluation
- Ex Dipole RLCDocument4 pagesEx Dipole RLClamilouch6498100% (1)
- 3 Ex Travail Puiss Energ 13 ComprDocument7 pages3 Ex Travail Puiss Energ 13 ComprYassir RochdPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueBoussetta ZouhaierPas encore d'évaluation
- Exercice Corrige Bac Blanc Physique Ondes Sonores PDFDocument2 pagesExercice Corrige Bac Blanc Physique Ondes Sonores PDFYassir Rochd50% (2)
- Fiche-La Radioactivite PDFDocument5 pagesFiche-La Radioactivite PDFYassir RochdPas encore d'évaluation
- Fiche Technique 7-ConductimetrieDocument2 pagesFiche Technique 7-ConductimetrieYassir RochdPas encore d'évaluation
- Chapitre VI Réaction ABDocument6 pagesChapitre VI Réaction ABSarah DiomandePas encore d'évaluation
- Acide Base +dosage1Document2 pagesAcide Base +dosage1hamzacrypto080Pas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Chimie TP9 ProfDocument2 pagesChimie TP9 ProfSafa MakhloufPas encore d'évaluation
- TleD - CH - L11 - Dosage Acido-BasiqueDocument10 pagesTleD - CH - L11 - Dosage Acido-BasiqueHamadi DialloPas encore d'évaluation
- Cours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneDocument5 pagesCours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneTawfiq Weld EL ArbiPas encore d'évaluation
- TP Dosage PhmetriqueDocument1 pageTP Dosage PhmetriqueNesrine BouzidPas encore d'évaluation
- Sans Titre - PDF Controle-1Document1 pageSans Titre - PDF Controle-1Elmostafa ELGHAZOULIPas encore d'évaluation
- TD Acide Fort Base Forte Dosage TS2Document10 pagesTD Acide Fort Base Forte Dosage TS2pathediakhate4Pas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Vinaigre CondDocument2 pagesVinaigre CondجعدبندرهمPas encore d'évaluation
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- Tp.3 Titrage PH Metrique Et ColorimétriqueDocument5 pagesTp.3 Titrage PH Metrique Et ColorimétriqueMalak El jadiriPas encore d'évaluation
- DosageDocument3 pagesDosageNourhene AbidPas encore d'évaluation
- 5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFDocument5 pages5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFkimmikPas encore d'évaluation
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- C8 ÉlèvesDocument5 pagesC8 ÉlèvesjallobibosPas encore d'évaluation
- HTTP://WWW - France Examen - Com/annales Bac Terminale Generale Scientifiq...Document3 pagesHTTP://WWW - France Examen - Com/annales Bac Terminale Generale Scientifiq...la physique selon le programme FrançaisPas encore d'évaluation
- Serie1 ChimeDocument3 pagesSerie1 ChimeJabri ImenePas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Université Sidi Mohamed Ben Abdellah: Ecole Supérieure de Technologie-FèsDocument7 pagesUniversité Sidi Mohamed Ben Abdellah: Ecole Supérieure de Technologie-FèsABDELALI SASSIOUIPas encore d'évaluation
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- C8 Dosages Effets Tampon 2024 LZRKMDocument4 pagesC8 Dosages Effets Tampon 2024 LZRKMngommeissa118Pas encore d'évaluation
- Dosagecorrige PDFDocument3 pagesDosagecorrige PDFMãşşī ĶãžPas encore d'évaluation
- Reaction Acido BasiqueDocument4 pagesReaction Acido BasiqueOumar TraoréPas encore d'évaluation
- Exercice Type: Titrage Acido-BasiqueDocument3 pagesExercice Type: Titrage Acido-BasiqueMiniar BoughzalaPas encore d'évaluation
- PH Des Solutions Aqueuses 023 0Document10 pagesPH Des Solutions Aqueuses 023 0km.aouadiPas encore d'évaluation
- Nouveau Document Microsoft Office WordDocument18 pagesNouveau Document Microsoft Office WordAnonymous b9f4AjwPPas encore d'évaluation
- TD2 ChimieDocument3 pagesTD2 ChimieSAMIA AQNOUCHPas encore d'évaluation
- Série Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943Document2 pagesSérie Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943dememamebousso09Pas encore d'évaluation
- Rapport Degre D'aciditeDocument5 pagesRapport Degre D'aciditezeinabhatemtarchichiPas encore d'évaluation
- 2010 Liban Exo1 Sujet AcideEthanoique 6 5ptsDocument3 pages2010 Liban Exo1 Sujet AcideEthanoique 6 5ptsMed BriniPas encore d'évaluation
- Série Chimie 2ème SC Dosage Acide Base (Selmi Jomaa)Document6 pagesSérie Chimie 2ème SC Dosage Acide Base (Selmi Jomaa)walidPas encore d'évaluation
- Ds Destop CorrecDocument11 pagesDs Destop CorrecDenis BurettePas encore d'évaluation
- TP1 CorigeDocument2 pagesTP1 CorigeSamir MirPas encore d'évaluation
- Correction Exercice Type Bac Dosage Acide BaseDocument3 pagesCorrection Exercice Type Bac Dosage Acide BaseColinePas encore d'évaluation
- 1cm3jftoi 866968Document2 pages1cm3jftoi 866968bipPas encore d'évaluation
- C7 Af BF WahabDiopDocument5 pagesC7 Af BF WahabDiopGaye BachirPas encore d'évaluation
- DosageDocument2 pagesDosagePhysique ChimiePas encore d'évaluation
- 2010 Liban Exo1 Sujet AcideEthanoique 6 5ptsDocument3 pages2010 Liban Exo1 Sujet AcideEthanoique 6 5ptsMoussa marsa bachirPas encore d'évaluation
- Exercice Corrigé Sur DosageDocument5 pagesExercice Corrigé Sur DosageIkram MgPas encore d'évaluation
- Sujet Physique ChimieDocument2 pagesSujet Physique ChimiemyriamdibbPas encore d'évaluation
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 pagesCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyPas encore d'évaluation
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 pagesSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinPas encore d'évaluation
- 5 Reactions Acido BasiquesDocument3 pages5 Reactions Acido BasiquesYouness SinePas encore d'évaluation
- CoursDocument5 pagesCoursYassir RochdPas encore d'évaluation
- Fiche Technique 2-Phmetrie PDFDocument1 pageFiche Technique 2-Phmetrie PDFYassir RochdPas encore d'évaluation
- Série Ec PDFDocument2 pagesSérie Ec PDFYassir RochdPas encore d'évaluation
- Phy 3Document13 pagesPhy 3Yassir Rochd100% (1)
- (Torrent9.red) Larousse - Orthographe - Les Indispensables PDFDocument122 pages(Torrent9.red) Larousse - Orthographe - Les Indispensables PDFgranmystePas encore d'évaluation
- Chimie C Chap11 Application Electrolyse PDFDocument1 pageChimie C Chap11 Application Electrolyse PDFYassir RochdPas encore d'évaluation
- TD Oscillation Mecanique 2014 Lolb-Wahab DiopDocument5 pagesTD Oscillation Mecanique 2014 Lolb-Wahab DiopYassir Rochd100% (2)
- Exo Gravitation 3 4 5 6 CorrDocument2 pagesExo Gravitation 3 4 5 6 CorrYassir RochdPas encore d'évaluation
- Cinema TiqueDocument32 pagesCinema TiqueAhmed HaniPas encore d'évaluation
- TermS PH Chap11Document17 pagesTermS PH Chap11Yassir RochdPas encore d'évaluation
- Chimie C Chap11 Application Electrolyse PDFDocument1 pageChimie C Chap11 Application Electrolyse PDFYassir RochdPas encore d'évaluation
- Exercices de DYNAMIQUE de RotationDocument13 pagesExercices de DYNAMIQUE de RotationYassir RochdPas encore d'évaluation
- Tp03complet PDFDocument12 pagesTp03complet PDFYassir RochdPas encore d'évaluation
- Exercice Bac Blanc Physique Ondes Sonores PDFDocument3 pagesExercice Bac Blanc Physique Ondes Sonores PDFYassir Rochd50% (2)
- 151 1s Ii.0 Formulaire PDFDocument2 pages151 1s Ii.0 Formulaire PDFYassir RochdPas encore d'évaluation
- Physique 1bac Cours - 05 Travail Et Energie Interne PDFDocument3 pagesPhysique 1bac Cours - 05 Travail Et Energie Interne PDFYassir RochdPas encore d'évaluation
- Energie Interne Et Calorimètre Exercices FR 16Document2 pagesEnergie Interne Et Calorimètre Exercices FR 16Yassir Rochd100% (1)
- Physique-Chapitre7-Transfert Thermique Et Energie InterneDocument3 pagesPhysique-Chapitre7-Transfert Thermique Et Energie InterneYassir RochdPas encore d'évaluation
- Chapitre 3 Mc3a9langesDocument27 pagesChapitre 3 Mc3a9langesabderrahim hafoudPas encore d'évaluation
- Série 2 - Corrigé - Chimie Des Solutions PDFDocument5 pagesSérie 2 - Corrigé - Chimie Des Solutions PDFAyoub BrhmmouchPas encore d'évaluation
- Chimie en Solution: TD Prof. M. BelfaquirDocument112 pagesChimie en Solution: TD Prof. M. BelfaquirAyoub Maverick100% (1)
- Concept Donneur-Accepteur-ResumeCours ProfDocument6 pagesConcept Donneur-Accepteur-ResumeCours ProfAnt ManPas encore d'évaluation
- Chapitre IIDocument28 pagesChapitre IIchaima sagiPas encore d'évaluation
- 2021-09-Metro - Exo1-Sujet-SyntheseEster-10ptsDocument4 pages2021-09-Metro - Exo1-Sujet-SyntheseEster-10ptsMartin SALEHPas encore d'évaluation
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiPas encore d'évaluation
- Definition en ChimieDocument2 pagesDefinition en ChimieIdrissa SankharePas encore d'évaluation
- Dosage Et TitrationDocument7 pagesDosage Et TitrationHell LorrPas encore d'évaluation
- 13.titrage PHDocument1 page13.titrage PHكوثر صوالح محمدPas encore d'évaluation
- 10 - PH Et Equilibre Acido-BasiqueDocument8 pages10 - PH Et Equilibre Acido-Basiquesisics2005Pas encore d'évaluation
- Titratable AcidityDocument3 pagesTitratable AcidityRachelHechanovaPas encore d'évaluation
- Dev CON2 4M 2020 2021 (Corrigé)Document14 pagesDev CON2 4M 2020 2021 (Corrigé)Barhoumi MouradPas encore d'évaluation
- Correction TP 12 Vinaigre New PDFDocument2 pagesCorrection TP 12 Vinaigre New PDFYouSsef Echafai100% (1)
- Sujet Chimie FMSP 2008Document2 pagesSujet Chimie FMSP 2008Karen DominiquePas encore d'évaluation
- Td13 Acides Precipitation CorrDocument2 pagesTd13 Acides Precipitation CorrAdri LebPas encore d'évaluation
- Fibonacci - Physique Chimie - SupDocument591 pagesFibonacci - Physique Chimie - SupYassinePas encore d'évaluation
- 1cqoefi3k 57913Document1 page1cqoefi3k 57913ArielPas encore d'évaluation
- Devoir de Revision2 2023bac Math DefDocument5 pagesDevoir de Revision2 2023bac Math DefNour NessahPas encore d'évaluation
- Ciao ExoDocument11 pagesCiao ExoOcéane Verbeke100% (2)
- TD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. MaghchicheDocument4 pagesTD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. Maghchicheromaissa benchadiPas encore d'évaluation
- Corrigé Type TD N°8Document7 pagesCorrigé Type TD N°8Sofiane BousifePas encore d'évaluation
- Série Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943Document2 pagesSérie Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943dememamebousso09Pas encore d'évaluation
- Rapport TP Géochimie BIKARNAFDocument19 pagesRapport TP Géochimie BIKARNAFAyad Said100% (3)
- 2021 Centres Etrangers ExoC Sujet AmmoniaquepH 5ptsDocument3 pages2021 Centres Etrangers ExoC Sujet AmmoniaquepH 5ptsMartin SALEHPas encore d'évaluation
- TD N°1 VolumDocument2 pagesTD N°1 VolumAbderrahmane AmzidPas encore d'évaluation
- Détermination de La Constante D'aciditéDocument3 pagesDétermination de La Constante D'aciditéAnis Dahnen100% (2)
- Grand Oral PCDocument9 pagesGrand Oral PCquivymanon94Pas encore d'évaluation
- Devoir de Contrôle N°3 Collège Pilote 2ème Semestre - Physique - 9ème (2018-2019) MR Kamel KhchiniDocument2 pagesDevoir de Contrôle N°3 Collège Pilote 2ème Semestre - Physique - 9ème (2018-2019) MR Kamel KhchiniMarzouki FaouziPas encore d'évaluation