Académique Documents
Professionnel Documents
Culture Documents
Epreuve Bac 2022 Chimie Série C D e Cameroun PDF
Transféré par
Amza FarelTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Epreuve Bac 2022 Chimie Série C D e Cameroun PDF
Transféré par
Amza FarelDroits d'auteur :
Formats disponibles
OFFICE DU BACCALAUREAT DU CAMEROUN
Examen: Baccalauréat Séries: C, D et E Session: 20.22
Epreuve: Chimie Coeff : 2 Durée: 3h
Partie A : Evaluation des ressources
Exercice 1 : Vérification des savoirs / 8 points
1- Définir: facteur cinétique, vitesse instantanée de disparition d'un réactif. 2pt
2- Donner l'intérêt de la trempe en cinétique chimique. 1pt
3- Choisir la bonne réponse:
Quand la température du milieu réactionnel augmente généralement, la vitesse d'une réaction
chimique:
a- reste la même b- augmente c- diminue Ipt
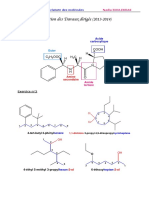
4- Ecrire la formule semi-développée du 2-amino-2,3-diméthylbutan-1-0J. Ipt
5- le 4-méthylpent-2-ène existe sous forme de deux diastéréoisomères. les représenter. 2pt'
om
6- la méthylamine CH3NH2 est une base faible. Ecrire l'équation de sa réaction avec l'eau. 1pt
Exercice 2 : Application des savoirs /8 points
1. le pKa du couple CH 3COOH!CH 3COO· a pour valeur 4,75 et celui du couple 4Hs-COOH!C6HS-COO· est de
4,20. Classer CH 3COOH et C6Hs-COOH par acidité croissante. Ipt
.c
, 2. le pH de l'estomac est voisin de 2. Donner, en justifiant la réponse, la forme prédominante de
l'aspirine (forme acide ou forme basique) dans l'estomac. On donne.le pKa du couple acide !base de
xa
l'aspirine égal à 3,8. 1,5pt
1
3. la concentration en ions hydroxyde OH- d'une solution est de 5,0 x 10.10 mol.l- à 25° C. Sachant que le
1
produit ionique de l'eau vaut 14=10.14, Calculer la concentration en molr des ions hydronium H30+. 1,5pt
te
4- Lors de la réaction de condensation entre l'alanine de formule CH3-CH(NH2)-COOH et la glycine de
formule H-CH(NHû-COOH, on peut obtenir deux dipeptides : Ala-Gly et Gly-Ala.
.4.1- Ecrire la formule seml-développée de Ala-Gly. Encadrer la liaison peptidique dans ce composé. 1,5pt
je
4.2- Décrire la démarche à suivre pour obtenir uniquement Ala-Gly. 1,5pt
5- l'oxydation ménagée d'un alcool à chaine carbonée saturée constitùée de trois atomes de carbone
su
conduit à une cétone. Ecrire. la formule semi-développée de cet alcool. Ipt
Exercice 3 : Utilisation des savoirs /8 points
1- On mélange 32,0 g d'acide acétique pur CH3COOH et 16,0 g d'alcoollsoamyllque de formule semi- ,
développée CH3-CH(CH3)-CHrCH2-0H.
1.1-lndiquer deux actions qu'on peut mener'pouraccélérer cette réaction. Ipt
1.2- l'un des réactifs est introduit en excès, lequel? Justifier. Ipt
1.3- Sachant que le rendement de la réaction est de 59%, calculer la masse d'ester obtenu. 2pt
1.4- Par quel autre réactif peut-on remplacer l'acide acétique pour obtenir une réaction totale? Ecrire
l'équation bilan de cette réaction. 1,5pt
2-Un composé A est obtenu par action de 0,2 mol de N,N-diméthylaniline C6Hs-N{CH 3h sur une solution de
0,2 mol d'iodoéthane dans !e benzène. En refroidissant, on obtient un précipité.
2.1- le benzène joue-t-ille rôle de réactif ou de solvant dans cette réaction? O,Spt
2.2- Ecrire l'équation bilan de la réaction. Ipt
2.3- Dans l'hypothèse d'une réaction totale, calculer la masse de produit obtenu. Ipt
On donne en g.mor1 : M(I) = 126,9; M(C) = 12; M(H) = 1; M(N) = 14 ; M (0) = 16.
OBC 1 BACCALAUREAT 1 SERIES C, D ET E 1 EPREUVE DE CHIMIE / SESSION 20.2,2 1/2
Partie B : Evaluation des compétences (16 points)
Situation-problème: Détermination de la posologie d'un traitement du reflux gastro-œsophaglen.
Une équipe de chercheurs a mis au point un médicament pour soulager les patients souffrant des
symptômes du reflux gastro-œsophagien à savoir les brûlures de l'estomac et les remontées acides. Le
principe actif dudit médicament est l'hydroxyde de magnésium qui agit en neutralisant le suc gastrique.
Les chercheurs doivent procéder à des tests avant la validation du nouveau médicament par un comité
scientifique. En vue d'étudier in vitro (c'est-à-dire au laboratoire) les réactions qui se déroulent dans
l'estomac, on cherche à préparer une solution d'acide chlorhydrique de pH égal à 4,0 à partir d'une
solution So d'acide chlorhydrique de pH=3,O. Les tests in vitro sont suivis des tests in vivo (dans le corps
humain) auprès d'un échantillon de patients volontaires.
r1 Doc.! :1--------------.
Le suc gastrique
...-nr---...r------------,
Doc.2 Produits disponibles :
- Le suc gastrique est une solution d'acide - Eau distillée
om
chlorhydrique dont le pH varie entre 1 et 5,5 en - Solution So de pH=3,O
fonction des aliments consommés et de la - Solution SI d'hydroxyde de sodium (Na++OH1
distance par rapport au repas. de concentration C)=O,lOmoI.L-1
(prendre le pH=2 pour évaluer la posologie).
- Le Volume de suc gastrique secrété par.c nDoc.4 1 Hydroxyde de magnésium:
l'estomac en 24h est en moyenne 2L. - Formule: Mg(OHn
xa
- Aspect: Poudre blanche peu soluble dans l'eau
Î Doc.3 1
- Masse molaire: 58,3g1mol
Conditionnement du médicament
te
- Action sur l'acide chlorhydrique:
Suspension buvable en flacons de 250 mL
contenant 9,75g d'hydroxyde de magnésium.
je
su
Elève en Terminale scientifique, tu es associé(e) à l'équipe des chercheurs.
1- Propose un protocole pour préparer 200 ml d'une solution S de pH=4 en s'aidant de la solution 50
et de l'eau distillée. 6pt
2- Elabore une posologie du médicamenf en indiquant le nombre maximum de cuillérées de 7,5 ml à
consommer par jour pour un malade. 10pt
La qualité de la rédaction sera valorisée. Les démarches adoptées pour élaborer ces tâches devront
s'accompagner, il chaque étape, de la précision sur le matériel et les conditions expérimentales utilisées,
voire, quand cela est nécessaire, de l'écriture des équations, des formules et des calculs appropriés.
1
1
1
aBC / BACCALAUREAT / SERIES C, 0 ET E / EPREUVE DE CHIMIE / SESSION 2022. 2/2
Vous aimerez peut-être aussi
- Chimie 2ndecDocument35 pagesChimie 2ndecBekongo Bertrand100% (1)
- Composes AromatiquesDocument51 pagesComposes AromatiquesFatima Ben100% (1)
- TD2 Structure - 12 - 13Document7 pagesTD2 Structure - 12 - 13sidi mohamed el amine nekkalPas encore d'évaluation
- Chimie Organique - Forum de Sciences Physiques - 258866Document3 pagesChimie Organique - Forum de Sciences Physiques - 258866Younoussa Sanogo100% (1)
- COURS APC de Chimie 2nde CDocument62 pagesCOURS APC de Chimie 2nde CKessyden TatsaPas encore d'évaluation
- Livre Final de Chimie P (C D)Document90 pagesLivre Final de Chimie P (C D)Valeria PeredaPas encore d'évaluation
- Alcanes TDDocument4 pagesAlcanes TDFoufouna MariposaPas encore d'évaluation
- Serie C4-benzene-WahabDiopDocument2 pagesSerie C4-benzene-WahabDiophamd kabore100% (2)
- Exercice Corriges Nomenclature 2 (Biofaculte)Document4 pagesExercice Corriges Nomenclature 2 (Biofaculte)Wou SOUAREPas encore d'évaluation
- Épreuve 2nde C CHIMIE Seq3 FONDATIONDocument2 pagesÉpreuve 2nde C CHIMIE Seq3 FONDATIONRomario nzouPas encore d'évaluation
- Corrigé S2 Mécanismes Réactionnels II PDFDocument3 pagesCorrigé S2 Mécanismes Réactionnels II PDFJuba MakefalPas encore d'évaluation
- Série N°3 SYMETRIE MOLECULAIRE ET THEORIE DE GROUPESDocument2 pagesSérie N°3 SYMETRIE MOLECULAIRE ET THEORIE DE GROUPESleilalargate_3780929Pas encore d'évaluation
- Epreuve Probatoire 2023 Chimie Serie C-D-E CamerounDocument2 pagesEpreuve Probatoire 2023 Chimie Serie C-D-E CamerounLE BARON charlesvl GNOCKONPas encore d'évaluation
- Alcools CoursDocument4 pagesAlcools CoursNEADJ100% (1)
- 2 ChamplectrostatiqueDocument11 pages2 ChamplectrostatiquealidemesPas encore d'évaluation
- Exercices Nomenclature CorrectionDocument2 pagesExercices Nomenclature CorrectionVeronica Drg100% (1)
- Chapitre17-Composes OxygenesDocument3 pagesChapitre17-Composes OxygenesSoule Oueder100% (1)
- AlcanesDocument2 pagesAlcanesmed-salem9Pas encore d'évaluation
- DS 2 1ère C, D Chimie-1Document2 pagesDS 2 1ère C, D Chimie-1Sop TiamPas encore d'évaluation
- Série TD N3-S3-20-21Document2 pagesSérie TD N3-S3-20-21فيصل البلخلفيPas encore d'évaluation
- Chap 4 Les Composes AromatiquesDocument6 pagesChap 4 Les Composes Aromatiquestoto TOTOROTO100% (1)
- Les AlcanesDocument2 pagesLes AlcanesLine Hustling Dollar100% (1)
- Serie c1 Generalites Sur La Chimie OrganiqueDocument2 pagesSerie c1 Generalites Sur La Chimie OrganiqueMamadou saliou Ba100% (1)
- Polycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedDocument84 pagesPolycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedAbdoul SawadogoPas encore d'évaluation
- Compo 1er S S2Document2 pagesCompo 1er S S2Ismaïla Diallo0% (1)
- Chimie Organique Série 01: Alcanes Et Cyclanes: Exercice 1Document36 pagesChimie Organique Série 01: Alcanes Et Cyclanes: Exercice 1brandonPas encore d'évaluation
- Cours Les AlcanesDocument10 pagesCours Les Alcanesstefan100% (1)
- Les AlcanesDocument5 pagesLes AlcanesMahugnon Abel CodjoPas encore d'évaluation
- Alcène AlcyneDocument2 pagesAlcène AlcyneMoussa HassanPas encore d'évaluation
- Ph-Solution Aqueuse-Autoprotolyse de L'eau-TsDocument2 pagesPh-Solution Aqueuse-Autoprotolyse de L'eau-TsSeydina WadePas encore d'évaluation
- CC-Exos1 1011Document11 pagesCC-Exos1 1011Dabo100% (1)
- Semestre Evoir N de Sciences Physiques H: Exercice 1Document5 pagesSemestre Evoir N de Sciences Physiques H: Exercice 1Mohamed KonatePas encore d'évaluation
- 1ered 2021Document2 pages1ered 2021Sadat Cisse100% (1)
- Science Physique Bac Sénégal 2009Document2 pagesScience Physique Bac Sénégal 2009Line Hustling DollarPas encore d'évaluation
- Chap - II Application de La Spectroscopie UV-visible PDFDocument85 pagesChap - II Application de La Spectroscopie UV-visible PDFRija Rasolomanana50% (2)
- ALCANDocument2 pagesALCANPFE100% (1)
- AlcaneDocument4 pagesAlcaneMamadou Thioye100% (1)
- Corrigé Type TD N°10Document3 pagesCorrigé Type TD N°10Sofiane BousifePas encore d'évaluation
- Amines - Acides CarboxyliquesDocument2 pagesAmines - Acides Carboxyliquesdiengsalla diengPas encore d'évaluation
- Série D'exercices - Physique Chimie - 1ère As MR YoussefDocument2 pagesSérie D'exercices - Physique Chimie - 1ère As MR YoussefMed Brini100% (1)
- Serie Sur Les SavonsDocument2 pagesSerie Sur Les Savonskhadidiatou baldePas encore d'évaluation
- Chimie Tle CD cours+TD +Document195 pagesChimie Tle CD cours+TD +Barold David slimPas encore d'évaluation
- Exercices Corriges Avec Les AlcenesDocument5 pagesExercices Corriges Avec Les AlcenesGaëlle NGNIE100% (2)
- PC 1ere CD-C4 Le BenzeneDocument9 pagesPC 1ere CD-C4 Le BenzeneSanéPas encore d'évaluation
- BAC Corrigé - SBT - 2013Document8 pagesBAC Corrigé - SBT - 2013Bsk100% (2)
- EVAL 3 Tle F2 F3 2020 2021Document2 pagesEVAL 3 Tle F2 F3 2020 2021brice mouadjePas encore d'évaluation
- 1 Nomenclature Organique ExercicesDocument25 pages1 Nomenclature Organique Exerciceskabli ilyassPas encore d'évaluation
- TD 4 Et 5 Avec Correction 2022Document12 pagesTD 4 Et 5 Avec Correction 2022ABDELKADER SULTANE OFFICIELPas encore d'évaluation
- 1ères CD - CH REVISION N°02Document2 pages1ères CD - CH REVISION N°02NDE0% (1)
- Alcene Et Alcyne PDFDocument11 pagesAlcene Et Alcyne PDFTraoré Mamadou Tâ100% (1)
- TD1 L3S6 - 20-21Document4 pagesTD1 L3S6 - 20-21Ilias aatikPas encore d'évaluation
- Correction Epreuve Devoir Departemental Sciences Physiques TS2Document6 pagesCorrection Epreuve Devoir Departemental Sciences Physiques TS2Mame cheikh DiopPas encore d'évaluation
- Séquence 2 Chimie Première C DDocument3 pagesSéquence 2 Chimie Première C DDonfackPas encore d'évaluation
- Chimie Exemple 2 SGDocument9 pagesChimie Exemple 2 SGSerge DemirdjianPas encore d'évaluation
- BAC BLANC Chimie Théorique Tle C Et DDocument3 pagesBAC BLANC Chimie Théorique Tle C Et Db60032595Pas encore d'évaluation
- O 2 2 (Aq) 2 (L) 2 (G)Document8 pagesO 2 2 (Aq) 2 (L) 2 (G)سمير دبيليPas encore d'évaluation
- Chimie-TleC D TI-Eval4Document6 pagesChimie-TleC D TI-Eval4hamidaPas encore d'évaluation
- Derniere Ligne Droite Bacc 2023Document12 pagesDerniere Ligne Droite Bacc 2023ArchPas encore d'évaluation
- CHIMIE TleCD Janvier-2023-OlympDocument2 pagesCHIMIE TleCD Janvier-2023-OlympBorel AmiaPas encore d'évaluation
- QuestCIEC Royaume UniDocument24 pagesQuestCIEC Royaume UniAmza FarelPas encore d'évaluation
- Sujetbb 12 Spe 29 JanvDocument6 pagesSujetbb 12 Spe 29 JanvAmza FarelPas encore d'évaluation
- Mfonkam Amza: Mars 2018 - Janvier 2019Document1 pageMfonkam Amza: Mars 2018 - Janvier 2019Amza FarelPas encore d'évaluation
- Guide Ademe Isolation ThermiqueDocument17 pagesGuide Ademe Isolation Thermiquesami nasr0% (1)
- Formulaire Esta Usa 2Document2 pagesFormulaire Esta Usa 2Amza FarelPas encore d'évaluation
- CHIMIE Probatoire Blanc National Session Davril 2021 Specialite Serie DDocument4 pagesCHIMIE Probatoire Blanc National Session Davril 2021 Specialite Serie DAmza FarelPas encore d'évaluation
- Henne Wikipedia-FrDocument9 pagesHenne Wikipedia-FrAmza FarelPas encore d'évaluation
- Feuilletage 418Document24 pagesFeuilletage 418Amza FarelPas encore d'évaluation
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 pagesS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirPas encore d'évaluation
- Serie 2 PHDocument3 pagesSerie 2 PHWassim Ben TanfousPas encore d'évaluation
- Burkina 2015 Phys Chimie Serie D 1er Tour RempDocument4 pagesBurkina 2015 Phys Chimie Serie D 1er Tour RempEvrard KaborePas encore d'évaluation
- Variation Du PH Au Cours Des Dosages Acide PDFDocument13 pagesVariation Du PH Au Cours Des Dosages Acide PDFAzizElheniPas encore d'évaluation
- Chap 5 ChiDocument7 pagesChap 5 ChiMahmoud FerhatPas encore d'évaluation
- BAC CetD 2006 Chimie (Corrigé)Document5 pagesBAC CetD 2006 Chimie (Corrigé)Ousmane Diarra100% (1)
- Dev Controle 2 (2eme Année Physique)Document4 pagesDev Controle 2 (2eme Année Physique)hkiri aymenPas encore d'évaluation
- 13-14 Cours CG2Document44 pages13-14 Cours CG2Boukalmoune IbrahimPas encore d'évaluation
- tp-3 Physico Chimie Des Solution GuelmaDocument4 pagestp-3 Physico Chimie Des Solution GuelmaAmir AttafiPas encore d'évaluation
- Cours Chimie de SolutionDocument37 pagesCours Chimie de SolutionMalek abidiPas encore d'évaluation
- Dosage Acide BaseDocument5 pagesDosage Acide BaseBichou HomPas encore d'évaluation
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 pagesSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- TD Nomenclature Corrige 6Document2 pagesTD Nomenclature Corrige 6Aaouine AbderrazzakPas encore d'évaluation
- Fatma Sehli - Mayssa Ben BrahimDocument6 pagesFatma Sehli - Mayssa Ben BrahimPRED ROOMPas encore d'évaluation
- Le PH Et Sa Mesure BisDocument31 pagesLe PH Et Sa Mesure Bisstanbul20001156Pas encore d'évaluation
- Bi102-2017-Acides AminesDocument62 pagesBi102-2017-Acides AminesMà YàPas encore d'évaluation
- BAC SM 2008 2018 Acide Et BaseDocument14 pagesBAC SM 2008 2018 Acide Et BaseHAMADA1972100% (2)
- Dc3 Sadiki 2012 MathsDocument5 pagesDc3 Sadiki 2012 MathsAnis DahnenPas encore d'évaluation
- ChloreActif 27C 35CDocument2 pagesChloreActif 27C 35Cnajwa zinaouiPas encore d'évaluation
- Chapitre 5 Action de L Acide Chlorydrique Sur Les MetauxDocument3 pagesChapitre 5 Action de L Acide Chlorydrique Sur Les MetauxAgnaou MohamedPas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- Bac Ad-2024 Chimie Theo TCDDocument4 pagesBac Ad-2024 Chimie Theo TCDfastdinho1011Pas encore d'évaluation
- Chimie Pratique Laboratoire: Preparation D'Une Solution D'Indicateur de PHDocument3 pagesChimie Pratique Laboratoire: Preparation D'Une Solution D'Indicateur de PHLuna LunePas encore d'évaluation
- Correction de La Série de Révision Sur Les Acides Et Les BasesDocument7 pagesCorrection de La Série de Révision Sur Les Acides Et Les BaseschadaPas encore d'évaluation
- Chimie en SolutionDocument91 pagesChimie en Solutionanaselkasmi68Pas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Cor-Exercices Revision C2Document4 pagesCor-Exercices Revision C2Achraf HouilaPas encore d'évaluation
- Ta TacDocument4 pagesTa TacSalah-Eddine Saidi100% (1)
- Sujet Chimie FMSP 2008Document2 pagesSujet Chimie FMSP 2008Karen DominiquePas encore d'évaluation
- Indice de LangelierDocument8 pagesIndice de LangelierEspoirVungingaByawendePas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)