Académique Documents
Professionnel Documents
Culture Documents
TPCorrCeFe 4
Transféré par
Amelie Pinchon100%(1)100% ont trouvé ce document utile (1 vote)
83 vues2 pagesTitre original
TPCorrCeFe-4
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
100%(1)100% ont trouvé ce document utile (1 vote)
83 vues2 pagesTPCorrCeFe 4
Transféré par
Amelie PinchonDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
CORRECTION TP : DOSAGE POTENTIOMETRIQUE DU FER
II Premier dosage rapide: suivi colorimétrique
1. Equation de la réaction: Fe2+ + Ce4+ = Fe3+ + Ce3+
2. Au début du dosage, il y a dans le bécher des ions Fe2+, qui forment un complexe avec l'orthophénanthroline de
couleur rouge Fe(o-phen)32+.
Avant l'équivalence, il y a toujours des Fe2+, donc le complexe Fe(o-phen)32+: la solution est rouge car la couleur de ce
complexe est très intense.
A l'équivalence, il y a dans le milieu des ions Fe3+, qui forment le complexe Fe(o-phen)33+, de couleur bleue et les ions
Ce3+, incolores: la solution est légèrement bleutée.
Après l'équivalence, le complexe bleu est toujours présent, mais les ions Ce4+, maintenant en excès et de couleur jaune
imposent leur couleur à la solution.
3. Le volume équivalent trouvé est de l'ordre de 10 mL. Par CFe.V=C0.Veq donc CFe = C0.Veq/V = 0,050 mol/L.
Pour estimer l'incertitude, il faut tenir compte:
- de l’incertitude sur la concentration de la solution en cérium : la plus importante mais non estimable.
- de l'incertitude de la pipette jaugée
- de l'incertitude de la burette, qui correspond à celle sur le volume équivalent.
2 2
∆𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒 ∆𝑉𝑝𝑖𝑝𝑒𝑡𝑡𝑒
L'incertitude est donc: ∆𝐶 = 𝐶. √( 𝑉𝑒𝑞
) +(𝑉 )
𝑝𝑖𝑝𝑒𝑡𝑡𝑒
III Second dosage précis: suivi potentiométrique
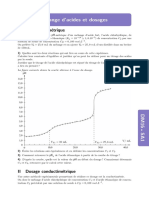
4. La courbe E=f(V) présente un saut de potentiel. On
donne ci-dessous la courbe de simulation du dosage.
Cette simulation ne tient pas compte du mur du
solvant et donne le potentiel de l’électrode de platine,
et non celui de la différence de potentiel mesurée.
5. Le volume équivalent est toujours de l'ordre de 10
mL. Pour les incertitudes, la plus grande incertitude est
due à la détermination du volume équivalent. Suivant
le nombre de points pris, la précision du tracé, cette
incertitude évolue et n'est plus vraiment due à la
burette mais au tracé…
2 2
∆𝑉𝑒𝑞 ∆𝑉𝑝𝑖𝑝𝑒𝑡𝑡𝑒
∆𝐶 = 𝐶. √( ) +( )
𝑉𝑒𝑞 𝑉𝑝𝑖𝑝𝑒𝑡𝑡𝑒
6. On peut faire un tableau d'avancement pour trouver les différentes quantités de matière. Il faut faire attention qu'on
mesure à chaque fois une différence de potentiel… soit e=E-Eref. E est donné par:
Avant l'équivalence, c'est le fer qui impose son potentiel:
3+ ]
𝑛𝐹𝑒 3+
°
[𝐹𝑒 ° 𝑉 ) = 𝐸 ° + 0,06. log ( 𝐶0 . 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒
𝐸 = 𝐸𝐹𝑒𝑟 + 0,06. log ( ) = 𝐸𝐹𝑒𝑟 + 0,06. log ( 𝑛𝐹𝑒 2+ 𝐹𝑒𝑟 )
[𝐹𝑒 2+ ] 𝐶𝐹𝑒 . 𝑉 − 𝐶0 . 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒
𝑉
°
𝐶0 . 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒 °
𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒
= 𝐸𝐹𝑒𝑟 + 0,06. log ( ) = 𝐸𝐹𝑒𝑟 + 0,06. log ( )
𝐶0 . (𝑉𝑒𝑞 − 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒 ) 𝑉𝑒𝑞 − 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒
Après l'équivalence, c'est le cérium qui impose son potentiel (bien qu’en réalité, on voit le mur du solvant:
𝑛𝐶𝑒 4+
[𝐶𝑒 4+ ] 𝑉𝑏𝑢𝑟𝑒𝑡𝑡𝑒 − 𝑉𝑒𝑞
°
𝐸 = 𝐸𝐶𝑒 + 0,06. log ( 3+ ) = 𝐸𝐶𝑒 + 0,06. log ( 𝑛 𝑉3+ ) = 𝐸𝐶𝑒
° °
+ 0,06. log ( )
[𝐶𝑒 ] 𝐶𝑒 𝑉𝑒𝑞
𝑉
7. Le potentiel du couple du cérium ne peut pas être atteint, car l'eau est oxydée avant celui-ci.
1
TP : DOSAGE POTENTIOMETRIQUE DU FER
GRILLE DE CORRECTION
DOMAINE COMPETENCE ACQUISE? NOTATION
- Ecrire correctement l’équation de dosage /0,25
Analyser - Expliquer correctement les couleurs observées /0,5
- Estimer correctement les potentiels impliqués /0,5
- Mettre en œuvre le protocole de manière sécurisé /0,5
Réaliser - Utiliser de manière correcte :
- le potentiomètre /0,5
- Les volumes équivalents sont indiqués /0,25
Valider - Les incertitudes sont correctement estimées /0,75
- La courbe de potentiel en fonction du volume est fournie /0,75
- Le graphique est tracé correctement (titre, axes…) /0,75
Communiquer - Le compte-rendu est propre et un soin tout particulier est apporté /0,25
au français.
- Chaque élève s’implique dans la réalisation du TP Malus
Etre autonome - Une aide de l’enseignante est sollicitée de manière pertinente et Malus
mesurée
Vous aimerez peut-être aussi
- Les Reactions D'oxydo ReductionDocument6 pagesLes Reactions D'oxydo ReductionAntoine de BeughemPas encore d'évaluation
- transformations-spontanees-dans-les-piles-et-production-d-energie-exercices-non-corriges-5Document5 pagestransformations-spontanees-dans-les-piles-et-production-d-energie-exercices-non-corriges-5qwerty aertyPas encore d'évaluation
- Cours Dynamique Des StructuresDocument2 pagesCours Dynamique Des StructuresAbderrahim Boulanouar100% (1)
- 31-104 Optique Miroirs PDFDocument13 pages31-104 Optique Miroirs PDFKheria ZitouniPas encore d'évaluation
- Série Unité NucléaireDocument6 pagesSérie Unité NucléaireابومحمدطهPas encore d'évaluation
- Activité Chapitre 4 Chimie Facteurs Cinétiques Et de LDocument3 pagesActivité Chapitre 4 Chimie Facteurs Cinétiques Et de LMalia TATEPas encore d'évaluation
- Poly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireDocument13 pagesPoly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireSélène Chausson100% (1)
- CHAPITRE III La SolubilitéDocument9 pagesCHAPITRE III La Solubilitéfullhd qatkaPas encore d'évaluation
- Serie de RevisionDocument3 pagesSerie de Revisionacademie archimedePas encore d'évaluation
- Cours - Chimie - Solubilité Et Précipitation Des Électrolytes - 3ème Informatique (2017-2018) MR Hedfi KhemaisDocument3 pagesCours - Chimie - Solubilité Et Précipitation Des Électrolytes - 3ème Informatique (2017-2018) MR Hedfi KhemaisBAATOUT OUMAIMAPas encore d'évaluation
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 pagesDM16 1112 - Dosage PH Metrique Es PDFEmma LovaPas encore d'évaluation
- Corrige Du Concours de Medecine Epreuve de Physique CorrectionDocument5 pagesCorrige Du Concours de Medecine Epreuve de Physique CorrectionDr. BENRAMDANEPas encore d'évaluation
- Exercices Corriges Equilibrer Des Reactions Nucleaires Reaction de Fusion Dans Le SoleilDocument3 pagesExercices Corriges Equilibrer Des Reactions Nucleaires Reaction de Fusion Dans Le Soleilroudy100% (1)
- Rappel - ThermoDocument18 pagesRappel - ThermoEmmanuel smith TaïgaPas encore d'évaluation
- TS - BAC Blanc N°1 - ObligatoireDocument9 pagesTS - BAC Blanc N°1 - ObligatoirephytanjaPas encore d'évaluation
- BAC Physique-Chimie-Specialite 2009 SDocument11 pagesBAC Physique-Chimie-Specialite 2009 SLetudiant.fr100% (7)
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pages4 Exercice Suivi D'une Transformation Chimiquenabil echerrarPas encore d'évaluation
- Série D'exercices - Physique Filtre - Bac Technique (2012-2013) MR Trayia NabilDocument2 pagesSérie D'exercices - Physique Filtre - Bac Technique (2012-2013) MR Trayia NabilLam LamPas encore d'évaluation
- 1 - Exercices de Fixation 2BAC FRDocument2 pages1 - Exercices de Fixation 2BAC FRboustakatbPas encore d'évaluation
- TP N°18 MODELISER UNE SOURCE REELLE DE TENSION 2022Document8 pagesTP N°18 MODELISER UNE SOURCE REELLE DE TENSION 2022Cthulhu ClassePas encore d'évaluation
- Auto InductionDocument5 pagesAuto InductionTraoré Mamadou Tâ0% (2)
- Fiche D Exos PC 3eDocument2 pagesFiche D Exos PC 3ebertin kabore100% (1)
- Suivi TeporelleDocument16 pagesSuivi TeporelleMustapha Zaki0% (1)
- DM Vendredi 27 MarsDocument6 pagesDM Vendredi 27 MarsEroline GuelciPas encore d'évaluation
- Eq Entre Phases Binaires 2019-2020 PDFDocument34 pagesEq Entre Phases Binaires 2019-2020 PDFبن الصغير البشيرPas encore d'évaluation
- Les Transformations Lentes Et Les Transformations Rapides Cours 2Document5 pagesLes Transformations Lentes Et Les Transformations Rapides Cours 2Hamza OushikhPas encore d'évaluation
- Exercice (Type Bac) Suivi Temporel D - Une Transformation ChimiqueDocument2 pagesExercice (Type Bac) Suivi Temporel D - Une Transformation ChimiquephytanjaPas encore d'évaluation
- 0607DM2 PDFDocument3 pages0607DM2 PDFFoudil Laouici100% (1)
- Charge D'un CondensateurDocument22 pagesCharge D'un CondensateurhajjajichouaibPas encore d'évaluation
- Transformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Document2 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Amine AlaoUii AlaouiPas encore d'évaluation
- Nouha Ramadan Hamou Mouna Exercices 1 Decroissance RadioactiveDocument1 pageNouha Ramadan Hamou Mouna Exercices 1 Decroissance Radioactiverihab0% (1)
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Exercices Corriges Nomenclature Distillation FractionneeDocument3 pagesExercices Corriges Nomenclature Distillation FractionneeclementzoghoPas encore d'évaluation
- Ouvrir SA Chap1 ConductimétrieDocument44 pagesOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- ChimieDocument5 pagesChimieEssamiPas encore d'évaluation
- TP - Et 100Document5 pagesTP - Et 100Droidy SpacePas encore d'évaluation
- 7SP20TE0319 Correction Exercices SyntheseDocument5 pages7SP20TE0319 Correction Exercices Synthesehxrsesxseriesandsxundedits100% (1)
- Devoir Surveille Ds de Physique de Niveau Premiere Mme MeunierDocument8 pagesDevoir Surveille Ds de Physique de Niveau Premiere Mme Meunierالغزيزال الحسن EL GHZIZAL Hassane100% (2)
- Serie 1 E Et 2 E (Cinétique Chimique) PDFDocument9 pagesSerie 1 E Et 2 E (Cinétique Chimique) PDFbouaounPas encore d'évaluation
- Suivi D Une Transformation Chimique Cours 2 2Document9 pagesSuivi D Une Transformation Chimique Cours 2 2Smove OnerPas encore d'évaluation
- Exercices 5 Suivi TemporelDocument1 pageExercices 5 Suivi TemporelMajed GharibPas encore d'évaluation
- Serie 06Document2 pagesSerie 06Omar LANGEUR100% (1)
- Chapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDDocument11 pagesChapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDKarim EL HAJJIPas encore d'évaluation
- exo-Poussee-dArchimede 230210 114058Document4 pagesexo-Poussee-dArchimede 230210 114058redfPas encore d'évaluation
- Serie 1 TransfoDocument2 pagesSerie 1 TransfoIbtissam AttaouanziPas encore d'évaluation
- 1ER-PC-CHAP 03 ExercicesDocument33 pages1ER-PC-CHAP 03 Exercicesarthur pasquet100% (1)
- Cours Dosage Acido-BasiqueDocument10 pagesCours Dosage Acido-BasiqueOussama ElfaqyrPas encore d'évaluation
- Serie de Révision15 2015 PDFDocument3 pagesSerie de Révision15 2015 PDFAzizElheniPas encore d'évaluation
- Serie5+solution 2020 2021Document3 pagesSerie5+solution 2020 2021ALI BOUANANIPas encore d'évaluation
- TD N°3 Thermo L2-GP Modifiée 2023Document2 pagesTD N°3 Thermo L2-GP Modifiée 2023Clash of Clans Bilal DzPas encore d'évaluation
- Pendule de Torsion Cours 1Document2 pagesPendule de Torsion Cours 1Hafsa HafsaPas encore d'évaluation
- Chapitre IDocument12 pagesChapitre INak awadPas encore d'évaluation
- Bac 2021 Proposition de Corrigã Physique Bac D CamerounDocument6 pagesBac 2021 Proposition de Corrigã Physique Bac D CamerounMark Tambus JhonsPas encore d'évaluation
- 2010 AmNord Exo1 Correction Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Correction Eau 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Electro Lys eDocument4 pagesElectro Lys eالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Projet scientifique Mécanique des fluides, LAGUNA Léo KUBIAK Stanley LUO Yuqian DIOT AntoineDocument5 pagesProjet scientifique Mécanique des fluides, LAGUNA Léo KUBIAK Stanley LUO Yuqian DIOT Antoinestanleyk31520Pas encore d'évaluation
- TP Électricité - Filtres ActifsDocument23 pagesTP Électricité - Filtres ActifsJoaquin Cornejo96% (24)
- tp2 OnorgaDocument13 pagestp2 OnorgaRa DjaPas encore d'évaluation
- rms119 1Document83 pagesrms119 1Martin KoebelPas encore d'évaluation
- Mémoire Haccp Eau de SourceDocument128 pagesMémoire Haccp Eau de Sourcemohammeddellouche100% (2)
- Annexe 6 Etapes Haccp Mars 2015Document25 pagesAnnexe 6 Etapes Haccp Mars 2015Oumayma NizPas encore d'évaluation
- TP C7 Vinaigre FrelatDocument3 pagesTP C7 Vinaigre FrelatAmelie PinchonPas encore d'évaluation
- Dosage Conduct DestopDocument8 pagesDosage Conduct DestopAmelie PinchonPas encore d'évaluation
- GRIESP Tle Titrage Destop 1207602Document9 pagesGRIESP Tle Titrage Destop 1207602Amelie PinchonPas encore d'évaluation
- LC21 2014-7 230308 171335Document4 pagesLC21 2014-7 230308 171335Amelie PinchonPas encore d'évaluation
- LC21 2014-7 230308 171335Document4 pagesLC21 2014-7 230308 171335Amelie PinchonPas encore d'évaluation
- TP 2Document5 pagesTP 2Zz BbPas encore d'évaluation
- TP2 Fer (II) Permanganate 1Document1 pageTP2 Fer (II) Permanganate 1Amelie PinchonPas encore d'évaluation
- Examen de EntrepreneuriatDocument14 pagesExamen de EntrepreneuriatMamadou Gueye100% (1)
- Partie II La Théorie Du Comportement de ConsommateurDocument77 pagesPartie II La Théorie Du Comportement de ConsommateuressalkagarmounePas encore d'évaluation
- 9 - Cours 9 Applications Industrielles Du Laser AggrandiDocument4 pages9 - Cours 9 Applications Industrielles Du Laser AggrandiLokman HamzaPas encore d'évaluation
- PompageDocument14 pagesPompagewithe animalsPas encore d'évaluation
- Étude de La Poussée AxialeDocument5 pagesÉtude de La Poussée Axialechahrazed bngPas encore d'évaluation
- L'Etat de Nature Chez Thomas HobbesDocument10 pagesL'Etat de Nature Chez Thomas HobbesDenisa Elena FocaruPas encore d'évaluation
- Aide Memoire Tuyauterie - CompletDocument62 pagesAide Memoire Tuyauterie - CompletMars7695% (121)
- Jeu de L'oie Épisode 3Document5 pagesJeu de L'oie Épisode 3Mery MeryPas encore d'évaluation
- Les Obstacles A La CommunicationDocument3 pagesLes Obstacles A La CommunicationSissou Bello100% (2)
- Programmation Didactique - Concours 10Document55 pagesProgrammation Didactique - Concours 10Miguel92% (13)
- LM Linear Range 12774 FRDocument248 pagesLM Linear Range 12774 FRAhmed MezniPas encore d'évaluation
- LeadershipDocument6 pagesLeadershipEvodie WestPas encore d'évaluation
- René Et Julien Sorel Ambition Et MélancolieDocument0 pageRené Et Julien Sorel Ambition Et MélancolieayouzyouftnPas encore d'évaluation
- Physique StatistiqueDocument369 pagesPhysique StatistiqueAnas Hasni86% (7)
- Il Faut Que Je Sois ParfaitDocument111 pagesIl Faut Que Je Sois ParfaitlynxnetPas encore d'évaluation
- Ifu - Lettre DgiDocument9 pagesIfu - Lettre Dgicomptabilité financière approfondiePas encore d'évaluation
- Cas - Pratique - Conduite - Du - Changement - Jean-FrançoisDocument3 pagesCas - Pratique - Conduite - Du - Changement - Jean-FrançoisFérielPas encore d'évaluation
- Les Modes de Transferts Thermique Dons Les BatimentDocument6 pagesLes Modes de Transferts Thermique Dons Les Batimentfatiha100% (1)
- Theme 1 Le Corps HumainDocument65 pagesTheme 1 Le Corps Humainmagali2m100% (1)
- CV Afiatou ToeDocument1 pageCV Afiatou ToeFranck AbPas encore d'évaluation
- SolfegeDocument24 pagesSolfegeDodaPas encore d'évaluation
- Certificat Informatique & Internet - Guide de L'apprenantDocument6 pagesCertificat Informatique & Internet - Guide de L'apprenantKhadidiatou DialloPas encore d'évaluation
- 3 - Rapport Sukuk Final PDFDocument28 pages3 - Rapport Sukuk Final PDFOussama Derwich100% (2)
- MTTH 4Document1 pageMTTH 4Anas MenoirPas encore d'évaluation
- Evangile Apocryphe de ThomasDocument10 pagesEvangile Apocryphe de ThomasYves MinougouPas encore d'évaluation
- Cours HDD ASSASNETDocument91 pagesCours HDD ASSASNETAlyssa PeixotoPas encore d'évaluation
- (CFT) Memento PDFDocument6 pages(CFT) Memento PDFlacoste123Pas encore d'évaluation
- Mobiscript 3Document77 pagesMobiscript 3wukzPas encore d'évaluation
- STA201 - Equations Structurelles - 1 - JakobowiczDocument65 pagesSTA201 - Equations Structurelles - 1 - JakobowicztchamPas encore d'évaluation
- Fiche Oral TEXTE 3 - Paysage, BaudelaireDocument2 pagesFiche Oral TEXTE 3 - Paysage, BaudelaireLola bricotPas encore d'évaluation