Académique Documents
Professionnel Documents
Culture Documents
Glyc o Proteines
Transféré par
malak kerakbiCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Glyc o Proteines
Transféré par
malak kerakbiDroits d'auteur :
Formats disponibles
Université Badji Mokhtar - Annaba
Faculté des Sciences
Département de Biochimie
Licence - L 3 (S 6) Biochimie
Matière: Structures et Fonctions des complexes formés avec les protéines
Cours: Structures et Fonctions de Glycoprotéines
PLAN
I. Glycoprotéines
I.1 Glucides fréquemment trouvés dans la partie glycaniques des glycoprotéines
I.2 Principaux types de glycosylation
I.2.1 N- glycosylation
I.2.2 O- glycosylation
I.3 Structures des chaines glycaniques
I.3.1 Structures des N- glycanes
I.3.2 Structures des O-glycanes
I.4 Rôle des glycanes
I.5 Fonctions de glycoprotéines
Conclusion
Bibliographie
I. Glycoprotéines
Les glycoprotéines sont largement répandues dans tout le règne du vivant . Elles
sont composées d'une ou plusieurs chaines glucidiques généralement ramifiées et
une partie protéique. Elles sont nombreuses et leurs fonction sont différentes.
I.1 Glucides fréquemment trouvés dans la partie glycanique des glycoprotéines
Les glycanes des glycoprotéines sont constituées de différents oses et leur
dérivés parmi lesquels il ya les composés suivants:
I.2 Principaux types de glycosylation
Chez les eucaryotes, la glycosylation des protéines est une modification co-tra-
ductionnelle ou post-traductionnelle. Le processus consiste à lier par voie enzyma-
tique l'oligosaccharide à la protéine. Sur la base de la liaison établie, il est distingué
deux principaux types de glycosylation: la N-glycosylation et la O-glycosylation.
I.2.1 N-glycosylation
La N-glycosylation des protéines est une modification co-traductionnelle.
Elle consiste à lier covalentiellement un oligosaccharide composé de 3 glucoses,
9mannoses et 2 N-acétylglucosamines Glc 3 Man 9 Glc NAc 2 à une chaine peptique
en cours de biosynthèse dès son entrée dans la lumière du réticulum endoplasmi-
que .La liaison est du type N- β glycosylamine impliquant le carbone semi-acétalique
du résidu Glc NAc, (ose terminal de l'oligosaccharide) initialement lié à un lipide
polyisoprénoide fixé à la membrane du réticulum endoplasmique du coté
cytoplasme, le dolichol préalablement phosphorylé par l'ATP en dilochol-phosphate
Glc3 Man 9 Glc NAc 2- PP-dolichol en présence de dolichol kinase et l'atome d'azote
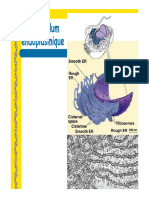
de la fonction amide du résidu accepteur l'asparagine (figure 1) d'une séquence
Figure1. Liaison entre l'azote du groupement amide de l'asparagine et le carbone
semi-acétalique du résidu N-acétylglucosamine
tripeptidique de N-glycosylation, Asn- X- Ser ou Asn - X- Thr ( X étant n'importe
quel acide aminé sauf proline) reconnue par l'enzyme membranaire de type
glycosyltranférase chargée de catalyser la réaction.
Durant l'élongation de la chaine polypetidique, des résidus glucidiques
de l'oligosaccharide sont clivés. Des glycosidases libèrent succèssivement 2 glucoses
( glucosidases 1) puis un glucose (glucosidases 2) et un mannose ( α- mannosidases 1
- ER Man 1). Cela conduit à la formation de Man8 Glc NAc 2. Les glycoprotéines sont
transférées par des vésicules de transport vers l'appareil de Golgi ou se poursuit la
maturation de l'oligosaccharide par le clivage et l'élimination de résidus mannose et
l'addition séquentielle de d'autres résidus glucidiques. Ces derniers provenant des
glucides nucléotides sont acheminés du cystol au compartiment golgien complexés à
la Guanosine diphosphate (GDP), l'Uridine diphosphate ( UDP) et la Cytidine mono-
phosphate( CMP). Le transfert du monosaccharide est réalisé par des transférases
qui portent le nom du glucide qu'elles conjuguent.
UDP- Glucide + Glycoprotéine--------------------- Glycoprotéine-Glucide + UDP
glycosyltransférase
UDP---------------------------------- UMP+ Pi
nucléoside diphosphate phosphatase
Les modifications se produisent dans les compartiments golgiens comme suit:
- Dans le compartiment Cis: Les α 1,2 - mannosidases (Golgi Man 1) éliminent trois
unités de mannose générant Man 5 Glc NAc 2. Ce dernier conduit à des N-glycanes
de type hybride et complexe.
- Dans le compartiment Médian: A ce niveau, le transfert d'un résidu Glc NAc termi-
nal par la Glc NAc transférase 1 et la coupes du mannose par la golgiα-mannosidase2
permettent la formation de Glc NAc 1 Man 3 Glc NAc 2.
-Dans le compartiment Trans: Différentes glycosyltransférases ajoutent séquentielle-
ment des résidus d'oses provenant de glucide-nucléotides. Il en résulte des chaines
d'oligosaccharides ramifiées et de longueur variable composées de Glc NAc(N-acétyl-
glucosamine), de galactose( Gal), de fucose( Fuc)etde N-acétylneuraminique présen-
tent dans les N-glycoprotéines membranaires ou sécrétées.
Remarque: Lorsque Man9GlcNAc2 est phosphorylé en position 6 de certains résidus
de mannose, la maturation des N-glycanes de type complexe et hybride est bloquée
mais celle des N-glycanes riches en mannose (oligomannosidique) présents dans les
glycoprotéines qui vont rejoindre les lysosomes est engagée.
I.2.2 O-glycosylation
La O-glycosylation est une modification post-traductionnelle. La liaison
glycane-protéine implique la fonction alcool du carbone hémiacétalique d'un mono-
saccharide et l'hydroxyle alcool d'un acide aminé hydroxylé ( Acide aminé-Monosac-
charide: Ser/Thr - α-GalNAc, Ser/Thr-β-Man, Ser/Thr-β-GlcNAc, Ser-β-Xyl, Ser-β-Glc
NAc, Hydroxy-Lys-α-Gal, Hydroxy-Pro-β-L-f Ara, Tyr-αGal). Les chaines glycanes sont
synthétisées par l'ajout, par étape, des glucides issus des glucides nucleotides, cataly
sé par des glycosyltransférases. Le processus se réalise dans l'appareil de Golgi médi
an et trans pour la plupart des protéines.La O-glycosylation la plus répandue comm-
ence par la N-acétylgalactosamine (GalNAc). La liaison est entre l'atome de carbone
hémiacétalique de la N-acétylgalactosamine et l'oxygène de l'hydroxyle de la chaine
latérale d'un acide aminé sérine ou thréonine de chaines peptidiques(figure2). Cette
Figure2. Liaison entre l'oxygène du groupement hydroxyle de la sérine et le
carbone semi-acétalique du résidu N-acétylgalctosamine
réaction est catalysée par une transférase UDP-GalNAc: protéine α -GalNAc transfé-
rase dont l'expression est tissus/cellule spécifique. Contrairement à la N-glycosylati-
on, aucune séquence d'acides aminés constante n'est identifiée autour des résidus
de sérine ou de thréonine glycosylables. L'élongation de cette amorce se fait par
l'addition des résidus de galactose , de N-acétylglucosamine, de N-acétylgalactosa-
mine, de fucose et d'acide sialique. Le transfert du monosaccharide est effectué par
des transférases telles que les galactosyl-, N-acétylglucosaminyl-,
N-acétylgalactosaminyl-, fucosyl-, sialyl-(ou neuraminyl- transférase. Il existe de
nombreuses variations dans la composition en glucides et dans la longueur des
chaines oligosaccharides.
I.3 Structures des chaines glycaniques
I.3.1 Structures des N-glycanes
Les structures des N-glycanes peuvent varier considérablement entre différen-
tes espèces, les tissus ou les protéines. Elles ont un noyau invariant composé de 2
résidus N-acétylglucosamine et 3 résidus de mannose Man3GlcNAc2. Sur les manno-
ses terminaux de ce pentasaccharide, des antennes qui sont des chaines d'oligosacc-
harides sont fixées. Selon la composition en résidus glucidiques des antennes, il est
distingué trois types principaux de N-glycanes: riche en mannose ou oligomannosidi-
que, complexe et hybride ou mixte (figure 3)
Figure 3. N-glycanes de type oligomannosidique (a), complexe(b) et hybride(c).
Le noyau en rouge correspond au pentasaccharide commun à tous les N-glycanes.
Les ramifications en noir correspondent aux différentes antennes.
* N-glycanes de type riche en mannose ou oligomannosidique: Ils ont des antennes
composées uniquement de résidus d'α-Man. Ils peuvent comporter de 4 à 9 résidus
Man.
* N-glycanes de type complexe: Ils sont bi-, tri-, tétra- et penta-antennés. Ils ont des
antennes plus ou moins longues constituées de N-acétyllactose Galβ(1-4)-GlcNAc,
N-acétylgalactosamine GalNAc, fucose Fuc et acides sialiques.
*N-glycanes de type hybride ou mixte: Ils sont des intermédiaires entre les N-glyca-
nes riche en mannose et complexe. Ils ont des antennes oligomannosidiques au ni-
veau de la branche Man(α1-6) du noyau pentasaccharidique, et des antennes de
type complexe sur la branche Man(α1-3).
I.3.2 Structures des O-glycanes
Les chaines glycaniques sont beaucoup plus variées que celles des N-glycoproteines.
Elles sont courtes et constituées le plus souvent de 1,2, voire 3 résidus osidiques. Les
O-glycanes sont caractérisées par les noyaux suivants:
Galβ1-3GalNAc, GlcNAcβ1-6(Galβ1-3)GalNAc,GlcNAcβ1-3GalNAc,GlcNAcβ1-6(GlcNAβ
1-3)GalNAc, GalNAc α1-3GalNAc, GlcNAcβ1-6GalNAc, GalNAc α 1-6 GalNAc, Gal α1-3
GalNAc. Les résidus de Gal, GlcNAc et GalNAc forment le noyau GlcNAc-β1-6-GalNAc
et le noyau Gal-β1-3-(GlcNAc-β1-6)GalNAc les plus répandus chez la plupart des ma-
mifères. Ils entrent dans la structure chimique des mucines ainsi que celles des gly-
coprotéines membranaires et sécrétées. L'ensemble des trois oses est le noyau le
plus commun des O-glycanes.
I.4. Rôle des glycanes
La partie glycanique des glycoprotéines est très importante. Elle représente1à 80%
de la molécule. Une quantité de glycanes conséquente permet d'augmenter la solu-
bilité des glycoprotéines. Le nombre de liaisons hydrogène et ionique et les intérac
-tions hydrophobes établi entre glycane-glycane et glycane-chaine peptidique parti-
cipent au maintien de la conformation tridimensionnelle responsable de la fonction
biologique de la molécule. La structure rigidifiée résiste à l'ouverture et
au dépliement de l'arrangement spatial de la chaine peptidique sous l'effet de la
chaleur. Les glycanes masquent les sites de clivage par les protéases. Ils permettent
à des agents ( virus,parasites et bactéries) d'éviter les défenses immunitaires de
l'hôte en masquant certains épitopes ou en modifiant leur conformation. Ils
interviennent dans les phénomènes cellulaires de reconnaissance.
I.5 Fonctions de glycoprotéines
Les glycoprotéines existent dans les fluides et dans les cellules dans lesquels elles
ont des fonctions précises. Certaines d'entre elles sont douées des activités suivante:
Fonction (exemple de glycoprotéine)
- Transport (transferrine)
- Défense de l'organisme (heptaglobine)
- Réaction d'oxydation( enzymes microsomales, céruloplasmine)
- Inhibition de protéases (α2 macroglobuline)
- Adhésion cellulaire (Immunoglobulines, cadhérines, sélectines, intégrines)
-Reconnaissance cellulaire ( glycoprotéines des groupes sanguins)
- Récepteurs des protéines( glycoprotéines transmembranaires: récepteurs au gluca-
con, récepteurs des gonadotropines FSH,TSH et LH), récepteurs aux sécrétines,récep-
teurs de la somatostatine)
Conclusion
De nombreuses protéines sont des glycoprotéines. Il existe la N-glycosylation et la
O-glycosylation.Les chaines oligosaccharidiques sont synthétisées grâce à l'action des
glycosidases et des glycosyltransférases. Il existe une très grande diversité de chaines
glycaniques. Ces dernières sont principalement responsables des fonctions
biologiques des glycoprotéines.
Bibliographie
1. Benjouad A , Fenouillet E. Réponse immune contre les glycopro-
téines d'enveloppe du virus de l'immunodéficence humaine: la glycosylation,
bouclier ou talon d'Achille? médecine/sciences 1994; 10: 544-50.
2. Alexandra C. Walls, Youg- Ju Park, M. Alejendra Tortorici , Abigail Wall, Andrew T.
Mc Guine, David Weesler. Structure, Function, and Antigenicity of the SARS-COV-2
Spike Glycoprotein. Cellule 2020 ; 181 (2): 281-292.
3. Arnold JN, Wormald MR, Slim R B, Rudd PM , Dwek R.A. The impact of glycosylati-
on the biological fuction and structure of human immunoglobulins . Ann Ren Immu-
nol 2007; 25: 21-50.
4.Clausen H, Bennet E P. A family of UDP-Gal NAc: polypeptide
N-acetylgalactosaminyl-transferase control of mucin type O- linked glycosylation.
Glycobiology 1996; 6: 635-646.
5. Elbein AD. Inhibitors of the biosynthesis and processing of N-linked oligosacchari-
de chains. Ann Rev Biochem 1987; 56: 497-534.
6. Fenouillet E. La N-glycosylation de VIH: du modèle experimental à l'app-
lication thérapeutique. medecine/sciences 1993; 9:901-6
7. Hounsell E F, Michael J D, Renouf D V. O-linked protein glycosylation struc-
ture and function. Glycoconj J 1996; 13: 19-26.
8. Jones J, Krag SS, Betenbaugh M J . Controlling N-linked glycan site occupancy.
Biochem Biophys Acta 2005; 1726: 121-37.
9. Kornfeld R, Kornfeld S. Assembly of asparagines-linked oligosaccharides. Ann Rev
Biochem 1985; 54: 631- 64
10.Moneret-Vautrin D A. Les allergènes alimentaires et leurs modifications par les
les technologies agroalimentaires. Rev fr Allergol, 1997; 37(1): 21-28
11. Stefan Gaunitz, Gabe Nagy, Nagy, Nicola LB Pohl, Milos V Novotny. Progrès
récents dans l'analyse des glycoprotéines complexes. Ann chim 2017; 89(1): 389-413
12. Weil, Jacques-Henry,(2009): Biochimie Générale. DUNOD, 760 p.
Vous aimerez peut-être aussi
- Poly 03-Metabolisme Des GlucidesDocument52 pagesPoly 03-Metabolisme Des Glucidessafemind100% (1)
- Bioch Pharm2an-Metabolisme GlucidesDocument28 pagesBioch Pharm2an-Metabolisme GlucidesmaryPas encore d'évaluation
- GlycoproteinesDocument16 pagesGlycoproteinesAannaxePas encore d'évaluation
- Les GlycoproteinesDocument3 pagesLes GlycoproteinesFatima BENHAFSSAPas encore d'évaluation
- Biochimie2an-Metabolisme Glucogene2019kouiderDocument10 pagesBiochimie2an-Metabolisme Glucogene2019kouiderrahma bouadamPas encore d'évaluation
- Chapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)Document17 pagesChapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)stephen njemsPas encore d'évaluation
- APPAREIL G Bis 2017-1Document19 pagesAPPAREIL G Bis 2017-1laarabPas encore d'évaluation
- GagDocument6 pagesGagAmine BouarfaPas encore d'évaluation
- Cours de MetabolismeDocument69 pagesCours de Metabolismeleonce kadjiPas encore d'évaluation
- Fichier Produit 1984 PDFDocument25 pagesFichier Produit 1984 PDFManel MedPas encore d'évaluation
- Biochimie2an-Metabolisme Glucogene2019Document48 pagesBiochimie2an-Metabolisme Glucogene2019Kenza KassabPas encore d'évaluation
- 04 - M-Tabolisme Des Glucides - 01 - EndDocument44 pages04 - M-Tabolisme Des Glucides - 01 - Endhoudahoudahh262Pas encore d'évaluation
- Chapitre 8Document9 pagesChapitre 8yvesPas encore d'évaluation
- Le COLLAGÈNEDocument37 pagesLe COLLAGÈNEIhab Nedjem EdinnePas encore d'évaluation
- Genie BiochimieDocument41 pagesGenie Biochimieddiouk2Pas encore d'évaluation
- Ali Abbou Sid AhmedDocument22 pagesAli Abbou Sid Ahmedaliabbousidahmed3Pas encore d'évaluation
- Biochimie1an Glycolyse2022ferganiDocument8 pagesBiochimie1an Glycolyse2022ferganiKhelassi OussamaPas encore d'évaluation
- NEOGLUCOGENEDocument7 pagesNEOGLUCOGENEMira45Pas encore d'évaluation
- Metabolisme Des GlucidesDocument29 pagesMetabolisme Des GlucidesSylvert DjéranéPas encore d'évaluation
- Métabolisme Des Glucides DR - Khebbat Zerargui F.Document68 pagesMétabolisme Des Glucides DR - Khebbat Zerargui F.oumnia mairechePas encore d'évaluation
- Glycolyse - Wikipédia PDFDocument8 pagesGlycolyse - Wikipédia PDFwxcvbnnbvcxwPas encore d'évaluation
- Microsoft Word - NeoglucogeneseDocument8 pagesMicrosoft Word - NeoglucogeneseDaniel PardejoPas encore d'évaluation
- Metabolisme Du GlycogeneDocument8 pagesMetabolisme Du GlycogeneFrançois John WilliamsPas encore d'évaluation
- Métabolisme Du Glycogéne 2021 TransmisDocument35 pagesMétabolisme Du Glycogéne 2021 TransmisGuy Morel KouacouPas encore d'évaluation
- Métabolisme Des GlucidesDocument28 pagesMétabolisme Des GlucidesilaPas encore d'évaluation
- Biochimie NeoglucogeneseDocument5 pagesBiochimie NeoglucogeneseHind BerradiPas encore d'évaluation
- Metabolisme Du GlycogeneDocument4 pagesMetabolisme Du GlycogeneJérémie barakaPas encore d'évaluation
- Métabolisme Des GlucidesDocument22 pagesMétabolisme Des Glucideswww.rourita99Pas encore d'évaluation
- Cours 4 MaturationDocument42 pagesCours 4 Maturationjeangredin2Pas encore d'évaluation
- Chapitre 3 Maturation Des ProtéinesDocument34 pagesChapitre 3 Maturation Des Protéinesryadh2203Pas encore d'évaluation
- Biochimie2an Glycolyse2019kouiderDocument11 pagesBiochimie2an Glycolyse2019kouiderrahma bouadamPas encore d'évaluation
- Bioch2an27 NeoglucogeneseDocument9 pagesBioch2an27 NeoglucogeneseIngenieur AgroPas encore d'évaluation
- Catabolisme Des GlucidesDocument11 pagesCatabolisme Des Glucidesevident 2014Pas encore d'évaluation
- Le GlucagonDocument6 pagesLe GlucagonRacem Boudghene stambouliPas encore d'évaluation
- 1 GlycolyseDocument56 pages1 Glycolysesoubin kimPas encore d'évaluation
- Glycogen eDocument9 pagesGlycogen esaidhassanefilsPas encore d'évaluation
- Cours3 Métabolisme GlucidesDocument15 pagesCours3 Métabolisme GlucidesOrnel RistelPas encore d'évaluation
- NeoglucogeneseDocument35 pagesNeoglucogenesecepPas encore d'évaluation
- Cours NéoglucogenèseDocument8 pagesCours NéoglucogenèseaxelPas encore d'évaluation
- 5.le Métabolisme 2017 2018 L2Document8 pages5.le Métabolisme 2017 2018 L2tema djdPas encore d'évaluation
- Cours 8 A GLYCOLYSEDocument15 pagesCours 8 A GLYCOLYSELina BernoussiPas encore d'évaluation
- Biochim 23Document6 pagesBiochim 23Ambre LarivierePas encore d'évaluation
- Metabolisme Des Glucides PR SAADI OUISLIM A.SDocument13 pagesMetabolisme Des Glucides PR SAADI OUISLIM A.SDemba Tahirou DIOPPas encore d'évaluation
- Métabolisme Des GlucidesDocument63 pagesMétabolisme Des GlucidesKdimosaure KdimoPas encore d'évaluation
- Biochimie Devoir Groupe 6Document4 pagesBiochimie Devoir Groupe 6mamisoaella3Pas encore d'évaluation
- Correction TD Metabolisme Glucidique 2Document31 pagesCorrection TD Metabolisme Glucidique 2acheparfaite958Pas encore d'évaluation
- 1.métabolisme Des Glucides GlycolyseDocument39 pages1.métabolisme Des Glucides GlycolyseboubouothnielPas encore d'évaluation
- DM N°3 SujetDocument10 pagesDM N°3 SujetnaimPas encore d'évaluation
- Bloc2 5Document9 pagesBloc2 5NsangwaPas encore d'évaluation
- Corrigé Type (1) (6837)Document3 pagesCorrigé Type (1) (6837)Dina DerichePas encore d'évaluation
- 01.1 Introduction Aux GlucidesDocument2 pages01.1 Introduction Aux Glucideswassimm31Pas encore d'évaluation
- Fichier Produit 1945Document64 pagesFichier Produit 1945Antz DanielPas encore d'évaluation
- 3 Métabolisme Partie 2 - 230503 - 135245910Document21 pages3 Métabolisme Partie 2 - 230503 - 135245910oeuildetigrePas encore d'évaluation
- 1 Metabolisme GlucidesDocument14 pages1 Metabolisme GlucidesAodPas encore d'évaluation
- IntroductionDocument24 pagesIntroductioncepPas encore d'évaluation
- NEOGLUCOGENESEDocument10 pagesNEOGLUCOGENESEZack EmyPas encore d'évaluation
- Métabolisme Des GlucidesDocument58 pagesMétabolisme Des GlucidesHäsnã HäsnãPas encore d'évaluation
- Métabolisme Du GlycogèneDocument2 pagesMétabolisme Du Glycogènenoujdi taniaPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation