Académique Documents
Professionnel Documents
Culture Documents
2008 Reunion Exo3 Correction Alcoolemie 4pts
Transféré par
badraf1590 évaluation0% ont trouvé ce document utile (0 vote)
40 vues1 pageSuiver tomporel
Titre original
2008-Reunion-Exo3-Correction-Alcoolemie-4pts
Copyright
© © All Rights Reserved
Formats disponibles
DOC, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentSuiver tomporel
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
40 vues1 page2008 Reunion Exo3 Correction Alcoolemie 4pts
Transféré par
badraf159Suiver tomporel
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
Réunion 2008 EXERCICE III : Taux d’alcoolémie (4 points) – Correction © http://labolycee.
org
1.Choix de la méthode de suivi
1.1. L’ion dichromate ainsi que l’ion chrome (III) colorent la solution. Cette coloration de la solution va
donc changer en fonction de l’apparition des ions chrome (III) et/ou la disparition des ions chromate. La
réaction pourra donc être suivie par spectrophotométrie.
1.2. La spectrophotométrie est une méthode de mesure non-destructive car le système chimique n'est
pas modifié par le passage de la lumière au cours de la mesure.
2. Suivi temporel
2.1. On sélectionne la longueur d’onde qui correspond au maximum d’absorption de l’espèce chimique
étudiée.
2.2.
3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16H+(aq) = 3CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l)
Équation
État initial n0 n1 Excès 0 0 Beaucoup
État
n0 – 3x n1 – 2x Excès 3x 4x Beaucoup
intermédiaire
État final n0 – 3xéq n1 – 2xéq Excès 3xéq 4xéq Beaucoup
2.3. [Cr2O72-(aq)] =
[Cr2O72-(aq)].V = n1 – 2x donc x= .(n1 – [Cr2O72-(aq)].V)
2.4. A = 150. [Cr2O72-(aq)] donc [Cr2O72-(aq)] =
x= .(n1 – .V) = .(c.V’ – .V) avec V’ = 10 mL = 1010–3 L
x= .(2,0.10–2 10×10–3 – ×12×10–3) = (2010–5 –8,010–5A) = (10 – 4A).10–5 mol
2.5. Lorsque l’absorbance n’évolue plus c’est que [Cr2O72–] n’évolue plus.
L’avancement est alors maximal, car la
transformation est totale.
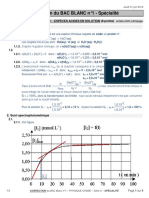
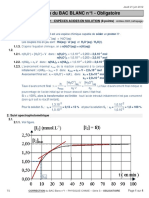
Graphiquement pour x = xmax, on a Af = 2,39.
xmax = (10 – 4. Af).10–5
xmax = (10 – 4×2,39)×10–5 = 4,410–6 mol.
Si l’éthanol est en limitant, cela signifie que
les ions dichromate sont en excès. Donc en
fin de réaction, il resterait des Cr2O72–.
Vérifions cette hypothèse :
n(Cr2O72–)finale = n1 – 2xmax
Amax
n(Cr2O72–)finale = c.V’ – 2 xmax
n(Cr2O72–)finale = 2,0.10–2 10×10–3 – 24,410–6
n(Cr2O72–)finale 0, l’ion dichromate est en
excès, l’éthanol est limitant.
2.6. L’éthanol est totalement consommé, soit n0 – 3xmax = 0.
Donc n0 = 3xmax, quantité de matière contenue dans 2,0 mL de sang.
Dans 1,0 L de sang la quantité de matière d’éthanol est n = n0 = 3xmax .
Alors la masse d’éthanol est m = n.M = 34,4x10–6 46 = 0,30 g pour un litre de sang. Le
conducteur n’est pas en infraction puisque cette alcoolémie est inférieure à 0,5 g/L.
Vous aimerez peut-être aussi
- 2008 Reunion Exo3 Correction Alcoolemie 4ptsDocument1 page2008 Reunion Exo3 Correction Alcoolemie 4ptsdansoujosemorelePas encore d'évaluation
- DM5 Methodes de Suivi Cinetique CorrectionDocument4 pagesDM5 Methodes de Suivi Cinetique CorrectionIkram ChamixoPas encore d'évaluation
- 2-Correction Suivi Temporel Facultatif 2022 - 231016 - 195621Document3 pages2-Correction Suivi Temporel Facultatif 2022 - 231016 - 195621rkibi.khadija2006Pas encore d'évaluation
- Devoir 3 Modele 3 Corrige 1Document5 pagesDevoir 3 Modele 3 Corrige 1hessasPas encore d'évaluation
- DS2 Correction LMA 09 11 2019 Avancement - OxydoreductionDocument4 pagesDS2 Correction LMA 09 11 2019 Avancement - Oxydoreductiondiomande Aminata Sarah FatimPas encore d'évaluation
- Coorectionv Exercices TypesDocument11 pagesCoorectionv Exercices TypesJulian BaliaPas encore d'évaluation
- 2011 Antilles Exo1 Correction Luminol 6 5pointsDocument3 pages2011 Antilles Exo1 Correction Luminol 6 5pointsmohamedPas encore d'évaluation
- Correction de La Fiche 1Document5 pagesCorrection de La Fiche 1LARIBIPas encore d'évaluation
- Correction DS ExempleDocument4 pagesCorrection DS ExempleAngélique GUAZPas encore d'évaluation
- TD Eq Chim 1ereDocument14 pagesTD Eq Chim 1ereyassine yazidiPas encore d'évaluation
- 2006 Pondichery Exo1 Correction Acide BaseDocument2 pages2006 Pondichery Exo1 Correction Acide BasegrajzgrPas encore d'évaluation
- TP5' ChimieDocument2 pagesTP5' Chimiebouaiedanissa61Pas encore d'évaluation
- C3Chim - Transformations - Limitees - Exercices - Sabatier PDFDocument5 pagesC3Chim - Transformations - Limitees - Exercices - Sabatier PDFAzizElheni0% (1)
- Entrainement Physique-Chimie Ts PDFDocument2 pagesEntrainement Physique-Chimie Ts PDFEl Hadje CoulibalyPas encore d'évaluation
- Chimie Et SpéléologieDocument5 pagesChimie Et SpéléologieقببقصPas encore d'évaluation
- Corrige Ex BACDosage Jus CitronDocument2 pagesCorrige Ex BACDosage Jus CitronPhysique Chimie au Lycée CoubertinPas encore d'évaluation
- C08 Avancement Activites Corr PDFDocument3 pagesC08 Avancement Activites Corr PDFbessama84Pas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- Cor-Exercices Revision C2Document4 pagesCor-Exercices Revision C2Achraf HouilaPas encore d'évaluation
- TD2 Correction PDFDocument8 pagesTD2 Correction PDFKhadija LakhdiriPas encore d'évaluation
- Exercice Eau Oxygenee + Corrige PDFDocument3 pagesExercice Eau Oxygenee + Corrige PDFCamusPas encore d'évaluation
- Cinétique Chimique TD Corrigé 05Document8 pagesCinétique Chimique TD Corrigé 05elie mij kisalePas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFSaifeddine MakniPas encore d'évaluation
- DS N3 CorrectionDocument4 pagesDS N3 Correctionالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 6 - S4 Corrigé S1Document4 pages6 - S4 Corrigé S1Oussam Ouadidi100% (2)
- TS - BAC Blanc N°1 Corrigé - ObligatoireDocument4 pagesTS - BAC Blanc N°1 Corrigé - ObligatoirephytanjaPas encore d'évaluation
- Exercices Corrigés Chimie Des Électrolytes SMC s3Document21 pagesExercices Corrigés Chimie Des Électrolytes SMC s3yassine100% (3)
- Des Ex Cour de Chimie ElectrochimieDocument21 pagesDes Ex Cour de Chimie ElectrochimieImene GhmrPas encore d'évaluation
- Correction TD Chimie Générale Fiche2 - CópiaDocument10 pagesCorrection TD Chimie Générale Fiche2 - CópiacomboudriPas encore d'évaluation
- T1 S5 Correction ExercicesDocument37 pagesT1 S5 Correction ExerciceskandedianissyPas encore d'évaluation
- 1 1 Ccor Précipitation CuOH2Document3 pages1 1 Ccor Précipitation CuOH2miniar tabassiePas encore d'évaluation
- Corrigé de L'épreuve de Sciences Physiques: Universite C A D DDocument5 pagesCorrigé de L'épreuve de Sciences Physiques: Universite C A D DLindeltaylor DioufPas encore d'évaluation
- 0607 C Exo S VitesseDocument3 pages0607 C Exo S VitesseSeverin LouaPas encore d'évaluation
- Série Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1Document8 pagesSérie Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1chadaPas encore d'évaluation
- TP Chimie PhysiqueDocument19 pagesTP Chimie Physiquemeriem.bouaouda7102Pas encore d'évaluation
- Exercice 2 AbsDocument2 pagesExercice 2 AbsHoucine BendaoudPas encore d'évaluation
- TD 1 PDFDocument4 pagesTD 1 PDFHadeel BensPas encore d'évaluation
- Corrigé Sujet S2 1er Groupe PC Session Normale 2019 1Document7 pagesCorrigé Sujet S2 1er Groupe PC Session Normale 2019 1Mamadou NdiayePas encore d'évaluation
- Aide Chimie GazParfaitDocument2 pagesAide Chimie GazParfaitlina chetouiPas encore d'évaluation
- Corrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Document4 pagesCorrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Riadh MarouaniPas encore d'évaluation
- Aide Chimie GazParfaitEXOdemainDocument2 pagesAide Chimie GazParfaitEXOdemainnarisoarakotovaoPas encore d'évaluation
- 5-État D'équilibre D'un Système Chimique (WWW - Pc1.ma)Document7 pages5-État D'équilibre D'un Système Chimique (WWW - Pc1.ma)Amine ElasriPas encore d'évaluation
- Fiche de TD CHIMIE N°5 GA - 045754Document4 pagesFiche de TD CHIMIE N°5 GA - 045754Juste Landry OngoloPas encore d'évaluation
- F1 Sdevoir Transf Chimiques CorrigeDocument2 pagesF1 Sdevoir Transf Chimiques Corrigejad mamouPas encore d'évaluation
- Exercice Dosage CorrectionDocument2 pagesExercice Dosage CorrectionElouan Berthome LavignottePas encore d'évaluation
- Corrigé - Réactions Chimiques + Acide:BaseDocument12 pagesCorrigé - Réactions Chimiques + Acide:BaseThierryPas encore d'évaluation
- TD 1Document4 pagesTD 1Abdou HajjajiPas encore d'évaluation
- 2003 Polynesie Correction Exo2 Cinetique 2 5ptsDocument2 pages2003 Polynesie Correction Exo2 Cinetique 2 5ptsdansoujosemorelePas encore d'évaluation
- 2c Exos Tableau AvancementDocument5 pages2c Exos Tableau AvancementMahboub SabirPas encore d'évaluation
- TD-cinetique ChimiqueDocument2 pagesTD-cinetique ChimiqueHaytem bossPas encore d'évaluation
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- ds1ts2 2017Document6 pagesds1ts2 2017Yan BelingaPas encore d'évaluation
- 1 - Etat D'équilibre D'un Système ChimiqueDocument7 pages1 - Etat D'équilibre D'un Système ChimiqueTaha BoulmanePas encore d'évaluation
- UAA6 - Cinétique - Corrigé Des ExercicesDocument6 pagesUAA6 - Cinétique - Corrigé Des ExercicesThomas CocoPas encore d'évaluation
- 2009 Bac PC Ter s2 CorrigeDocument6 pages2009 Bac PC Ter s2 CorrigeLindoucha DadouchaPas encore d'évaluation
- TD 4 Avec Corrigé de Chimie Des SolutionsDocument7 pagesTD 4 Avec Corrigé de Chimie Des SolutionsETUSUP100% (1)
- Suivi Temporel D - Une TRSF ChimiqueDocument4 pagesSuivi Temporel D - Une TRSF ChimiquemedPas encore d'évaluation
- Kit Interphone Notice Bticino DomomatDocument20 pagesKit Interphone Notice Bticino DomomatMc ZraikaPas encore d'évaluation
- Cours Acoustique Des LieuxDocument25 pagesCours Acoustique Des LieuxbobPas encore d'évaluation
- Fiche Pédagogique DahbiDocument2 pagesFiche Pédagogique Dahbisouhail kadmari100% (1)
- La Qualite Denergie Les HarmoniquesDocument23 pagesLa Qualite Denergie Les HarmoniquesAbdelkrim IDIRPas encore d'évaluation
- Guide de Construction ParasismiqueDocument37 pagesGuide de Construction ParasismiqueratzitPas encore d'évaluation
- Exercice Diode PDFDocument24 pagesExercice Diode PDFanon_370127034100% (1)
- DiagraphieDocument3 pagesDiagraphieنضال نضالPas encore d'évaluation
- Economie D'énergie Sur Les Installations D'air CompriméDocument57 pagesEconomie D'énergie Sur Les Installations D'air CompriméAyoub Mamaoui100% (1)
- Cours Forces CentralesDocument6 pagesCours Forces Centralesmohaait190Pas encore d'évaluation
- Travail R Alis Par: Ben Dhief Fourat Ksiksi Hatten Samet Firas Arbi Anis Encadrant: M.Ben Chiekh MaherDocument15 pagesTravail R Alis Par: Ben Dhief Fourat Ksiksi Hatten Samet Firas Arbi Anis Encadrant: M.Ben Chiekh Maherg TSPas encore d'évaluation
- Exo Moteur A Courant Continu PDFDocument2 pagesExo Moteur A Courant Continu PDFanas sellam100% (1)
- RVP361 Instructions D Installation FR PDFDocument12 pagesRVP361 Instructions D Installation FR PDFe-genieclimatique.comPas encore d'évaluation
- QCM - Pim - 2020 3Document5 pagesQCM - Pim - 2020 3Jaoui RachidPas encore d'évaluation
- Géothermie PrépaDocument37 pagesGéothermie PrépaÉnoch Kazimoto JuniorPas encore d'évaluation
- Cours OnduleurDocument7 pagesCours Onduleurmasmoudimohamed50% (2)
- Evaluation Site Maritime VFDocument103 pagesEvaluation Site Maritime VFBenhar Imad100% (1)
- ملحق الفرضيات العلائقية والفروق وحجم الأثرDocument7 pagesملحق الفرضيات العلائقية والفروق وحجم الأثرAbderrahmane CherabaPas encore d'évaluation
- DS Fonctions DeriveesDocument1 pageDS Fonctions DeriveesKarim NdahoqPas encore d'évaluation
- Packb Cuc J1zni S R4idc8 107466 Ia 01Document2 pagesPackb Cuc J1zni S R4idc8 107466 Ia 01Vegard SømliøyPas encore d'évaluation
- ONDESDocument34 pagesONDESMarganice NgPas encore d'évaluation
- 18-210-Dossier Crépine 104D - Non SoumisDocument49 pages18-210-Dossier Crépine 104D - Non SoumisAzee TitouPas encore d'évaluation
- Manuel de Montage Et D'utilisationDocument42 pagesManuel de Montage Et D'utilisationAurélien GAUTRONPas encore d'évaluation
- CyberPower NI DS US30010-40CNG FR FR v2Document2 pagesCyberPower NI DS US30010-40CNG FR FR v2Anonymous oyUAtpKPas encore d'évaluation
- Memoire Master2Document43 pagesMemoire Master2lazhar beghouraPas encore d'évaluation
- Modulation AngulaireDocument13 pagesModulation Angulairemohammed el azhari100% (2)
- Ahmed Lesfari - Variables Complexes Cours Et Exercices Corrigés-Ellipses Marketing (2014)Document435 pagesAhmed Lesfari - Variables Complexes Cours Et Exercices Corrigés-Ellipses Marketing (2014)Eddahbi Ettahiri100% (1)
- Bazarov - Thermodynamique - Mir - 1989Document409 pagesBazarov - Thermodynamique - Mir - 1989Hicham YangPas encore d'évaluation
- doctoratLMD 2019-2020 Univ-Guelma PDFDocument4 pagesdoctoratLMD 2019-2020 Univ-Guelma PDFokba wuniPas encore d'évaluation
- BAC-2019 - Série C - Eléments de Réponse Et Grille-2-1Document11 pagesBAC-2019 - Série C - Eléments de Réponse Et Grille-2-1Bon AvenirPas encore d'évaluation
- Prevision de La Geometrie Des MoleculesDocument25 pagesPrevision de La Geometrie Des MoleculesNassima El MahniPas encore d'évaluation